Hausarztmedizin: Diagnostik der Demenz
Interessengebiete: Allgemeinmedizin und Innere Medizin, Neurologie, Geriatrie
Fortbildungsinhalte und Lernziele
Mit der zunehmenden Überalterung der Gesellschaften in den westlichen Industrieländern steigt die Inzidenz der altersbezogenen Erkrankungen an. Hierzu zählen auch
alle Krankheiten, die mit einem Abbau der zerebralen Funktionsfähigkeit einhergehen, insbesondere die Demenzerkrankungen.
Für Fachärztinnen und Fachärzte der Nervenheilkunde oder betreuende Hausärztinnen und Hausärzte stellt der vermeintliche Rückgang der kognitiven Fähigkeiten einen häufigen Beratungsanlass dar, so dass die Kenntnis der diagnostischen und therapeutischen Möglichkeiten für eine möglichst zielführende Betreuung der PatientInnen unerlässlich ist.
Diese Fortbildung ermöglicht es, das Wissen über die Demenzen zu erweitern und individuell die Weichen für das treffende Behandlungsangebot zu stellen.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Grundlagen der Demenzerkrankungen
- Haupttypen der Demenz
- Klinische Diagnostik von Demenzerkrankungen
- Anamnese und klinische Untersuchung
- Genetische Aspekte und Diagnostik
- Differentialdiagnose
- Praktischer Leitfaden zur Umsetzung der S3-Leitlinien
- Zusammenfassung und Aktuelle Entwicklungen
- Literatur
Einleitung
Mit der zunehmenden Überalterung der Gesellschaften in den westlichen Industrieländern steigt die Inzidenz der altersbezogenen Erkrankungen an. Hierzu zählen auch alle Krankheiten, die mit einem Abbau der zerebralen Funktionsfähigkeit einhergehen, insbesondere die Demenzerkrankungen [1].
Für FachärztInnen der Nervenheilkunde oder betreuende HausärztInnen stellt der vermeintliche Rückgang der kognitiven Fähigkeiten einen häufigen Beratungsanlass dar, so dass die Kenntnis der diagnostischen und therapeutischen Möglichkeiten für eine möglichst zielführende Betreuung der PatientInnen unerlässlich ist.
Diese Fortbildung ermöglicht es, das Wissen über die Demenzen zu erweitern und individuell die Weichen für das treffende Behandlungsangebot zu stellen.
Grundlagen der Demenzerkrankungen
Definition und Klassifikation von Demenz
Demenz ist ein allgemeiner Begriff für Erkrankungen, die durch den chronischen und progressiven Abbau von kognitiven Fähigkeiten gekennzeichnet sind. Dies betrifft ins- besondere das Gedächtnis, das Denkvermögen, die Orientierung, das Verständnis, die Rechenfähigkeit, das Lernvermögen, die Sprache und das Urteilsvermögen [4]. Es gibt verschiedene Klassifikationssysteme für Demenz. Das Diagnostic and Statistical Manual of Mental Disorders, Fifth Edition (DSM-5), definiert beispielsweise bestimmte Kriterien für die Diagnose von Demenz, die als „Major Neurocognitive Disorder“ bezeichnet wird [2].
Epidemiologie
Weltweit sind etwa 50 Millionen Menschen von Demenz betroffen, und es gibt jährlich fast 10 Millionen Neuerkrankungen [1]. In Deutschland sind es aktuell ca. 1,8 Millionen Menschen [57]. Die Prävalenz von Demenz steigt mit dem Alter, wobei die Häufigkeit unter den über 65-Jährigen etwa 5-8 % beträgt und sich mit jedem zusätzlichen Le- bensjahrzehnt verdoppelt [5]. Aufgrund des globalen demografischen Wandels und der Zunahme der älteren Bevölkerung wird erwartet, dass die Zahl der Demenzerkrankun- gen in den kommenden Jahrzehnten weiter zunehmen wird. Dies wird begünstigt z. B. durch die steigende Zahl an DiabetikerInnen, da das Risiko für DiabetikerInnen an einer Demenz zu erkranken insbesondere bei insuffizienter Blutzucker-Einstellung deutlich erhöht ist [6]. Darüber hinaus tritt bei verminderter körperlicher Aktivität, Nikotinabusus, dem gleichzeitigen Vorliegen einer Depression sowie auch bei einem niedrigen Bildungsgrad häufiger eine demenzielle Erkrankung auf [6].
Haupttypen der Demenz
Alzheimer-Demenz
Alzheimer-Demenz ist die häufigste Form der Demenz und macht etwa 60-80 % aller Demenzfälle aus [7]. Sie ist durch den Verlust von Nervenzellen im Gehirn gekennzeichnet, der durch die Ablagerung von Beta-Amyloid-Proteinplaques und Tau-Protein-Fibrillen verursacht wird und stellt das Endstadium einer über viele Jahre verlaufende Krankheitsentwicklung dar [8]. Die Symptome umfassen Gedächtnisverlust, Sprachstörungen, Orientierungsprobleme und Schwierigkeiten bei alltäglichen Aufgaben. Üblicher- weise durchläuft die Alzheimer-Demenz vier Stadien: das Prodromalstadium, die frühe, die mittlere und die späte Phase. Als Prodromalstadium werden Zeiten episodischer Gedächtnisstörungen gesehen, aus denen sich bei gleichzeitigem Vorliegen neuropathischer Biomarker in ca. 90 % eine Demenz entwickelt, ohne diese Biomarker kommt es nur in ca. 10 % zur Ausbildung einer Demenz [9]. Wichtig ist auch die Tatsache, dass die dominant vererbte Alzheimer-Krankheit (DIAD) im Vergleich zur sporadischen Form selten auftritt [8]. Zur Therapie stehen in den verschiedenen Phasen unterschiedliche Medikamente zur Verfügung.
Vaskuläre Demenz
Die vaskuläre Demenz ist mit ca. 20 % der Betroffenen die zweithäufigste Demenzform und wird durch Schäden an den Blutgefäßen im Gehirn verursacht, die zu einem vermin- derten Blutfluss und Sauerstoffmangel in bestimmten Gehirnregionen führen. Dies kann durch Schlaganfälle oder kleinere Gefäßschäden geschehen [10], insbesondere durch die mikroangiopathischen Veränderungen bei Diabetes mellitus ist das Risiko an einer vaskulären Demenz zu erkranken um das Zweifache erhöht, Frauen betrifft dies häufiger als Männer [6]. Symptome können Gedächtnisprobleme, Konzentrationsschwierigkeiten und Probleme mit dem Denken und Planen umfassen. Die Therapie besteht bei dieser Demenz-Form in der Behandlung der Gefäßveränderungen bzw. Risikofaktoren.
Mischform-Demenz
Bei den Betroffenen finden sich sowohl Ablagerungen wie bei der Alzheimer-Demenz
als auch Gefäß-Veränderungen wie bei der vaskulären Demenz. Zu dieser Gruppe zählen bis zu 15 % der PatientInnen.
Frontotemporal-Lappen-Demenz (FTLD)
Die Frontotemporal-Lappen-Demenz betrifft hauptsächlich die Frontallappen und Temporallappen des Gehirns, so dass im MRT dort eine verstärkte Atrophie gesehen werden
kann [11]. Es gibt verschiedene Unterformen von FTLD, einschließlich der Verhaltensvariante und der primär progressiven Aphasie. Die FTLD ist durch Veränderungen im Verhalten und der Persönlichkeit (behaviour variants, eher bei Veränderungen im Frontallappen) und der Sprache (eher bei Veränderungen im Temporallappen) gekennzeichnet
[12]. Diese PatientInnen fallen auf durch Perseverationen oder indem sie zum Beispiel immer das Gleiche essen wollen. Im Spätstadium der temporallappen-betonten Demenz fällt eine progrediente semantische und nicht-flüssige Aphasie auf. Bisher wurde für diese Demenz-Form noch keine kausale Therapie gefunden.
Lewy-Körperchen-Demenz (LKD)
Die Lewy-Körperchen-Demenz ist durch das Vorhandensein von Lewy-Körperchen (abnormen Protein-ablagerungen) in den Nervenzellen des Gehirns gekennzeichnet. Diese
Demenzform ist mit Fluktuationen in der Wachsamkeit und Aufmerksamkeit, visuellen Halluzinationen und Parkinsonismus verbunden [13]. Auch hierfür ist noch keine überzeugende kausale Therapie verfügbar, es haben sich jedoch Hinweise auf eine leichte positive Beeinflussung von Verhalten und Kognition durch Medikamente gezeigt.
Parkinson-Disease-Demenz (PDD)
Parkinson-Disease-Demenz tritt bei Patienten mit Parkinson-Krankheit auf und entwickelt sich in der Regel im späteren Verlauf der Erkrankung. Symptome umfassen Gedächtnisverlust, Schwierigkeiten beim Lösen von Problemen, Schwierigkeiten bei der Aufmerksamkeitskontrolle und Veränderungen im Sozialverhalten [14]. Zur Behandlung
wird die Gabe von Rivastigmin empfohlen.
Die beiden letztgenannten Sonderformen der Demenz werden wie auch der Morbus Parkinson und andere neurodegenerative Erkrankungen zu den Synucleinopathien gezählt, bei denen vermehrt intrazerebrale Ablagerungen von Alpha-Synuclein gefunden wurden.
Zu erwähnen sei hierbei auch das Auftreten einer Demenz als Komorbidität oder Folgeerkrankung bei
- anderen neurodegenerativen Erkrankungen,
- Prionenerkrankungen (z. B. Creutzfeldt-Jacob-Krankheit),
- bei entzündlichen ZNS-Erkrankungen,
- nach Traumata/Traumatisierungen, oft als posttraumatische Belastungsstörung
nach life-events (z. B. Pensionierung, Verlust einer sozialen Rolle) [16], - bei Hirntumoren,
- bei metabolisch-toxischen Erkrankungen (z. B. hepatische Enzephalopathie bei Leberzirrhose) [17].
Klinische Diagnostik von Demenzerkrankungen
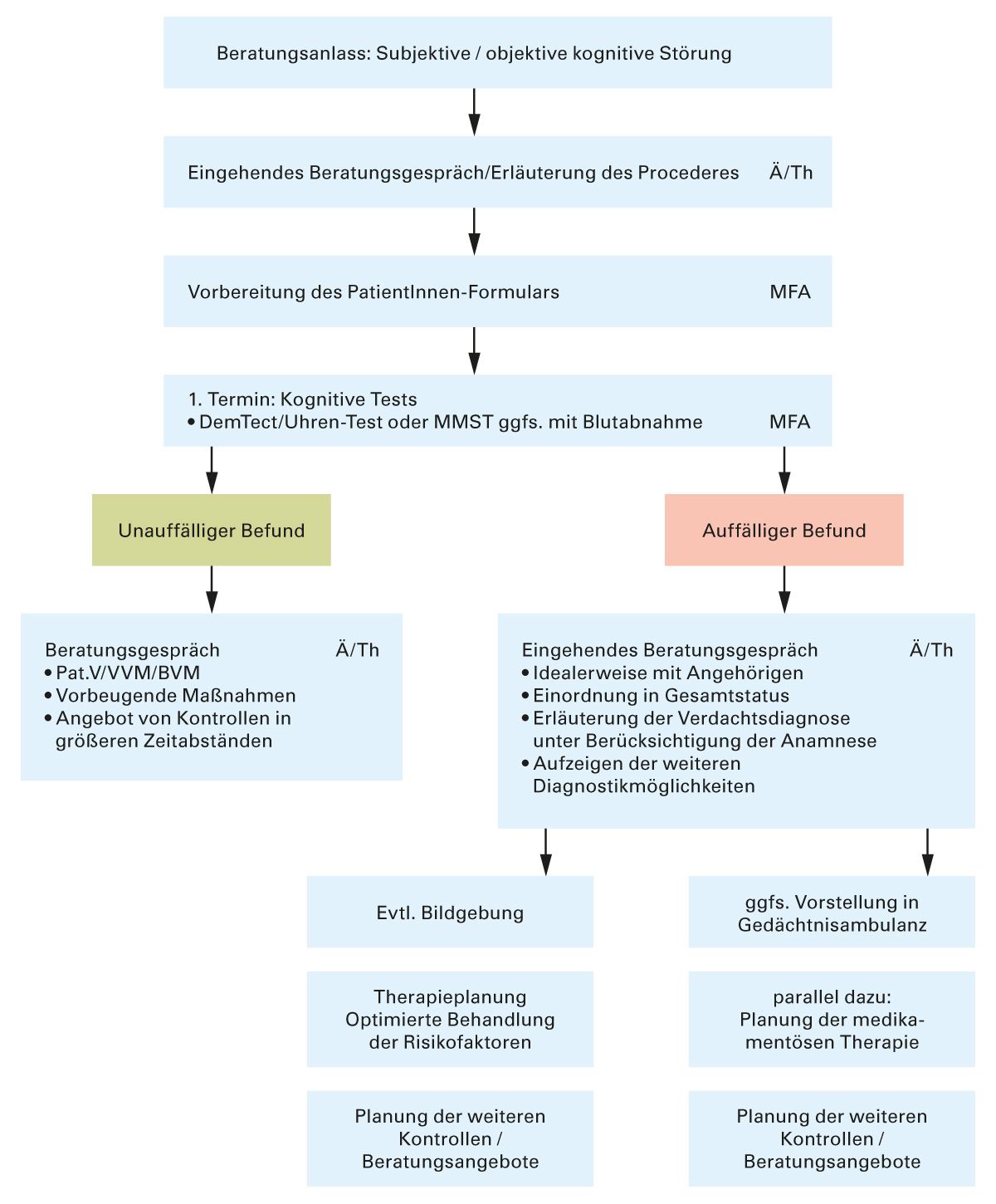
Die Diagnose einer Demenzerkrankung ist ein mehrstufiger Prozess, der verschiedene Methoden und Werkzeuge umfasst. Eine genaue Diagnose ist wichtig für das Verständnis der zugrunde liegenden Ursache der Symptome und für die Entwicklung eines effektiven Behandlungs- und Betreuungsplans. Empfehlenswert ist die Erstellung eines
eigenen Algorithmus für die Abklärung der Verdachtsdiagnose einer Demenz, unabhängig vom Behandlungsanlass (siehe Abb. 1).
Anamnese und klinische Untersuchung
Eine sorgfältige Anamneseerhebung ist auch hier die Grundlage für die weitergehende Behandlung. Hierbei haben die subjektiv empfundenen Gedächtnisstörungen nur eine
geringe Spezifität und Sensitivität [18]. Wichtiger ist neben der Eigenanamnese die rücksichtsvolle Erhebung der Familienanamnese und insbesondere der Fremdanamnese
und der Sozialanamnese. Es sollte auch im Verlauf nach traumatischen Ereignissen in der Kindheit gefragt werden, um verschüttete Erinnerungen aufzudecken, die zu einer
unterschwelligen posttraumatischen Belastungsstörung geführt haben (z. B. Ereignisse in Kriegszeiten) [16]. Das Gespräch mit Familienmitgliedern oder Betreuungspersonen
kann auch wertvolle Einblicke in die Symptomatik und den funktionellen Status des Patienten geben.
Die körperliche Untersuchung und Exploration sollte internistisch orientiert kardiovaskuläre, metabolische und endokrinologische Ursachen erkennen lassen, neurologisch
nach extrapyramidalen Störungen (wie beim Morbus Parkinson), Gangbild-Störungen (wie beim Normaldruckhydrozephalus), Paresen, Atrophien und Okulomotorikstörungen suchen und psychiatrisch Persönlichkeitsstörungen, Veränderungen des Affekts, Wahninhalte und Halluzinationen herausfinden [19].
Wichtig sind hierbei auch geriatrische Assessment-Untersuchungen, die Abklärung einer Sturzgefahr (z. B. Timed-up-and-go-Test) und die Betrachtung des Ernährungsstatus zur Bestimmung eines Frailty-Syndroms oder einer Sarkopenie [20].
Kognitive Tests und Skalen zur Beurteilung des Schweregrades
Kognitive Tests sind ein wichtiges Instrument zur Beurteilung der kognitiven Funktionen, für die einzelnen Phasen der Demenz haben sich unterschiedliche Testungen bewährt.
Der DemTect eignet sich besonders als Screening-Untersuchung für das Prodromalstadium und die frühe Phase der Demenz (EOD = early-onset dementia). Der Mini-MentalStatus-Test (MMST) und der Montreal Cognitive Assessment (MoCA) sind gängige Screening-Tests zur Erkennung kognitiver Beeinträchtigungen [21] für spätere Phasen der Demenz und finden dadurch als Verlaufsuntersuchung Anwendung. Der Uhren-Test als Teil des MoCA gibt aber auch schon in den frühen Phasen der Demenz wertvolle
Hinweise auf Störungen der Alltagskompetenz der PatientInnen. Des Weiteren werden spezialisierte Skalen wie die Clinical Dementia Rating (CDR) Skala zur Beurteilung des
Schweregrades der Demenz eingesetzt [22].
Neuropsychologische Untersuchung
Eine ausführliche neuropsychologische Untersuchung kann dazu beitragen, spezifische kognitive Defizite zu identifizieren und abzugrenzen, welche Domänen betroffen sind.
Dies kann auch wichtige Informationen zur Differenzierung zwischen verschiedenen Formen der Demenz liefern [23]. Hierbei wären zu nennen die umfangreiche neurophysiological assessment battery des CERAD-plus, die Untersuchung der Herzratenvariabilität und die Ableitung der vagus-evozierten Potentiale zur Detektion einer leichten kognitiven Einschränkung (MCI = mild cognitive impairment) [49].
EEG
Da eine erhöhte Prävalenz der Kombination insbesondere der Alzheimer-Demenz und der Frontotemporal-Lappen-Demenz mit der Epilepsie bekannt ist, sollte über Oberflächen-EEGs und eventuell sogar invasive EEGs das Vorhandensein einer Epilepsie überprüft werden, da eine konsequente Behandlung der Epilepsie auch einem beschleunigten kognitiven Abbau entgegenwirken kann [24].
Bildgebung (CT, MRT, PET)
Bildgebende Verfahren sind entscheidend für die Diagnose von Demenz sowie für die Detektion behandelbarer Ursachen und helfen, strukturelle und funktionelle Veränderungen im Gehirn zu erkennen.
Die Magnetresonanztomographie (MRT) wird häufig zur Darstellung von Gehirnatrophien (bei Alzheimer-Demenz insbesondere im medialen Temporallappen [25]) verwendet, während die craniale Computertomographie (cCT) Schlaganfälle oder andere Veränderungen identifizieren kann, die auf eine vaskuläre Demenz hinweisen könnten
[26], z. B. disseminierte Mikro-Infarkte und White-Matter-Läsionen, wie die myelinisierten Bereiche im Gehirn als Zeichen einer Atrophie bezeichnet werden.
Die Positronenemissionstomographie (PET) kann verwendet werden, um den Stoffwechsel von Glukose im Gehirn zu verfolgen, was bei Alzheimer-PatientInnen oft
verändert ist [27,28] sowie zur Darstellung der veränderten Amyloid- und Tau-ProteinVerteilung im Gehirn von Alzheimer-PatientInnen [29].
In der Bildgebung kann außerdem eine DaTSCAN hilfreich sein, um nuklearmedizinsch eine verminderte Dopamin-Rezeptor-Dichte nachzuweisen, die sowohl bei PDD
als auch bei LKD häufig sind [30].
Die Nahinfrarotspektroskopie NIRS hilft über die Detektion von Veränderungen niederfrequenter Oszillationen im frontalen und parietalen Cortex in Kombination mit humangenetischen Untersuchungen in der Frühdiagnostik einer dementiellen Erkrankung.
Die Interpretation von Veränderungen in der Bildgebung erfordert allerdings eine
große Expertise, wie sie z. B. in Gedächtnisambulanzen zu erwarten ist [9].
Liquordiagnostik
Die Liquordiagnostik kann zur Identifizierung von Neurodegenerations-Biomarkern für Alzheimer-Demenz, wie zum Beispiel verschiedener Beta-Amyloide und Tau-Proteine,
verwendet werden [31]. Dies kann besonders hilfreich sein, wenn die Diagnose auf der Grundlage von klinischen Symptomen und Bildgebung unsicher ist. Neuere Forschungen beschäftigen sich mit der Rolle des Proteoms Arl8b, welches im Liquor nachweisbar ist und am Abbau von Beta-Amyloid-Aggregaten beteiligt ist [51].
Labordiagnostik
Zunächst ist sie wichtig im Rahmen der klinisch-internistischen Differentialdiagnostik, hier sollten folgende Werte vorliegen: kleines Blutbild, Natrium, Kalium, Nüchtern-BZ,
TSH basal, CRP, GOT, GPT, GGT, LDH, Kreatinin, Harnstoff, eventuell können diese ergänzt werden durch: Calcium, HbA1c, Vitamin B12, Vitamin B1/6.
Darüber hinaus kann im Weiteren in bestimmten, ausgewählten Fällen mit der humangenetischen Bestimmung des APO-E4-Genotyps nach einem Risikofaktor für eine
Spätform der Alzheimer-Demenz (late onset alzheimer’s dementia) gesucht werden. Diese Untersuchung ist nicht für die Primärdiagnostik geeignet, da in frühen Stadien der
Demenz Verhaltensauffälligkeiten durch Aktivierung anderer Hirnareale kompensiert werden. Auch sind blutbasierte Biomarker-Alzheimer-Test bereits weit entwickelt. Für diese Frühformen der Demenz besteht bereits ein Therapieansatz mit monoklonalen Antikörpern wie Aducanumab und Lecanemab, so dass diese Blutuntersuchungen prognostisch häufiger zur Anwendung kommen werden.
Genetische Aspekte und Diagnostik
Die Genetik wird in Zukunft eine wichtigere Rolle bei Demenzerkrankungen spielen, da das Verständnis der genetischen Faktoren dazu beitragen kann, das Risiko für eine
Demenz zu bestimmen und eine Präzisierung der Diagnose und damit eine gezielte Behandlung vornehmen zu können.
Überblick über genetische Faktoren bei Demenz
Es gibt sowohl monogenetische als auch komplexe genetische Einflüsse bei Demenz. Monogenetische Formen sind durch Mutationen in einem bestimmten Gen charakterisiert, während komplexe genetische Faktoren das Zusammenspiel mehrerer Gene betreffen. Das Apolipoprotein E (ApoE) ε4 Allel ist der stärkste genetische Risikofaktor für die spät einsetzende Alzheimer-Krankheit [18]. Andere Gene, wie APP, PSEN1 und PSEN2, sind mit der früh einsetzenden Form der Krankheit verbunden.
Indikationen und Vorgehen bei genetischer Diagnostik
Die genetische Diagnostik kann in Fällen von familiär gehäufter Demenz, bei untypischem klinischem Verlauf oder bei frühem Krankheitsbeginn in Betracht gezogen werden. Die
Diagnostik umfasst die genetische Analyse mittels Next-Generation-Sequencing, um spezifische Mutationen zu identifizieren [33]. Es ist wichtig, dass die Entscheidung zur genetischen Diagnostik sorgfältig abgewogen wird und in Zusammenarbeit mit genetischen Beratern erfolgt.
Genetische Beratung
Eine genetische Beratung ist ein wichtiger Teil des Prozesses der genetischen Diagnostik. Genetische Berater unterstützen Patienten und ihre Familien dabei, die genetischen Informationen zu verstehen, informierte Entscheidungen zu treffen und sich auf mögliche Ergebnisse vorzubereiten [34]. Die genetische Diagnostik wirft ethische Fragen auf und führt zu datenschutzrechtlichen Bedenken. Wichtig ist die Gewährleistung der Privatsphäre und Vertraulichkeit der genetischen Informationen [35].
Differentialdiagnose
Die Kenntnis der Differentialdiagnosen ist ein entscheidender Schritt schon zu Beginn des diagnostischen Prozesses von Demenzerkrankungen. Gezielte Fragen im Verlauf der
Anamneseerhebung und Hinweise bei der klinischen Untersuchung helfen diagnostische Maßnahmen auszuwählen und speziellere Untersuchungen hintanzustellen. Ein
genaues Vorgehen gegebenenfalls auch mit einer Check-Liste kann eine wichtige Arbeit leisten hin zu einer zielgerichteten Therapie, soweit diese möglich und sinnvoll ist. Hilfreich ist z. B. auch ein Formular wie das folgende (Abb. 4).
Wie bereits oben erwähnt, gibt es eine Reihe von Erkrankungen oder passagerer Gesundheitsstörungen, die mit einer Verminderung der kognitiven Fähigkeiten einhergehen und durch einfache Untersuchungen festgestellt werden können. Dazu zählen auch psychische Erkrankungen, die nicht nur vorübergehend zu einer Persönlichkeits- und
Aufmerksamkeitsveränderung führen können (z. B. Pseudodemenz bei der Depression) [36]. Daher sollte gegebenenfalls eine psychotherapeutische Exploration zur differentialdiagnostischen Klärung mit in Betracht gezogen werden [20].
Auch die Einwirkung von Toxinen sowie eine Fehldosierung von Medikamenten oder eine Polypharmazie bergen das Risiko einer kognitiven Einschränkung [37].
Praktischer Leitfaden zur Umsetzung der S3-Leitlinien
Interpretation und Anwendung der S3-Leitlinien
Die S3-Leitlinien bieten evidenzbasierte Empfehlungen für die Diagnose und Behandlung von Demenzerkrankungen. Sie sind in Deutschland entwickelt und basieren auf einer sorgfältigen Analyse der aktuellen wissenschaftlichen Literatur und Expertenmeinungen [38]. Bei der Anwendung der S3-Leitlinien ist es wichtig, diese im Kontext des individuellen Patienten zu interpretieren und neben den PatientInnen auch die Betreuungspersonen miteinzubeziehen [39].
Fallbeispiele zur Illustration der Anwendung von S3-Leitlinien in der Praxis
Fallbeispiel 1: Alzheimer-Demenz
Ein 72-jähriger Patient wird von seiner Familie zu einer neurologischen Untersuchung gebracht, weil er zunehmend vergesslich ist und Schwierigkeiten hat, tägliche Aufgaben zu bewältigen. Unter Berücksichtigung der S3-Leitlinien wird eine ausführliche Anamnese erhoben, gefolgt von kognitiven Tests. Nachdem eine Alzheimer-Demenz diagnostiziert wurde, empfehlen die S3-Leitlinien, dass eine medikamentöse Therapie mit Cholinesterasehemmern in Betracht gezogen werden sollte, was auch der Familie erklärt wird [40].
Fallbeispiel 2: Vaskuläre Demenz
Eine 65-jährige Patientin mit Diabetes und Bluthochdruck klagt über Gedächtnisprobleme und Konzentrationsschwäche. Die S3-Leitlinien legen nahe, bei Patienten mit
solchen Risikofaktoren vaskuläre Ursachen zu berücksichtigen. Eine MRT des Gehirns zeigt mehrere kleine Infarkte. Die Diagnose vaskuläre Demenz wird gestellt, und es wird
empfohlen, die Risikofaktoren aggressiv zu behandeln, um das Fortschreiten der Erkrankung zu verlangsamen [41].
Fallbeispiel 3: Gemischte Demenz
Ein 84-jähriger, dem Hausarzt schon lange bekannter Patient fällt dem Praxisteam durch eine zunehmende situative Verwirrung auf. Aus der Eigenanamnese sind bereits mehrfache, passagere zerebrale Durchblutungsstörungen mit Nachweis von disseminierten Infarkten bekannt. Die Kognitionstests zeigen zunächst eine MCI, bei der Wiederholung sechs Monate später fällt das Ergebnis schlechter aus und beschreibt eine leichte Demenz. Nach den S3-Leitlinien wird bei Verdacht auf vaskuläre Demenz zunächst die Einstellung der kardiovaskulären Risikofaktoren intensiviert, aber aufgrund des Fortschreitens der kognitiven Einschränkungen kann nun auch die Behandlung mit einem Acetylcholinesterase-Hemmer begonnen werden. Weitere bildgebende Maßnahmen werden wegen fehlender Konsequenz unterlassen, durch Wiederholung der kognitiven
Tests in abgewandelter Form und regelmäßigen Abständen wird bei zunehmender Verschlechterung gegebenenfalls Memantin als Antidementivum ergänzt.
Erstellung von Versorgungsplänen basierend auf Diagnosen
Nach der Diagnosestellung basierend auf den S3-Leitlinien ist es wichtig, einen individualisierten Versorgungsplan zu erstellen. Dieser Plan sollte sowohl medikamentöse
als auch nicht-medikamentöse Interventionen enthalten. Zu den nicht-medikamentösen Interventionen gehören beispielsweise Gedächtnistraining, Ergotherapie und Physiotherapie [42].
Der Versorgungsplan sollte auch das soziale Umfeld des Patienten berücksichtigen und die Angehörigen in die Betreuung einbeziehen. Bei der Erstellung des Plans ist es
wichtig, realistische Ziele zu setzen und regelmäßige Nachuntersuchungen durchzuführen, um den Plan bei Bedarf anzupassen [43]. Entscheidend ist hierbei auch die vorsichtige Information hinsichtlich einer perspektivischen Übergabe der Gesundheitsfürsorge in fremde Hände, so dass frühzeitig eine Aufklärung zu einer Patientenverfügung, einer Vorsorgevollmacht und einer Betreuungsverfügung erfolgen sollte.
Schließlich ist es entscheidend, den Patienten und seine Angehörigen über die Erkrankung aufzuklären und ihnen bei der Bewältigung zu helfen. Außerdem sollten auch
Informationen über Selbsthilfegruppen und andere Unterstützungsmöglichkeiten zur Verfügung gestellt werden [43].
Zusammenfassung und Aktuelle Entwicklungen
Zusammenfassung der Hauptpunkte
Diese Fortbildung gab einen umfassenden Überblick über das Thema Demenz, seine
Diagnostik und das Behandlungsmanagement. Die Demenz ist eine Erkrankung, die
durch kognitive Beeinträchtigungen charakterisiert ist, und wir haben die verschiedenen
Typen der Demenz besprochen [1].
Es wurde auch auf die Bedeutung der genauen Anamnese und der klinischen Diagnostik eingegangen, die die Grundlage für ein effektives Management und die Betreuung von Patienten mit Demenz ist [2]. Die genetischen Aspekte und die Bedeutung
der genetischen Diagnostik wurden erörtert, ebenso wie die differentialdiagnostischen
Überlegungen [26,35]. Es wurde auch ein Überblick über spezielle diagnostische Verfahren gegeben [29].
In der Praxis ist die Anwendung von S3-Leitlinien entscheidend für eine standardisierte Herangehensweise an die Diagnose und Behandlung [37], hierbei kann auch
eine Check-Liste Unterstützung bieten. Wir haben darüber gesprochen, wie man einen Versorgungsplan erstellt und die Bedeutung der Einbeziehung von Patienten und
Angehörigen in den Behandlungsprozess [43]. Zuletzt wird ein Algorithmus als Handlungsempfehlung für die Behandlung von PatientInnen mit kognitiven Einschränkungen
angeführt.
Aktuelle Forschung und neue Entwicklungen in der Diagnostik von Demenzerkrankungen
Es gibt eine ständig wachsende Forschung in den Bereichen Diagnose und Behandlung
von Demenz. Eine der aufregenden Entwicklungen in der Diagnostik ist die Nutzung von Biomarkern. Blutbiomarker wie Neurofilament-Leichtketten (NfL) und Amyloid-beta
könnten die Früherkennung der Alzheimer-Demenz [44,45] und der FTLD [45] verbessern.
Darüber hinaus werden auch Fortschritte in der Bildgebung gemacht. Die Tau-PETBildgebung, zum Beispiel, ermöglicht es, Tau-Proteine im Gehirn sichtbar zu machen,
was bei der Diagnose von Alzheimer entscheidend sein kann [46].
Hinsichtlich der Behandlung gibt es auch neue Therapieansätze. Die Entwicklung von Antikörpern gegen Amyloid-beta und Tau-Proteine könnten potenziell eine neue
Generation von Medikamenten für die Behandlung von Alzheimer darstellen [47].
Herausforderungen und Möglichkeiten für die Zukunft
Die alternde Bevölkerung stellt eine Herausforderung für das Gesundheitswesen dar, da die Prävalenz von Demenzerkrankungen mit zunehmendem Alter ansteigt [12]. Eine der
größten Herausforderungen ist neben der Entwicklung effektiver Therapien zur Verlangsamung oder Umkehrung des Krankheitsverlaufs auch die individuelle und adäquate
Versorgung der PatientInnen sowohl zu Beginn als auch im Endstadium der Demenz.
Hier bleibt die Stigmatisierung von Demenz ein bedeutendes Problem, welches die frühzeitige Diagnose und Behandlung erschweren kann [48]. Es ist wichtig, dass es eine kontinuierliche Aufklärung der Öffentlichkeit gibt und dass Ressourcen zur Unterstützung von PatientInnen und Familien bereitgestellt werden.
Zusammenfassend lässt sich sagen, dass es von entscheidender Bedeutung ist, dass sich Fachleute zum einen kontinuierlich fortbilden, um auf dem neuesten Stand
der Forschung zu bleiben, zum anderen aber auch dass sie die erworbenen Kenntnisse in den Praxisalltag einbringen und für eine bestmögliche Versorgung in umsetzbarer
Form anbieten.
Literaturverzeichnis
- World Health Organization. (2019). Dementia. Retrieved from https://www.who.int/news-room/fact-sheets/detail/dementia
- American Psychiatric Association. (2013). Diagnostic and Statistical Manual of Mental Disorders (5th ed.). Arlington, VA: American Psychiatric Publishing.
- Sorbi, S., Hort, J., Erkinjuntti, T., Fladby, T., Gainotti, G., Gurvit, H., … & Scheltens, P. (2012). EFNS-ENS Guidelines on the diagnosis and management of disorders associated with dementia. European Journal of Neurology, 19(9), 1159-1179.
- World Health Organization. (2017). Dementia.
- Prince, M., Wimo, A., Guerchet, M., Ali, G., Wu, Y., & Prina, M. (2015). World Alzheimer Report 2015: The Global Impact of Dementia: An analysis of prevalence, incidence, costs and trends. Alzheimer‘s Disease International.
- Zeyfang, A. (2017). Diabetes und Kognition – Prädisposition zur Demenz. Perspektiven der Diabetologie 02/2017, 20-21.
- Alzheimer‘s Association. (2020). Alzheimer‘s disease facts and figures. Alzheimer‘s & Dementia, 16(3),391-460.
- Müller-Sarnowski, F., Levin, J., Danek, A., Laske, Chr., Preische, O., Jucker, M. (2015). Alzheimer- Wie man nach einer kausalen Therapie sucht. Perspektiven der Neurologie 01/2015, 28.
- Jessen, F. et al (2023): Früherkennung von Demenz – Gedächtnisambulanzen mit Kernkompetenz für Alzheimer. Deutsches Ärzteblatt, 120/18, A 816-820.
- O‘Brien, J. T., & Thomas, A. (2015). Vascular dementia. The Lancet, 386(10004), 1698-1706.
- Rascovsky, K., Hodges, J. R., Knopman, D., Mendez, M. F., Kramer, J. H., Neuhaus, J., … & Miller, B. L. (2011). Sensiti – vity of revised diagnostic criteria for the behavioural variant of frontotemporal dementia. Brain, 134(9), 2456-2477.
- Bang, J., Spina, S., & Miller, B. L. (2015). Frontotemporal dementia. The Lancet, 386(10004), 1672-1682.
- McKeith, I. G., Boeve, B. F., Dickson, D. W., Halliday, G., Taylor, J. P., Weintraub, D., … & Kosaka, K. (2017). Diagnosis and management of dementia with Lewy bodies: Fourth consensus report of the DLB Consortium. Neurology, 89(1), 88-100.
- Goldman, J. G., & Weintraub, D. (2015). Advances in the treatment of cognitive impairment in Parkinson’s disease. Movement Disorders, 30(11), 1471-1489.
- Blotenberg, I., Hoffmann, W., Thyrian, J.R. (2023). Dementia in Germany: epidemiology and prevention potential. Dtsch. Ärzteblatt Int. 2023, 120, 470-6.
- Bojack, B. (2021). Wie Traumastörungen das Risiko für Demenz erhöhen. Geriatrie-Report 16(1), 22-25.
- Crist, C., (2023). Be Aware of Hepatic Encephalopathy, Dementia Overlap in Older Patients With Cirrhosis, Medscape, 10.02.2023.
- Eichler, T., Thyrian, R., Teipel, St., Hoffmann, W. (2015). Früherkennung der Demenz in der Hausarztpraxis. Perspektiven der Neurologie 01/2015, 15.
- Reetz, K., Schulz, J.B., (2015). Verdachtsdiagnose Dmenz- Was is tzu tun? Perspektiven der Neurologie 01/2015, 11-14.
- Gogol, MV (FGSA) et al. (2016). Klug entscheiden in der Geriatrie, Deutsches Ärzteblatt, Jg.113, Heft 40, 7.Okt.2106, A 1756-1760.
- Nasreddine, Z. S., Phillips, N. A., Bédirian, V., Charbonneau, S., Whitehead, V., Collin, I., … & Chertkow, H. (2005). The Montreal Cognitive Assessment, MoCA: a brief screening tool for mild cognitive impairment. Journal of the American Geriatrics Society, 53(4), 695-699.
- Morris, J. C. (1993). The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology.
- Lezak, M.D., Howieson, D.B., Bigler, E.D., & Tranel, D. (2012). Neuropsychological Assessment. Oxford University
Press. - Riepe, M.W., (2023): Epilepsie im Alter und Alzheimer – Diagnostik und Therapie , Deutsches Ärzteblatt, 120/26. 1002-1006
- Frisoni, G. B., Fox, N. C., Jack, C. R., Scheltens, P., & Thompson, P. M. (2010). The clinical use of structural MRI in Alzheimer disease. Nature reviews neurology, 6(2), 67-77.
- Barber, R., & Scheltens, P. (2016). White matter hyperintensities and the mediating role of cerebral blood flow in cognitively normal older adults. Journal of Alzheimer‘s Disease, 50(1), 107-120.
- Herholz, K., & Ebmeier, K. (2011). Clinical amyloid imaging in Alzheimer‘s disease. The Lancet Neurology, 10(7), 667-670.
- Klunk, W. E. (2011). Amyloid imaging as a biomarker for cerebral β-amyloidosis and risk prediction for Alzheimer dementia. Neurobiology of aging, 32, S20-S36.
- Blennow, K., & Zetterberg, H. (2018). Biomarkers for Alzheimer‘s disease: current status and prospects for the future. Journal of Internal Medicine, 284(6), 643-663.
- O‘Brien, J. T., Oertel, W. H., McKeith, I. G., Grosset, D. G., Walker, Z., Tatsch, K., … & MDS Committee on Rating Scales Development. (2009). Is ioflupane I123 injection diagnostically effective in patients with movement disorders and dementia? Pooled analysis of two multicentre trials. BMJ open, 2(4), e000998.
- –
- Corder, E. H., Saunders, A. M., Strittmatter, W. J., Schmechel, D. E., Gaskell, P. C., Small, G. W., … & Pericak-Vance, M. A. (1993). Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer‘s disease in late onset families. Science, 261(5123), 921-923.
- Chiu, M. J., Chen, Y. F., Chen, T. F., Yang, S. Y., Yang, F. P., Tseng, T. W., … & Chen, J. C. (2014). Plasma tau as a window to the brain—negative associations with brain volume and memory function in mild cognitive impairment and early Alzheimer‘s disease. Human brain mapping, 35(7), 3132-3142.
- Skirton, H., & Patch, C. (2013). The development of genetic counseling services and professional roles. In Genetic Disorders and the Fetus (pp. 115-136). Springer, Berlin, Heidelberg.
- Borry, P., Stultiens, L., Nys, H., Cassiman, J. J., & Dierickx, K. (2008). Presymptomatic and predictive genetic testing in minors: a systematic review of guidelines and position papers. Clinical Genetics, 74(5), 425-431.
- Jorm, A. F. (2001). History of depression as a risk factor for dementia: an updated review. Australian & New Zealand Journal of Psychiatry, 35(6), 776-781.
- Salzman, C. (1995). Medication compliance in the elderly. Journal of Clinical Psychiatry, 56 Suppl 1, 18-23.
- Deutsche Gesellschaft für Psychiatrie und Psychotherapie, Psychosomatik und Nervenheilkunde (DGPPN). (2016). S3-Leitlinie „Demenzen“. AWMF-Registernummer: 038-013.
- Olazarán, J., Reisberg, B., Clare, L., Cruz, I., Peña-Casanova, J., Del Ser, T., … & Muñiz, R. (2010). Nonpharmacological therapies in Alzheimer’s disease: a systematic review of efficacy. Dementia and geriatric cognitive disorders, 30(2), 161-178.
- Birks,J.(2006).Cholinesterase inhibitors for Alzheimer’s disease. Cochrane Database of Systematic Reviews, (1).
- Roman, G. C., & Erkinjuntti, T. (2001). Vascular dementia: diagnostic criteria for research studies: report of the NINDSAIREN International Workshop. Neurology, 56(7_suppl_5), S23-S27.
- Olazarán, J., Reisberg, B., Clare, L., Cruz, I., Peña-Casanova, J., Del Ser, T., … & Muñiz, R. (2010). Nonpharmacological therapies in Alzheimer’s disease: a systematic review of efficacy. Dementia and geriatric cognitive disorders, 30(2),
161-178. - Callahan, C. M., Boustani, M. A., Unverzagt, F. W., Austrom, M. G., Damush, T. M., Perkins, A. J., … & Hendrie, H. C. (2006). Effectiveness of collaborative care for older adults with Alzheimer disease in primary care: a randomized controlled trial. Jama, 295(18), 2148-2157.
- Lewczuk, P., Ermann, N., Andreasson, U., Schultheis, C., Podhorna, J., Spitzer, P., … & Kornhuber, J. (2018). Plasma neurofilament light as a potential biomarker of neurodegeneration in Alzheimer‘s disease. Alzheimer‘s research & therapy, 10(1), 1-9.
- Nabizadeh, M., et al. (2022). Plasma monofilament light levels correlate with white matter damage prior to Alzheimer’s disease. Results from ADNI. Aging Clin Exp Res 2022Oct. 34(10) 2362-2372.
- Johnson, K. A., Schultz, A., Betensky, R. A., Becker, J. A., Sepulcre, J., Rentz, D., … & Sperling, R. (2016). Tau positron emission tomographic imaging in aging and early Alzheimer disease. Annals of neurology, 79(1), 110-119.
- Cummings, J., Lee, G., Ritter, A., Sabbagh, M., & Zhong, K. (2020). Alzheimer’s disease drug development pipeline: 2020. Alzheimer‘s & Dementia: Translational Research & Clinical Interventions, 6(1), e12050.
- Werner, P.& Davidson, M. (2004). Emotional reactions of lay persons to someone with Alzheimer‘s disease. International Journal of Geriatric Psychiatry: A journal of the psychiatry of late life and allied sciences, 19(4), 391-397.
- Metzger, F. et al. (2012). Vagus somatosensory evoked potentials – a possibility for diagnostic improvement in patients with mild cognitive impairment, Dementia and cognitive disorders 33 (5): 289-296.
- Willnow, T. et al., Pressemitteilung Nr. 28 des Max-Delbrück-Centrums für Molekulare Medizin, 2020.
- Wanker, A. et al., Pressemitteilung Max-Delbrück-Centrum für Molekulare Medizin, 20.07.2023.
Bildquellen
Titel: © Studio Romantic – stock.adobe.com
Abb. 2 © Ivan – stock.adobe.com
Abb. 3 © Atthapon – stock.adobe.com





sehr gute Zusammenfassung