Endometriose – Update 2022
Interessengebiete: Allgemeinmedizin und Innere Medizin, Frauenheilkunde und Geburtshilfe
Die Endometriose ist nach den Myomen die zweithäufigste gynäkologische Erkrankung: jedoch sind die Ursachen für die Entstehung noch nicht vollständig geklärt. Diese umfassende CME-Fortbildung stellt die aktuellen Erklärungsmodelle vor, gibt einen Überblick über die klinischen Manifestationen und behandelt ebenso die immunologischen Aspekte.
Beschrieben werden Pathologie, molekulare Grundlagen und klinische Diagnose der Endometriose, sowie die Therapie der Peritoneal-Endometriose und Ovarial-Endometriose, als auch die Therapie der tiefinfiltrierenden und extragenitalen Endometriose. Bei Kinderwunschpatientinnen und bei Adenomyosis muss die Endometriose-Therapie sorgfältig geplant werden.
Zusatzmaterial
Interaktive M3D-vis-Darstellung im Browser. Kombination aus klinischem Befund und Anatomie: Durch Klicken auf markierte Bereiche erhalten Sie sofort Zusatzinformationen, Bilder und Videos.
© 2023 arztCME / Dunkel Digital Design
Das 3D-Modell ist auch als Basis für den Einsatz in Augmented Reality (AR) Anwendungen geeignet.
Kursinhalt
Inhaltsverzeichnis
Vorwort
Die Endometriose ist nach den Myomen die zweithäufigste gynäkologische Erkrankung: jedoch sind die Ursachen für die Entstehung noch nicht vollständig geklärt. Diese umfassende CME-Fortbildung stellt die aktuellen Erklärungsmodelle vor, gibt einen Überblick über die klinischen Manifestationen und behandelt ebenso die immunologischen Aspekte.
Zusammenfassung
Beschrieben werden Pathologie, molekulare Grundlagen und klinische Diagnose der Endometriose, sowie die Therapie der Peritoneal-Endometriose und Ovarial-Endometriose, als auch die Therapie der tiefinfiltrierenden und extragenitalen Endometriose. Bei Kinderwunschpatientinnen und bei Adenomyosis muss die Endometriose-Therapie sorgfältig geplant werden.
Einleitung
Die Endometriose ist nach Myomen die zweithäufigste gynäkologische Erkrankung. Die Ursachen für die Entstehung sind jedoch nach wie vor nicht vollständig geklärt. Der Beitrag stellt die wichtigsten Erklärungsmodelle vor und wirft auch einen Blick auf die immunologischen Aspekte. Bislang existieren keine Biomarker, die eine Endometriose eindeutig diagnostizieren, und oft vergehen Jahre bis zur endgültigen Diagnosestellung – gerade in Deutschland. Eine häufigere klinisch orientierte Diagnostik anstelle der primär chirurgischen Variante wäre wünschenswert und wird heute gefordert.
ist.
Die Peritonealendometriose stellt die häufigste Manifestation der Endometriose dar – die nicht unbedingt operativ saniert werden muss. In vielen Fällen ist eine primäre hormonelle Therapie möglich, zumal hier geeignete Medikamente zur Verfügung stehen. Im Gegensatz zu anderen Lokalisationen der Endometriose ist die Ovarialendometriose sehr gut zu diagnostizieren. Nach Abklärung des Malignitätspotenzials stellt sich die Frage, ob eine Therapie notwendig ist und wenn ja, welche. Tiefinfiltrierende Endometriosen sind die schwersten Formen der Endometriose, da es hier oft zu einer Einbeziehung von anderen Organen wie Blase, Ureter und Darm kommt. Dies führt bei der Patientin oft zu einem hohen Leidensdruck und Beeinträchtigungen auch anderer Organe. Extragenitale Endometriosen sind zwar selten, werden aber auch oft verzögert diagnostiziert.
Endometriose betrifft häufig auch Kinderwunschpatientinnen. Im Vordergrund der Therapie stehen dann in erster Linie operative Maßnahmen sowie Maßnahmen der assistierten Reproduktion. Die Zusammenarbeit mit Reproduktionsmedizinern ist dabei erforderlich.
Pathologie und molekulare Grundlagen
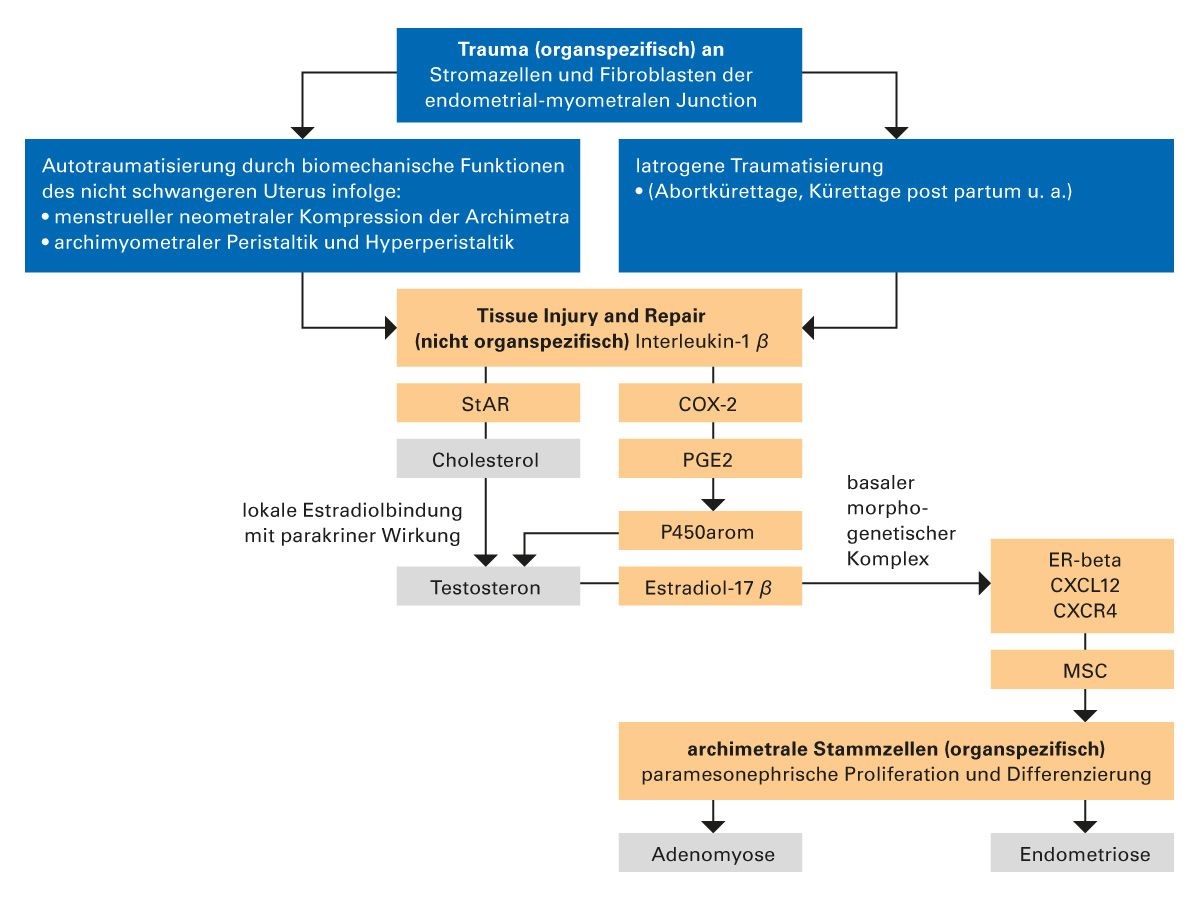
Nach verschiedenen Schätzungen liegt die Prävalenz der Endometriose bei 10–15 %, in Deutschland erkranken demnach jedes Jahr etwa 40.000 Frauen [1, 2]. Die Ursachen für die Entstehung der Endometriose sind nach wie vor nicht vollständig geklärt, entsprechend viele Erklärungsmodelle gibt es, die jedoch allesamt auch Schwächen haben. Vor allem die Tissue Injury And Repair (TIAR)-Theorie hat in den vergangenen Jahren viele Argumente auf sich vereinen können. Demnach führt eine gesteigerte Peristaltik der Gebärmuttermuskulatur zur Autotraumatisierung. Im Reparationsmechanismus werden lokal Estrogene freigesetzt, welche wiederum die Peristaltik verstärken. Daraus könnte ein Teufelskreis entstehen. Keine der vorliegenden Theorien kann jedoch bislang das komplexe Bild der Endometriose erklären. Vielmehr muss man ein multimodales Konzept aus den bisher bekannten Theorien annehmen, in dem eine Vielzahl von verschiedenen Faktoren zusammenwirkt.
Die Tissue Injury And Repair (TIAR)-Theorie
Die Endometriose ist in ihrer Pathogenese Ausdruck einer gestörten Wundheilung nach mechanischem Trauma. Während der fortpflanzungsfähigen Phase ist der Uterus ständigen mechanischen Belastungen ausgesetzt [3]. Dazu gehören die andauernde peristaltische Aktivität für den gerichteten Spermientransport und die hohe fundale Implantation der Blastozyste sowie die Kontraktionen am Ende eines Zyklus zur Externalisierung des menstruellen Debris. Diese mechanischen Aktivitäten stellen eine chronische Belastung des Gewebes dar.
Im verletzten Gewebe werden mesenchymale Stammzellen (MSC) über die Wirkung von Zytokinen durch Zellkontakt in endometriale (archimetrale) Stammzellen (ESC oder ASC) umgewandelt und proliferieren als Zellen des Gastgewebes. Da die Autotraumatisierung oder die Folgen eines iatrogenen Traumas persistieren können, resultiert daraus ein chronischer Proliferationsprozess. In der frühen und mittleren Proliferationsphase ist die Frequenz der peristaltischen Wellen bei Frauen mit Endometriose gegenüber gesunden Kontrollen verdoppelt [4].
Auf molekularer Ebene gilt die lokale Bildung von Estrogenen als elementar für das Verständnis der Pathophysiologie des Krankheitsbildes [5]. Estradiol spielt eine zentrale Rolle bei der Wundheilung – eine evolutionär alte Funktion, die im Wesentlichen über den Estrogenrezeptor beta (ER-beta) entfaltet wird. Eine durch Interleukin-1 induzierte Aktivierung der Cyclooxygenase-2 (COX-2) führt zur Produktion von Prostaglandin E2 (PGE2), das seinerseits StAR (steroidogenic acute regulatory protein) und die P 450 Aromatase aktiviert.
TIAR ist demnach ein nicht organspezifischer Prozess, der im Bindegewebe bei Wundheilung aktiviert wird. Die Übereinstimmung der Molekularbiologie von TIAR in verschiedenen Geweben nach Verletzung [6] mit den molekularbiologischen Phänomenen bei Endometriose [7], legen die Vermutung nahe, dass TIAR auch in der Pathophysiologie der Endometriose von fundamentaler Bedeutung ist [8].
Unter Vermittlung des ER-beta fördert Estradiol am Ort der Verletzung die Expression des Chemokins CXCL12, das als Ligand eine Verbindung mit dem entsprechenden Rezeptor, CXCR4, eingeht. Dieses Protein wird auf der Oberfläche von mesenchymalen Stammzellen (MSC) exprimiert, sodass die MSC, die über das Blutversorgungssystem an den Verletzungsort gelangen, dort festgehalten werden [9].
Mesenchymale Stammzellen (bone marrow-derived stem cells, MSC) sind eine heterogene Population von Zellen, die nur etwa 0,01 % des Knochenmarks ausmachen. Sie lassen sich heute aus fast allen Geweben, z. B. Fettgewebe, isolieren und sind durch bestimmte Kriterien definiert [10]. Unter bestimmten Umständen können sie in verschiedene Vorläuferzellen wie Osteoblasten, Chondrozyten, Myozyten und Adipozyten ausdifferenzieren. Dieser Differenzierungsprozess kommt u. a. durch Zellkontakt, Wachstumsfaktoren und Zytokine zustande. Die mesenchymalen Stamm-/Stromazellen exprimieren an ihrer Oberfläche den Rezeptor CXCR4.
In hypoestrogenen Situationen, z. B. in der späten Postmenopause oder nach Ovarektomie sowie bei schwerer hypothalamischer Ovarialinsuffizienz, wird die für die Gewebsregeneration notwendige Inkorporation von CXCR4 markierten MSC in das Gewebe durch eine reduzierte Expression von CXCL12 eingeschränkt. Auch die Qualität der Stammzellen selbst ist offenbar in solchen Situationen vermindert [11]. Der TIAR- Prozess kann demnach als eine physiologische Notfallmaßnahme betrachtet werden, die den Heilungsprozess durch vermehrte Inkorporation von MSC beschleunigt.
Bei der Endometriose besteht als Folge des TIAR-Prozesses und der konsekutiven lokalen Produktion und parakrinen Wirkung von Estradiol eine dramatisch erhöhte Expression von CXCL12 im glandulären Epithel und somit über das System der Blutversorgung eine entsprechend verstärkte Anziehung und Anlagerung von MSC. Die Einschleusung von Stammzellen führt jedoch zu keiner Heilung, sondern zu einem chronischen Proliferationsprozess.
Invasivität und Metastasierung
Zwei Aspekte des Verhaltens von Endometriosezellen ähneln dem maligner Tumoren: Invasivität und Metastasierung. Eine Erklärungsmöglichkeit besteht in der modulierten Expression des Adhäsionsmoleküls N-Cadherin und der fehlenden E-Cadherin-Expression. Durch die gestörte Gewebeintegrität können sich Zellen aus dem Gewebeverband lösen.
In der tiefsten Schicht des Endometriums existierende Stammzellen sind für die monatliche Regeneration verantwortlich. Nach dem Abbluten der Functionalis müssen komplexe Reparaturmechanismen die Schleimhaut mit Stroma, Drüsen, Gefäßen und Nerven neu aufbauen. Durch die lokale Aromataseexpression während der TIAR, könnte es nun zum Abschilfern stammzellhaltiger Basalisanteile kommen, die über die Tuben in den Bauchraum und somit auf das Peritoneum gelangen, wo sie sich weiterentwickeln. Für das Gestagen Dienogest wurde gezeigt, dass es in der Lage ist, die Proliferation von Läsionen aus Endometriosezysten, deren endogene Aromataseexpression und die Angiogenese zu reduzieren, während die Apoptose gleichzeitig zunahm [12].
Auch immunologische Mechanismen scheinen an der Entstehung einer Endometriose beteiligt, denn die Endometriumzellen werden offensichtlich nicht vom Immunsystem attackiert. Dies wird auf Veränderungen im originären Endometrium oder im peritonealen Kompartiment zurückgeführt. Hier können verschiedene Zytokine (z. B. IL-1, IL-6, IL-8 und IL-11, TNF-α, NF-KB u. a.) eine Rolle spielen [13].
Augmented Reality (AR)-Technologie
Diese Abbildung steht mit weiteren Informationen zur Verfügung und liefert mit Hilfe eines Smartphones zusätzliche klinische Bilder als AR-Projektion.
Klinische Diagnose der Endometriose
Endometriose wird typischerweise durch ihre Histologie definiert. Basierend auf Lage und Tiefe werden Läsionen weiter als oberflächliche Peritonealläsionen, Ovarialendometriom, oder als tief infiltrierende Endometriose (TIE) beschrieben. Das Vorhandensein von Läsionen schließt jedoch andere Ursachen für die Symptome der Patientin nicht aus, umgekehrt schließt das Fehlen offensichtlicher Läsionen die Möglichkeit einer Endometriose nicht aus. Darüber hinaus besteht kaum eine Korrelation zwischen Symptomen und Schweregrad oder Ausmaß der Erkrankung [14].
Häufig liegt zwischen dem ersten Besprechen der Symptome und der Diagnose ein langer Zeitraum, in Deutschland derzeit 7 Jahre. Diese Verzögerung der Diagnose hat für die Patientinnen nachteilige Auswirkungen auf die Lebensqualität und ist auch für die Arzt-Patientinnen-Beziehung belastend [15].
Von der Histologie zur Klinik
Aus klinischer Sicht kann Endometriose besser als menstruationszyklusabhängige, chronische, entzündliche, systemische Erkrankung definiert werden, die häufig in Form von Beckenschmerzen auftritt. Der Übergang von einer histologischen zu einer klinischen Definition öffnet die Tür zu einem anderen Diagnoseansatz, bei dem die Symptome und ihre Ursachen über das Vorhandensein oder Fehlen von Läsionen hervorgehoben werden und der in Zukunft möglicherweise durch spezifische, nicht invasive Krankheitsbiomarker validiert wird. Die Anamnese wird ergänzt durch eine gynäkologische Untersuchung mit Spekulumeinstellung unter Inspektion insbesondere auch des Fornix posterior vaginae (zweiblättrige Spekula verwenden), durch bimanuelle vaginale und rektovaginale Palpation sowie transvaginale und ggf. abdominale Sonografie ergänzt. Das derzeitige, auch in Deutschland noch weitverbreitete, diagnostische Paradigma erfordert eine Laparoskopie mit histologischer Untersuchung als Goldstandard, obwohl viele internationale Leitlinien die empirische Behandlung von Symptomen befürworten, bevor eine endgültige chirurgische Diagnose gestellt wird [16].
Vor allem die Leitlinien des britischen National Institute for Health and Care Excellence haben hier den Mut zu einem kompletten Wandel, bei dem die empirische Therapie der Laparoskopie zur Diagnose vorangestellt wird, sofern die Fertilität keine Priorität hat [17]. Und das aus gutem Grund: Obwohl die Laparoskopie auch unbestrittene Vorteile hat, müssen Effizienz, Risiken und Kosten neu bewertet werden. Die schlechte Korrelation zwischen den berichteten Symptomen und dem Ausmaß der per Laparoskopie festgestellten Erkrankung verdeutlicht die Grenzen der chirurgischen Beurteilung [18]. Die visuelle Identifizierung von Läsionen wird durch das heterogene Auftreten von Läsionen infrage gestellt, vor allem bei unzugänglichen Läsionsstellen [19].
Ein praktischer Ansatz
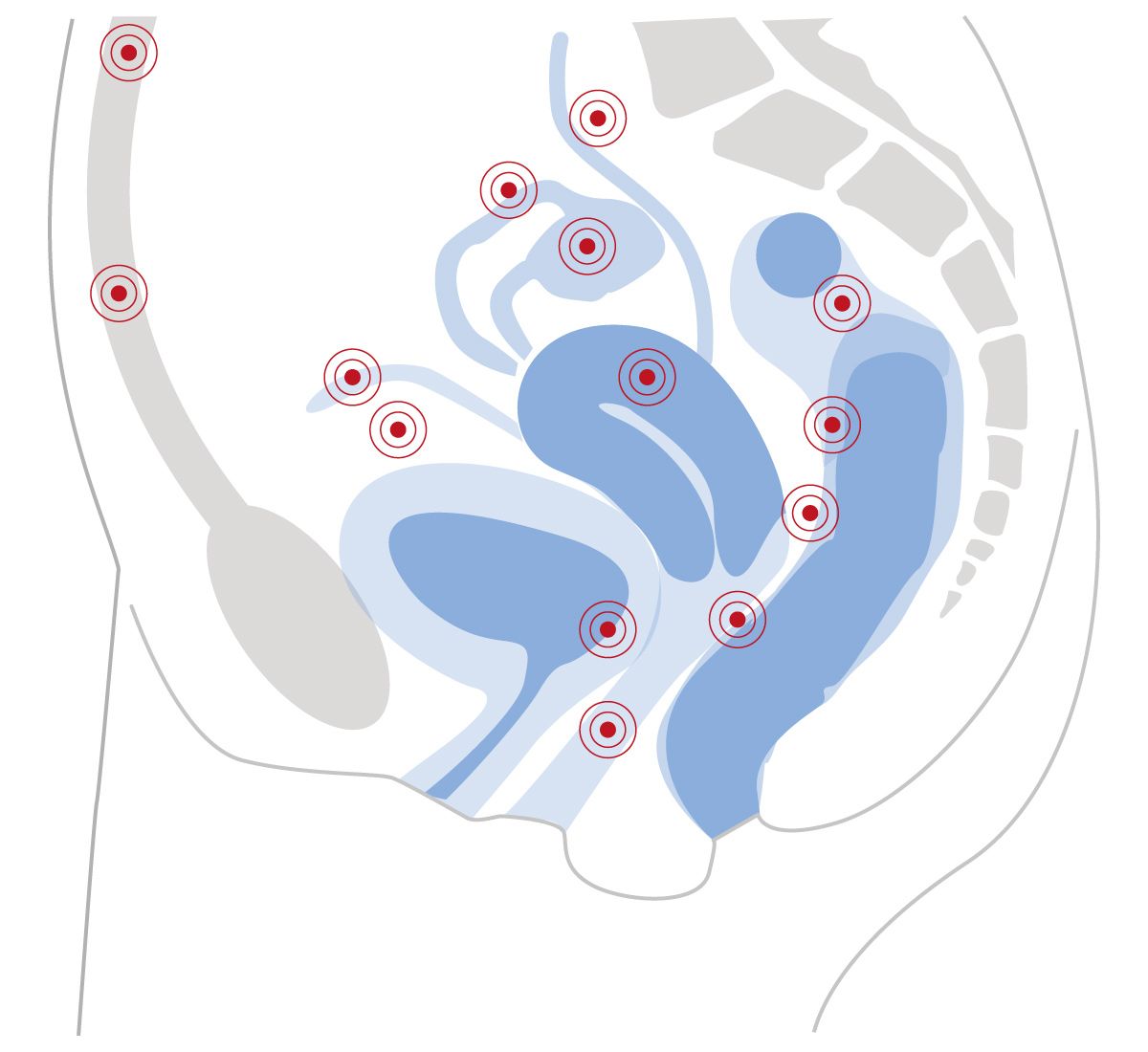
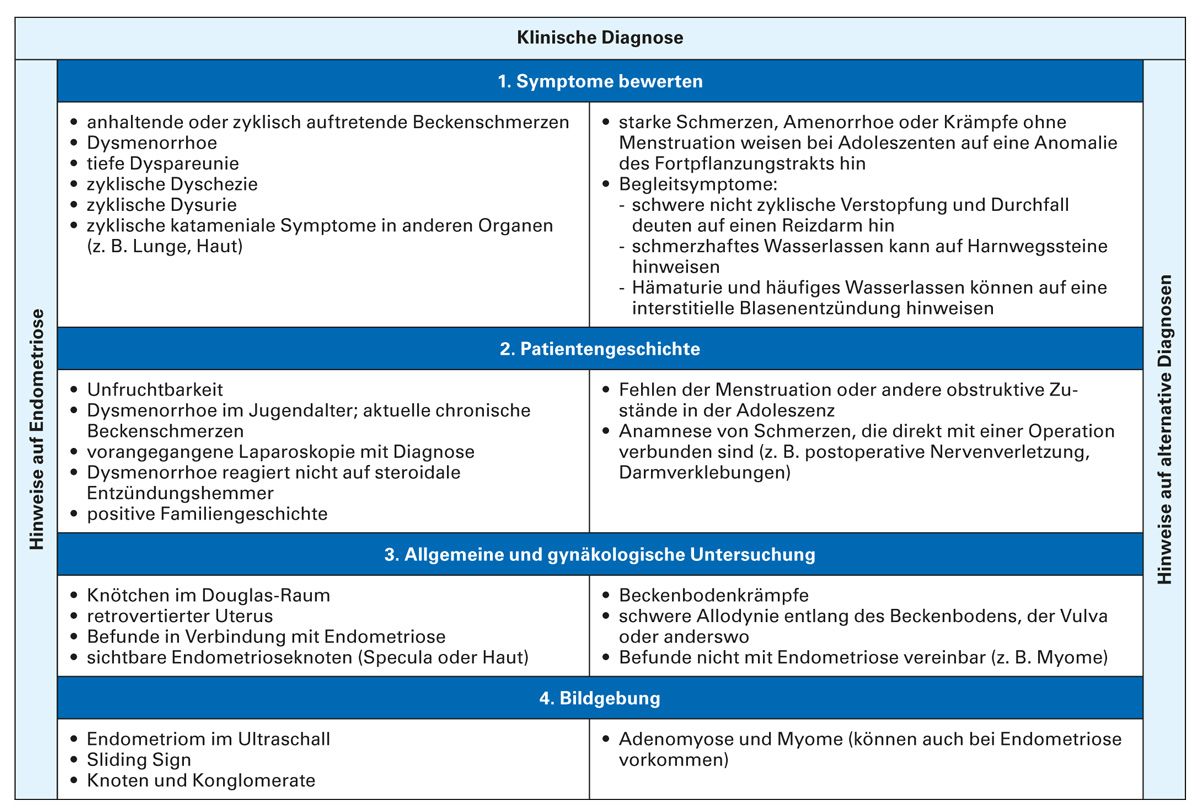
Um einen einheitlichen, praktischen Ansatz für die klinische Diagnose der Endometriose zu bieten, hat eine internationale Arbeitsgruppe einen Algorithmus auf Basis der verfügbaren Literatur und klinischer Erfahrung entwickelt [20]. Die im vorgeschlagenen Algorithmus verwendeten Techniken sind auch im niedergelassenen Bereich leicht umsetzbar. Für jeden Schritt enthält er Befunde, die auf eine Endometriose hinweisen und solche, die eher für eine alternative Diagnose sprechen. Im Allgemeinen deuten persistierende oder progrediente Unterleibsschmerzen sowie die 4D-Symptome (Dysmenorrhoe, Dysurie, Dyschezie, Dyspareunie) auf eine Endometriose hin.
Die weiterführende Diagnostik bei vermuteter urologischer Organbeteiligung, Darmbeteiligung, Beteiligung der pelvinen Nerven, extrapelviner und multifokaler TIE oder Adenomyosis beinhaltet dann [21]: MRT der Beckenorgane und Harnwege, Zystoskopie, ggf. Nierensonografie, Rektosigmoidoskopie, rektale Endosonografie sowie komplette Koloskopie (bei rektalen Blutungen).
Diese Verfahren dienen insbesondere der Planung einer Operation und sind nicht obligat durchzuführen. Insbesondere bei Adenomyose ist bereits die Kombination aus Klinik und transvaginaler Sonografie, ggf. ergänzt durch Dopplersonografie, ausreichend aussagekräftig [22]. Die Möglichkeiten zur klinischen Diagnose sind in Abbildung 3 zusammengefasst [23].
Therapie der Peritonealendometriose
Die Peritonealendometriose stellt die häufigste Manifestation der Endometriose dar und spielt sowohl beim Kinderwunsch als auch bei der Schmerzpatientin eine wesentliche Rolle. Wenn es auch zahlreiche Kombinationen der verschiedenen Manifestationen der Endometriose gibt (peritoneal, ovariell, tief infiltrierend), findet sich doch auch häufig eine peritoneale Endometriose allein. Für die eindeutige Beschreibung gibt es seit 2021 eine erweiterte Version der Enzian-Klassifikation [24]. Diese ist eine Kombination der ASRM-Klassifikation und der vorherigen ENZIAN-Klassifikation, die sich nur auf die tiefinfiltrierende Endometriose bezog.
Die Problematik bei der peritonealen Endometriose besteht darin, dass es kein sicheres bildgebendes Verfahren gibt, mit dem eine Peritonealendometriose sicher zu diagnostizieren ist. So bleibt es aufgrund der Symptomatik meist nur bei einer klinischen Verdachtsdiagnose. Im Vordergrund der Diagnostik stehen hier der klinische Befund einer Dysmenorrhoe sowie auch häufig ein auffälliger Tastbefund (Druckdolenzen im Bereich des Blasendachs, des Douglas und der Ligamenta sacrouterina).
Operative versus hormonelle Therapie
Während bis vor einigen Jahren in diesen Situationen zwingend eine laparoskopische Diagnostik und histologische Abklärung gefordert wurde, hat sich hier in den vergangenen Jahren auch in den internationalen Leitlinien ein Paradigmenwechsel vollzogen. Auch bei einer klinisch suspekten Endometriose wird zunächst eine primär hormonelle Therapie bevorzugt, eine Laparoskopie kommt erst bei Absetzen der Therapie, Auftreten von Nebenwirkungen und bestehendem Kinderwunsch zum Einsatz [25].
Die Entscheidung, ob chirurgisch oder medikamentös, sollte immer individuell gestellt werden – abhängig vom Beschwerdebild und vor allem vom Kinderwunsch der Patientin. Bestehen Kinderwunsch und eine entsprechende Symptomatik, die auf eine Peritonealendometriose hindeutet, ist eine operative Therapie indiziert, ebenso beim Verdacht auf weitere Pathologien (z. B. Adhäsionen), die einer medikamentösen Therapie nicht zugänglich sind. Vorteile der operativen Therapie sind histologische Sicherung, Ausschluss anderer Pathologien und Staging der Läsionen. Bei Patienten, bei denen der dringende klinische Verdacht auf eine peritoneale Endometriose besteht und auch kein Anhalt für ovarielle Endometriose oder tief infiltrierende Endometriose mit Organdestruktion, kann primär eine hormonelle Therapie eingesetzt werden. Sie ist nicht invasiv, unabhängig von der Erfahrung des Operateurs und vor allem auch als Langzeittherapie möglich [26, 27].
Hormonelle Therapie: KOK versus Gestagene
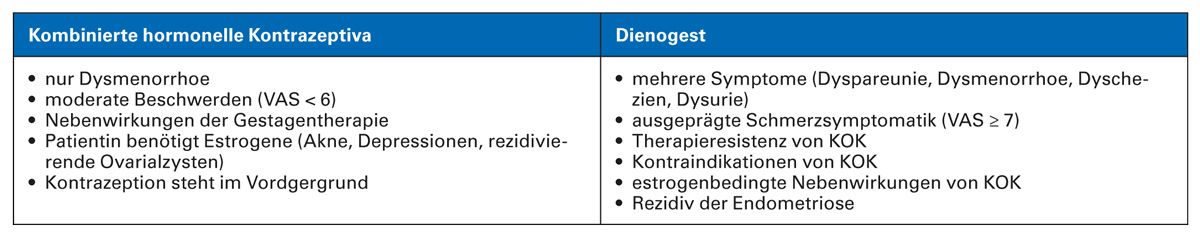
Während in den vergangenen Jahren vor allem kombinierte orale Kontrazeptiva (KOK) eingesetzt wurden, wird jetzt international mehr und mehr eine primäre Gestagentherapie empfohlen, bevorzugt mit Dienogest. Die Entscheidung, ob KOK oder Gestagene angewendet werden, hängt von vielen Faktoren ab [28]. So sind bei Patientinnen unter 18 Jahren bevorzugt KOK anzuwenden, da Dienogest in dieser Altersgruppe bei einer Anwendung von über einem Jahr zu einer Abnahme der Knochendichte führen kann. Auch wenn die Patientin nur geringe Beschwerden hat, kann zunächst ein Therapieversuch mit KOK erfolgen, insbesondere wenn die Kontrazeption im Vordergrund steht.
Auch bei Patientinnen, die ausschließlich eine moderate Dysmenorrhoe haben und keine weiteren Beschwerden wie Dysurie, Dyspareunie und Dyschezie, können KOK bevorzugt eingesetzt werden. Damit wird die bei den jungen Patientinnen häufige primäre Dysmenorrhoe erfolgreich behandelt. In Studien konnte gezeigt werden, dass KOK bei der Dysmenorrhoe effektiv sind, während z. B. für die chronischen Unterbauchbeschwerden oder Dyspareunien keine signifikante Verbesserung erreicht wurde.
Bei Patientinnen mit Schmerzscore VAS > 7 oder einer zusätzlichen Symptomatik wie Dyspareunie, Dyschezie und Dysurie, ist eine primäre Gestagentherapie zu empfehlen. Die meisten Gestagene haben allerdings keine Zulassung zur Kontrazeption (Ausnahme Desogestrel, Drospirenon), sodass unter dem Aspekt der Kontrazeption eine entsprechende Dosierung (doppelte Ovulationshemmdosis) angewendet werden muss, die auch sicher kontrazeptiv ist. Da es sich um einen Off-Label-Use handelt, ist eine entsprechende Aufklärung der Patientin notwendig. Ein Vorteil aller Gestagene gegenüber KOK ist das niedrigere Thromboserisiko, insbesondere bei Risikogruppen wie Raucherinnen im Alter über 35 Jahren, Patientinnen mit Hypertonus, bei länger bestehendem Diabetes mellitus oder einer anamnestischen Thromboembolie. Hier bestehen Kontraindikationen für die Anwendung von KOK.
Last but not least sind KOK zur Behandlung der Endometriose auch nicht zugelassen. Insofern sind Gestagene bei Patientinnen mit stärkeren Beschwerdebildern, einem höheren Thromboembolierisiko oder anderen estrogenbedingten Nebenwirkungen immer zu bevorzugen. Wenn ein KOK angewendet werden soll, dann sollte dies nach Möglichkeit als Langzeiteinnahme, d. h. kontinuierlich, erfolgen. In zahlreichen Studien konnte gezeigt werden, dass dadurch die Effektivität höher ist. Dieses Vorgehen wird auch in den aktuellen Kontrazeptionsleitlinien empfohlen.
Auswahl des Gestagens
Sehr häufig werden in Deutschland unter dem Aspekt der vorliegenden Zulassung für die Kontrazeption Desogestrel-Monopräparate (75 µg) angewendet. Diese sind für die Endometriose wirksam, erreichen aber bei Weitem nicht die Effektivität von Dienogest und sind auch nicht für die Behandlung der Endometriose zugelassen.
In den meisten Fällen ist die Dosierung von 75 µg Desogestrel nicht ausreichend. Berechnet man die Transformationsdosen, wären für eine äquieffektive Therapie wie mit 2 mg Dienogest ca. drei bis fünf Tabletten Desogestrel erforderlich. Das wiederum führt aber zu häufigeren Nebenwirkungen. Dies gilt auch für andere in Deutschland verfügbare Gestagen-Monopräparate. Bei der Anwendung von Chlormadinonacetat, Medroxyprogesteronacetat oder Dydrogesteron sind deutlich höhere Dosierungen für die Therapie der Endometriose erforderlich und auch hier bestehen keine Zulassungen für die Therapie der Endometriose. Somit ist Dienogest in der Therapie der Peritonealendometriose bevorzugt einzusetzen [29, 30]. Initiale Blutungsstörungen lassen sich durch die initiale Anwendung von 4 mg Dienogest über sechs bis acht Wochen oft reduzieren. Dadurch wird das Endometrium schneller supprimiert.
Treten nach einer längeren Anwendung von Dienogest Blutungen auf, kann durch eine kurzzeitige Unterbrechung der Therapie (eine Woche) die Blutung meist gestoppt und dann erneut mit der Therapie begonnen werden. Ist das nicht erfolgreich, kann auch eine kurzzeitige Therapie mit 1 mg Estradiol über fünf bis sieben Tage erfolgen. Die Therapie mit Dienogest kann so lange fortgeführt werden, bis die Patientin erneute Beschwerden hat oder aus anderen Gründen eine Indikation zur Laparoskopie besteht bzw. die Patientin einen Kinderwunsch hat.
Die primäre medikamentöse Therapie führt dazu, dass die Laparoskopie möglichst nur einmal und dann zu einem optimalen Zeitpunkt durchgeführt wird. Auch bei Patientinnen, die bereits eine andere frustrane Gestagentherapie hatten, kann eine Umstellung auf Dienogest sinnvoll sein. Hier ist oft noch eine erfolgreiche Schmerzreduktion zu erreichen und es kann eventuell auf eine Operation verzichtet werden [31].
Therapie der Ovarialendometriose
Die Ovarialendometriose ist eine häufige Form der Endometriose. Die Diagnose erfolgt durch die gynäkologische Palpation und vor allem die Vaginalsonografie. Das führt dazu, dass nicht nur symptomatische Patientinnen diagnostiziert werden, sondern auch symptomlose Patientinnen, z. B. im Zuge der Kinderwunschdiagnostik [32]. Die Ovarialendometriose kommt häufig mit einer peritonealen Endometriose, aber auch mit einer tief infiltrierenden Endometriose vor.
Jeder Operateur kennt den typischen Befund einer tief infiltrierenden rektovaginalen Endometriose, bei dem beide Ovarien adhärent sind und oft noch miteinander verklebt, in Form von „kissing ovaries“. Als Folge einer ovariellen Endometriose können periovarielle Adhäsionen unter Einbeziehung der Tube entstehen, was dann wiederum zu Tubenpassagenstörungen führen kann. Des Weiteren kann eine ausgeprägtere Ova- rialendometriose auch zur Fertilitätsstörung führen. Diese hängt weitgehend von Größe und Persistenz der Endometriome ab und der dann verbliebenen ovariellen Reserve.
Problematisch bleibt auch die Differenzialdiagnostik. Nicht jede glatt begrenzte echoarme Zyste ist eine Endometriosezyste. Schokoladenzysten können auch eingeblu- tete funktionelle Zysten sein, da sich die sonografischen Bilder ähnlich sind. Bei einer Persistenz derartiger Zysten, verbunden mit einer entsprechenden Symptomatik oder Infertilitätsproblematik, liegt es doch sehr nahe, dass es sich um Endometriosezysten handelt. Die definitive Diagnose liefert dann allerdings erst die Histologie.
Differenzialdiagnostik und Malignitätspotenzial
Eine Besonderheit der Ovarialendometriose ist vor allem die Differenzialdiagnostik zu malignen Tumoren oder Borderlinetumoren. Hier gelten die üblichen Kriterien für Adnextumoren. Zur Abgrenzung maligner Befunde ist die Vaginalsonografie entscheidend, wobei differenzialdiagnostisch auch Tumormarker wie CA125 hilfreich sein können. Allerdings ist zu beachten, dass auch bei Endometriosezysten und ausgeprägter Endometriose leicht erhöhte CA125-Werte vorkommen können [33]. Bei malignen Ovarialtumoren liegen die Werte meist um ein Vielfaches höher. Bei jedem Verdacht auf Malignität, die altersabhängig zunimmt, aber insgesamt deutlich unter 1 % liegt, ist eine operative und histologische Abklärung entsprechend den Leitlinien unabdingbar. In den meisten Situationen stellen sich jedoch die Befunde relativ eindeutig als benigne Schokoladenzysten dar. Dann stellt sich die Frage, ob und welche Therapie notwendig ist.
Indikationen zur Therapie
Indikationen zur Therapie von Endometriomen bestehen bei Schmerzpatientinnen, Patientinnen mit länger andauernder Infertilität, bei denen eine weitere Abklärung notwendig ist und in jedem Fall von unklarer Dignität. Zur Frage, ab welcher Größe eine Therapie zwingend indiziert ist, auch bezüglich der Fertilität, gibt es keine evidenzbasierten Studien. Während in einigen Leitlinien der cut-off level bezüglich der Größe mit 3 cm angegeben wird, ziehen andere Empfehlungen die Grenze bei 4 cm. Somit ist eine individuelle klinische Entscheidung zu treffen.
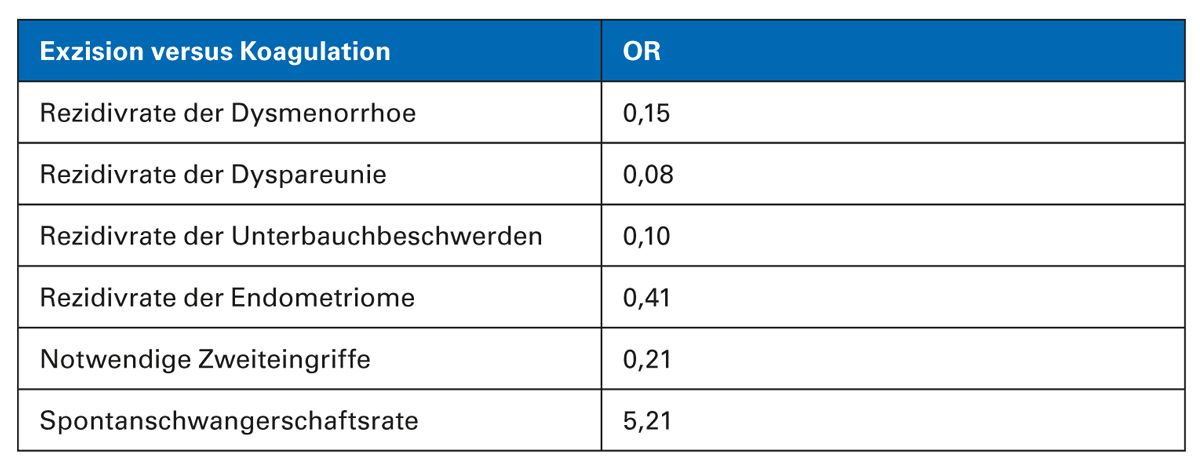
Als primäre Therapie wird entsprechend der deutschen Leitlinien die operative Sanierung der Befunde empfohlen. Wenn eine operative Therapie indiziert ist, sollte eine Exzision, d. h. die komplette Ausschälung des Zystenbalges, erfolgen. Diese ist der alleinigen Fensterung und Koagulation überlegen. Die Rezidivraten sind hier geringer und die Spontanschwangerschaftsraten um das 5-Fache höher.
Die Entscheidung zur operativen Sanierung, insbesondere bei Kinderwunschpatientinnen, ist zurückhaltend zu treffen, da die laparoskopische Exzision ggf. zu einem Verlust von gesundem Gewebe führen kann. Durch Koagulationsnekrosen kann es zu einer gestörten Blutversorgung kommen, die Stimulierbarkeit des Ovars kann dadurch reduziert und der AMH-Wert gesenkt werden. Das Risiko für ein Rezidiv liegt bei 32–40 % und betrifft besonders jüngere Patientinnen, die bereits vorangegangene Endometrioseoperationen hatten.
Ein weiterer Einflussfaktor ist natürlich die Erfahrung des Operateurs. Die Operation von Ovarialendometriomen bei jungen Patientinnen mit noch bestehendem Kinderwunsch gehört in die Hand eines Endometrioseoperateurs mit Erfahrung in der Fertilitätschirurgie. Die Entscheidung zur Operation muss somit immer unter Berücksichtigung der potenziellen Schädigung der ovariellen Reserve getroffen werden.
Adjuvante Hormontherapie nach laparoskopischer Entfernung von Endometriomen
Zur adjuvanten Hormontherapie werden häufig kombinierte orale Kontrazeptiva angewendet. In mehreren Studien konnte gezeigt werden, dass die Rate von Rezidivendometriomen durch Hormontherapien gesenkt wird. Die Rezidivrate nach sechs Monaten liegt bei einem exspektativen Management bei 29 %, bei einer zyklischen KOK-Anwendung bei 14 % und bei einer kontinuierlichen Anwendung bei 8 %. Andere Studien zeigen beim exspektativen Management Rezidivraten von 75 % und bei der Anwendung von KOK zwischen 20 und 32 %, wobei hier KOK, die Dienogest enthalten, die niedrigste Rezidivrate hat [34].
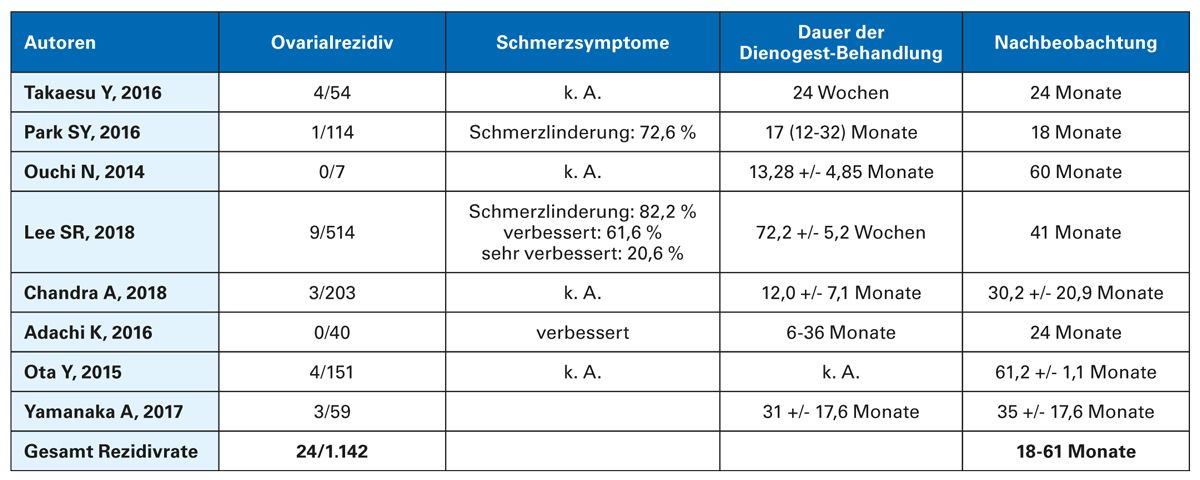
In einer Metaanalyse konnte bestätigt werden, dass eine kontinuierliche KOK-Anwendung das Rezidivrisiko von Endometriomen deutlicher senkt als eine zyklische Anwendung [35]. In zahlreichen Untersuchungen wurde die hohe Effektivität von Dienogest nach Endometriomen bestätigt. In umfangreichen Studien mit 1.142 Patienten gab es nur 24 Rezidive mit einem unterschiedlichen Follow-up zwischen 18 und 61 Monaten, d.h. die Rezidivrate beträgt nur 2,1 %, wenn eine Rezidivprophylaxe mit Dienogest erfolgte [36].
hat, vermindert eine adjuvante Hormontherapie das Rezidivrisiko deutlich.
So konnte in einer Studie gezeigt werden, dass nach 24 Monaten die Rezidivrate nach einer Operation mit Abwarten 24 % beträgt, mit Dienogest 0 % [37]. In einer Lang- zeitstudie zur Prävention von Endometriomen nach einer Operation wurden 568 Frauen über fünf Jahre untersucht. Davon wurden 151 mit Dienogest 2 mg behandelt und 470 mit Placebo. Die Rezidivrate nach fünf Jahren lag in der Placebogruppe bei 69 % und in der Dienogestgruppe nur bei 4 % [38]. Somit wird deutlich, dass, wenn eine Operation erfolgt und die Patientin nicht unmittelbar einen Kinderwunsch hat, eine adjuvante Hormontherapie das Rezidivrisiko deutlich vermindert.
Umfangreiche und günstige Langzeitdaten liegen aber für Dienogest vor. Diese Therapie ist unbegrenzt möglich. In allen Studien ist hier eine hoch signifikante Reduktion der Rezidivrate im Vergleich zu dem abwartenden Management zu verzeichnen. Es sollte mit jeder Patientin nach der Operation von Ovarialendometriomen eine adjuvante Hormontherapie besprochen werden, um das Rezidivrisiko signifikant zu senken. Das Risiko eines Rezidivs mit Schädigung der ovariellen Reserve kann dadurch signifikant gesenkt werden.
Primäre Hormontherapie bei Endometriomen
In den vergangenen Jahren zeigt sich gerade in der Therapie der Ovarialendometriose zunehmend ein Wandel. Eine primäre chirurgische Therapie wurde bisher als die Therapie der Wahl gesehen, neuere Daten zeigen aber, dass gerade Dienogest in der primären Therapie einen Effekt hat und zur Reduktion der Größe von Endometriomen führt [39, 40]. Der Durchmesser der Schokoladenzysten wurde um bis zu 70 % reduziert, Ähnliches konnte auch für bilaterale Endometriome nachgewiesen werden. Die Daten zeigen, dass eine primäre Therapie mit Dienogest erwogen werden kann, wenn eine sichere Diagnose des Endometriums vorliegt. Insbesondere gilt das in einer Rezidivsituation, um eventuelle Zweiteingriffe zu vermeiden.
Welche Auswirkungen dies auf die nachfolgende Fertilität hat, kann nur vermutet werden. Eine hormonelle Therapie der Endometriose in der Primärtherapie dürfte am ehesten geeignet sein bei jungen Patientinnen mit Rezidiven und kleineren Endometriomen (<4 cm) sowie keiner oder nur geringer Beschwerdesymptomatik. Die spezifischen Eigenschaften von Dienogest bezüglich der Endometriose dürften hier von Vorteil sein. Bezüglich der Auswahl, ob kombinierte orale Kontrazeptiva oder Dienogest angewendet werden, gelten die gleichen Kriterien wie bei der Anwendung der primären Hormontherapie bei Peritonealendometriose.
Therapie der tiefinfiltrierenden und extragenitalen Endometriose
Diagnostik
Tiefinfiltrierende Endometriosen zeigen oft eine typische Anamnese. Meist haben die Patientinnen bereits eine lange Historie von Endometriosebeschwerden. Anamnestisch typisch für die Blasenendometriose ist neben der Dysurie auch das Auftreten einer zyklischen Hämaturie. Sonografisch lassen sich typische Knoten zwischen Uterus und Blase gut verifizieren. Bei Mukosabefall ist auch eine diagnostische Zystoskopie zielführend. Hier kann auch durch eine Biopsie das Ergebnis histologisch gesichert werden. Für die rektovaginale Endometriose ist eine Dyspareunie und eine Dyschezie sowie eine zyklische Hämatochezie wegweisend für die Diagnostik.
Bei der rektovaginalen Endometriose zeigen sich oft schon bei der Spiegeleinstellung bläulich-schimmernde Endometrioseherde im hinteren Scheidengewölbe. Palpato- risch finden sich straffe Sacrouterinligamente. Meist ist auch ein Knoten zu tasten. Hier ist die Verschieblichkeit zu testen. Oft lassen sich in der Vaginalsonografie im rektovaginalen Kompartiment Knoten nachweisen.
Besteht der Verdacht auf eine Darmbeteiligung, ist eine transrektale Endosonografie notwendig. Nur in Fällen, in denen auch eine Blutung besteht, d. h. ein Mukosabefall, ist eine Rektoskopie bzw. besser Koloskopie indiziert, um die Endometriose zu sichern, zu lokalisieren und die Ausdehnung zu verifizieren, um somit eine Therapieplanung zu ermöglichen.
90 % der Darmendometriosen sind im Rektum oder Sigma lokalisiert [41]. Differenzialdiagnostisch ist auch an chronisch-entzündliche Darmerkrankungen zu denken, da bei Frauen mit Endometriosen ein erhöhtes Risiko besteht. Maligne Entartungen von Darmendometriosen sind selten (< 1 %) [42]. Bei perimenopausalen neu auftretenden Befunden sollte dies aber differenzialdiagnostisch ausgeschlossen werden.
Die Durchführung einer Nierensonografie ist sowohl bei einer Blasenendometriose als auch einer rektovaginalen Endometriose sehr wichtig, da durch eine Beteiligung der Ureteren immer die Gefahr einer Hydronephrose besteht, die langfristig zu einer erheblichen Schädigung der Niere führen kann. In ausgewählten Fällen ist auch eine MRT-Untersuchung hilfreich, insbesondere wenn auch eine parametrane Beteiligung vorliegt. Die MRT-Untersuchung sollte allerdings mit einer gezielten Fragestellung durchgeführt werden.
Therapie der Blasenendometriose
Besteht eine Blasenendometriose, ist zunächst zu eruieren, inwieweit eine Beteiligung des Ureters vorliegt. Kann diese ausgeschlossen werden, kann in dieser Situation mit der Patientin zunächst eine hormonelle Therapie versucht werden. Hier ist Dienogest das Mittel der ersten Wahl. Dienogest ist hier besonders wirksam, da es zu einer deutlichen Reduktion der Läsion kommt.
Neben der Größenreduktion zeigt sich auch eine Reduktion der Vaskularisierung und der entzündlichen Komponente. In einer internationalen Studie konnte gezeigt werden, dass mit einer Therapie von Dienogest über einen langen Zeitraum nur noch 50 % der Patientinnen einer Operation bedürfen. Bei den 50 % der Patientinnen, die nach einer Therapie noch operiert werden, zeigt sich, dass das Areal, das aus der Blasenwand reseziert werden muss, deutlich kleiner ist, was für die nachfolgende Blasenkapazität für die Patientin klinisch bedeutsam ist [43].
In der Regel sollte aber der Befund sowohl zystoskopisch als auch sonografisch gesichert ein. Besteht allerdings eine Beteiligung der Ureteren, muss eine operative Therapie durchgeführt werden (z. B. Ureterneuimplantation/Blasenteilresektion). Bei Notwendigkeit einer Ureterneueinpflanzung ist dies dann in interdisziplinärer Zusammenarbeit mit den Urologen in einem klinischen Endometriosezentrum durchzuführen. Eine der häufigsten extragenitalen Formen ist die Endometriose in Sectio-Narben.
Hier besteht zumindest der Eindruck, dass dies in den vergangenen Jahren häufiger geworden ist. Für eine Narbenendometriose sind ein Tastbefund in der Narbe und Narbenschmerzen Hinweiszeichen, die mit dem Anschwellen eines Knotens in der Narbe während der Menstruation einhergehen können.
Zwerchfellendometriosen lassen sich meist gut im Zuge der herkömmlichen Laparoskopie diagnostizieren; deshalb ist ein Blick auch in den Oberbauch bei der Laparoskopie immer wichtig. Hinweiszeichen für eine Endometriose des Diaphragmas sind zyklische Oberbauchbeschwerden, die gelegentlich bis in die Schultern ausstrahlen können.
Therapie der rektovaginalen Endometriose
Bei der rektovaginalen Endometriose besteht für die Patientinnen oft ein erheblicher Leidensdruck, sodass hier oft eine operative Therapie gewünscht wird. Allerdings erfolgte auch hier in den vergangenen Jahren ein Paradigmenwechsel. Denn die Operationen einer rektovaginalen Endometriose ist ein Eingriff mit einem hohen Komplikationspotenzial, insbesondere wenn eine Darmresektion erforderlich ist. Selbst in Endometriosezentren liegt die Komplikationsrate bei 7–10 % [44]. In Abhängigkeit von Alter und Leidensdruck der Patientin sowie der Ausdehnung des Befundes ist die Operationsindikation sehr sorgfältig abzuwägen. Besteht eine Obstruktion des Darmes mit Lumeneinschränkung, ist eine Operation meist unumgänglich. Besteht auch eine Infiltration oder Passagestörung des Ureters, muss die rektovaginale Endometriose reseziert werden. Diese interdisziplinären Operationen sollten ausschließlich in klinischen Endometriosezentren und möglichst gemeinsam mit endoskopisch versierten Chirurgen laparoskopisch durchgeführt werden. Eine sehr gute Operationsplanung einschließlich Endosonografie ist in jedem Fall notwendig.
Wenn das Darmlumen nicht eingeschränkt ist, auch ohne Mukosabefall und ohne eine Einschränkung der Ureterenpassage, sollte primär eine hormonelle Therapie versucht werden. In einigen Studien konnte hier gezeigt werden, dass es bei einer Langzeittherapie über drei Jahre zu einer Reduktion der rektovaginalen Knoten kommt.
In anderen Studien mit sechs bzw. zwölf Monaten Therapie konnte gezeigt werden, dass es mit 2 mg Dienogest zu einer signifikanten Verbesserung aller Schmerzformen kommt (Reduktion von Dysmenorrhoe, Unterbauchschmerzen, Darmschmerzen und Dyspareunie), auch wenn es zu keiner signifikanten Volumenreduktion der tief- infiltrierenden Knoten kam [45]. In einer weiteren Studie konnte gezeigt werden, dass nach einer erfolglosen Therapie mit Norethisteronacetat erst nach einer Umstellung auf 2 mg Dienogest nach sechs Monaten eine signifikante Reduktion der Schmerzen erreicht wurde, ohne dass es zu einer signifikanten Volumenreduktion der rektovaginalen Knoten kam [46].
Wenn Passagestörungen sowohl des Darmes als auch des Ureters ausgeschlossen wurden, sollte auf jeden Fall ein hormoneller Therapieversuch mit der Patientin besprochen werden. Hier ist Dienogest bzgl. der Schmerzsymptomatik hocheffektiv. Möglicherweise ist dann auch bei einer Langzeittherapie sogar in vielen Fällen eine Reduktion des Volumens der Knoten zu erreichen. Im Vordergrund steht jedoch für die Patientin immer die Reduktion der Schmerzsymptomatik [47].
Da nach Operationen rektovaginaler Endometriose über geburtshilfliche Komplikationen berichtet wurde, sollten gerade für Patientinnen, die noch einen Kinderwunsch haben, operative Lösungen möglichst auf die Zeit nach Abschluss der Familienplanung verschoben werden. Bei Patientinnen mit potenziellem Kinderwunsch ist die primäre Dienogest-Therapie bei rektovaginaler Endometriose sinnvoll. Dabei sind allerdings auch regelmäßige Nierensonografien erforderlich.
Therapie der extragenitalen Endometriose
Bei einigen extragenitalen Endometriosen ist eine Operation primär nicht oder nur sehr schwierig möglich. Bei Diaphragma-Endometriosen kann zwar eine Reduktion der En- dometriose laparoskopisch versucht werden, möglicherweise sind dabei aber nicht alle Herde erreichbar. Insofern ist hier auch ein hormoneller Therapieversuch mit Dienogest eine Option, um die Schmerzen zu lindern.
Ähnlich gilt dies für andere Formen der Endometriose, die sehr schwierig zu diagnostizieren und therapieren sind, z. B. Endometriose in der Lunge. Auch hier ist eine hormonelle Suppression die Therapie der ersten Wahl und gilt nicht nur als diagnostisches Ausschlusskriterium, sondern auch als mögliche Langzeittherapieoption. Anders verhält es sich bei Narbenendometriosen, insbesondere in Sectio-Narben. Hier ist eine hormonelle Therapie kaum wirksam. Die Herde sind für eine operative Therapie in den meisten Fällen gut zugänglich, sodass hier die Exzision der Narbenendometriose die Therapie der ersten Wahl sein sollte. In diesem Fall sollte die Operation idealerweise zum Zeitpunkt der Menstruation durchgeführt werden. Hier lassen sich die Herde dann am besten identifizieren (ggf. mit intraoperativer sonografischer Markierung). Auch bei Endometriose im Nabelbereich (primäre und sekundäre Form) oder an Trokareinstichstellen ist eine operative Entfernung einer hormonellen Therapie vorzuziehen.
Endometriosetherapie bei Kinderwunschpatientinnen
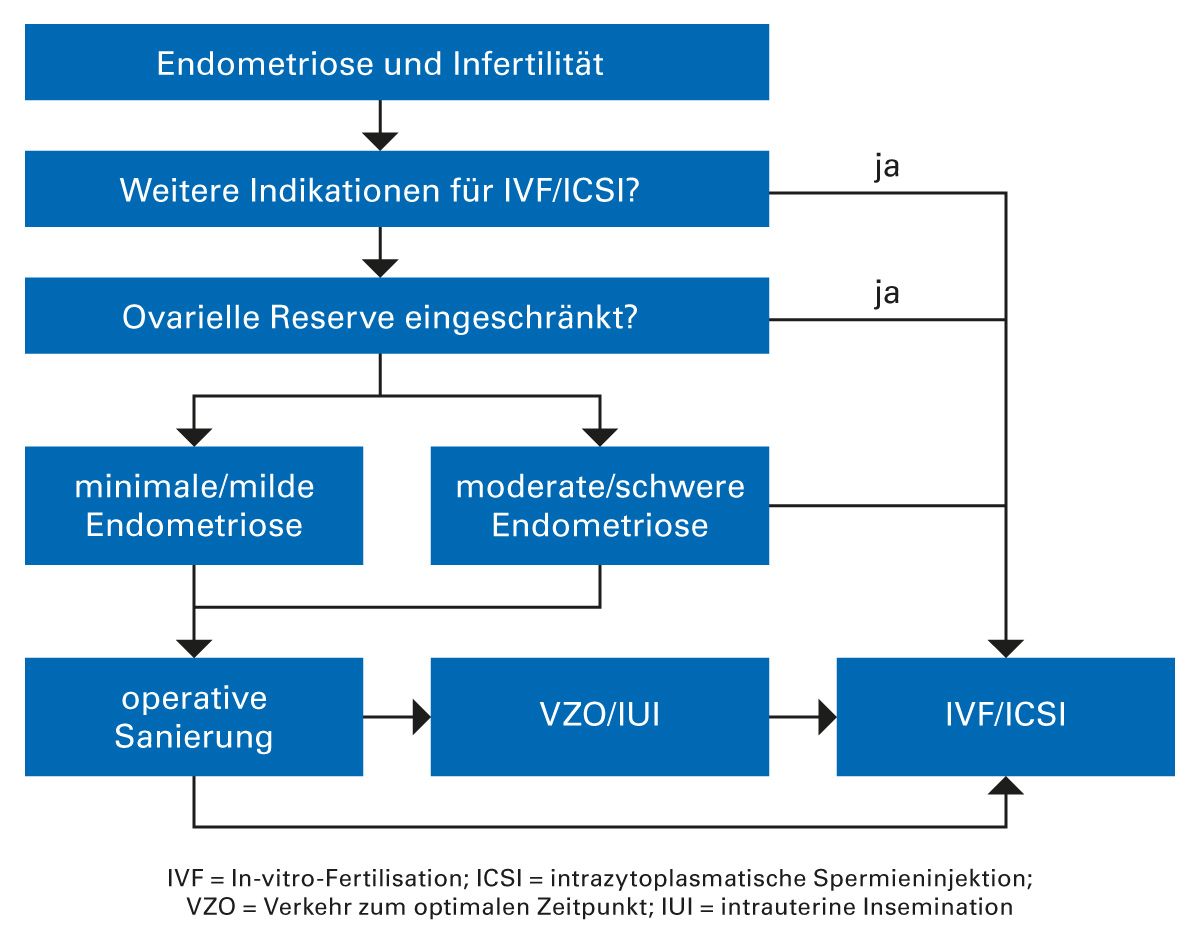
Die Endometriose ist eine der häufigsten gynäkologischen Erkrankungen und betrifft auch viele Kinderwunschpatientinnen [48]. Oft wird die Endometriose erst im Zuge der zur Kinderwunschdiagnostik durchgeführten Laparoskopie entdeckt. Dann stellt sich die Frage, inwieweit es eine relevante Assoziation zwischen Endometriose und Kinderwunsch gibt und welche Therapieansätze relevant sind.
Operation bei Kinderwunsch
Im Gegensatz zur effektiven Schmerztherapie bei Endometriose sind die Erfolge medikamentöser Therapien bei Infertilität begrenzt. Die chirurgische Therapie der Endometriose ist bei Kinderwunschpatientinnen oft die Therapie der Wahl. Mit der chirurgischen Methode können auch andere Probleme, die die Fertilität beeinträchtigen, beseitigt werden – wie Adhäsionen – und die Anatomie kann wiederhergestellt werden. Dazu gehören auch Tubenrekonstruktionen. Somit ist oft auch bei Patientinnen, bei denen eine Endometriose bekannt ist und die bisher medikamentös behandelt wurden, die Indikation für eine Laparoskopie gegeben, wenn aktuell ein Kinderwunsch besteht. Viele Patientinnen mit Endometriose und Kinderwunsch haben auch eine entsprechende klinische Symptomatik in Form von Dysmenorrhoen, Dysurie, Dyschezie und vor allem Dyspareunie. Mit letzterer Symptomatik geht oft eine reduzierte Frequenz von Kohabitationen einher, was wiederum die Konzeptionschancen senkt.
Ovarialendometriose
Wenn Ovarialendometriosen diagnostiziert werden, ist eine operative Therapie oft unumgänglich. In der Literatur wird oft eine Größe der Endometriosezysten von 4 cm als OP-Indikation angegeben. In jedem Fall muss operiert werden, wenn eine unklare Dignität besteht oder die Patientin stärkere Schmerzen hat. Entscheidet man sich für eine Operation bei Endometriomen, ist die komplette Exzision der Koagulation überlegen, da dann eine fünffach höhere Schwangerschaftsrate verzeichnet wird und auch die Rezidivrate der Endometriome signifikant geringer ist.
Problematisch ist in dieser Situation, dass die Entscheidung zur Operation immer unter dem Aspekt der potenziellen Schädigung der ovariellen Reserve getroffen werden muss, da es bei jeder laparoskopischen Ovaroperation auch zum Verlust von gesundem Gewebe kommen kann. Die Koagulation für die Hämostase kann die Blutversorgung stören und damit die Stimulierbarkeit des Ovars reduzieren, was sich dann in einem Absinken des AMH-Wertes zeigt. Besonders hoch ist das Risiko bei wiederholten Operationen am Ovar und bei einem jungen Alter der Patientinnen.
In großen Metaanalysen von über 2.000 Frauen mit Endometriose und Infertilität wurde gezeigt, dass sowohl eine operative Therapie als auch eine GnRH-Analoga-Therapie zu höheren Schwangerschaftsraten führt [49]. In aktuellen Reviews mit 33 Studien konnte gezeigt werden, dass die Lebendgeburtrate bei IVF im Vergleich zu Frauen ohne Endometriose gleich ist, und auch die klinische Schwangerschaftsrate ist vergleichbar [50]. Allerdings wird bei Frauen mit Endometriomen eine geringere Zahl von Eizellen gewonnen und es erfolgt häufiger ein Zyklusabbruch.
Werden Frauen mit Endometriomen vor einer IVF operiert, ergeben sich auch hier keine Unterschiede bezüglich der Lebendgeburtrate und klinischen Schwangerschafts- rate. Es wurde auch die gleiche Anzahl Eizellen gewonnen, sodass das IVF-Outcome mit Endometriomen ähnlich ist wie ohne. Es konnte ferner auch gezeigt werden, dass die operative Therapie keine negativen Effekte auf das IVF-Outcome hat. Auch in aktuellen Metaanalysen wurde gezeigt, dass es keine signifikanten Differenzen zwischen Operationen und exspektativem Management gibt [51].
Bei Endometriomen muss die Indikation zur Operation daher kritisch gestellt werden. Die Reduktion der klinischen Symptomatik steht hierbei im Vordergrund. Wie die Studien gezeigt haben, ist eine Verbesserung der Fertilität eher fraglich. Der Vorteil der Laparoskopie ist die Mitbehandlung weiterer fertilitätsrelevanter Endometrioseherde und/oder von Begleitpathologien wie Adhäsionen, Myomen oder Tubenverschlüssen. Des Weiteren wird die Punktion bei IVF erleichtert und es erfolgt ein sicherer Ausschluss prämaligner oder maligner Prozesse, die allerdings relativ selten sind (unter 3 %). Nachteile der Operation sind das Operations- und Narkoserisiko und die potenzielle Gefahr für die ovarielle Reserve.
Salpingitis isthmica nodosa
Eine wenig bekannte Form der Endometriose oder besser Adenomyosis ist der proximale Tubenverschluss durch eine Salpingitis isthmica nodosa. Hier ist immer darauf zu achten, dass bei beidseitigen isolierten proximalen Tubenverschlüssen auch technische Fehler ausgeschlossen werden, wie das falsche Sitzen des Adapters bei der Chromopertubation. Erhärtet sich der Verdacht auf eine Salpingitis isthmica nodosa, kann versucht werden, durch eine 3- bis 6-monatige GnRH-Analoga-Therapie, die Durchgängigkeit der Tuben wiederherzustellen. Das gelingt allerdings nur in ca. 50 % der Fälle [52]. In allen anderen Fällen ist in eine mikrochirurgische Tubenanastomose oder alternativ, je nach weiteren Kofaktoren, eine IVF-Behandlung notwendig. Eine Therapie mit GnRH-Analoga erfordert obligat eine Add-Back-Therapie, wenn sie länger als 6 Monate angewendet werden soll.
Tiefinfiltrierende Endometriose und Peritonealendometriose
Bei der tiefinfiltrierenden Endometriose, insbesondere rektovaginal, sollte die Operati- onsindikation immer besonders kritisch gestellt werden. Auch diese Operation ist mit einem hohen Risiko für Komplikationen verbunden und der Erhalt der Fertilität sollte bei diesen Patientinnen im Vordergrund stehen. Randomisierte kontrollierte Studien zu diesem Thema gibt es nicht. In vier retrospektiven und drei prospektiven Beobachtungsstudien konnte gezeigt werden, dass sich die spontanen Schwangerschaftsraten durch die Operation einer TIE erhöhen und die IVF-Resultate verbessert werden, wobei hier allerdings keine Signifikanz besteht [53].
Demgegenüber steht die hohe Komplikationsrate derartiger Operationen. So kann bei einer tiefinfiltrierenden Endometriose bei Kinderwunschpatientinnen ggf. ein eingeschränktes operatives Vorgehen erfolgen. Wenn klinisch möglich, sollten ausgedehntere Operationen wie Darmresektionen erst nach abgeschlossener Familienplanung erfolgen. Eine alleinige medikamentöse Therapie bei Peritonealendometriose verbessert im Stadium 1 und 2 die Fertilität nicht. Durch die chirurgische Therapie – Resektion als auch Ablation – kann die Fertilität verbessert werden, wobei auch hier die Datenlage limitiert ist.
Assistierte Reproduktion bei Endometriose
Maßnahmen der assistierten Reproduktion gewinnen zunehmend an Bedeutung. In Studien konnte gezeigt werden, dass bei Inseminationen mit Ovulationsinduktion eine geringe Verbesserung der Schwangerschaftsrate im Vergleich zu Spontanzyklen bei Patientinnen mit Endometriose im Stadium 1 und 2 erreicht wurde [54].
Häufig stellt sich die Frage, ob die Endometriose unter der Stimulation exazerbieren kann. Dies ist zumindest nicht belegt. Vermutlich ist hier eher der lange Zeitraum rele- vant, in dem die Patientin wegen des Kinderwunsches keine adäquate medikamentöse Therapie erhalten kann. Dadurch wird das Rezidivrisiko erhöht. Deshalb wird oft auch eine Vorbehandlung mit GnRH-Analoga bei schweren Endometriosen vor einer IVF durchgeführt. Hier konnte allerdings in einer Cochrane-Analyse kein eindeutiger positiver Effekt auf die Schwangerschaftsrate gezeigt werden [55]. Es ist daher empfehlenswert, die Patientinnen frühzeitig zur assistierten Reproduktion zuzuweisen. Auch Kofaktoren wie die andrologische Subfertilität müssen beachtet werden. Bei Patientinnen mit schweren Endometriosen sollte die Zeitspanne ohne Hormontherapie bis zur Schwangerschaft so kurz wie möglich gehalten werden [56].
Adenomyosis
Eine Fertilitätsstörung kann auch mit einer Adenomyosis assoziiert sein. Hier ist die Datenlage noch heterogener. Die kumulative Schwangerschaftsrate ist von der Ausprägung der Adenomyosis abhängig und bei ausgeprägten Adenomyosen geringer.
In verschiedenen Studien wurden organerhaltende operative Therapien verglichen. Eine operative Therapie ist auch bei der Adenomyosis nur eingeschränkt durchführbar. Osada hat hier eine Laparotomiemethode mit Exzision der ausgedehnten Adenomyosisherde und Defektdeckung durch eine Lappenplastik entwickelt und zeigte, in einer allerdings kleinen Gruppe, Schwangerschaftsraten von bis 60 % [57]. Organerhaltende Operationen, die in Kombination mit GnRH-Analoga eine Adenomyosis definitiv reduzieren, können also durchaus in ausgewählten Fällen ihre Berechtigung haben.
Inwieweit die Adenomyosis Einfluss auf eine IVF-Behandlung hat, wird immer wie- der kontrovers diskutiert. In der Mehrheit der Studien sind die IVF-Ergebnisse bei Ade- nomyosis-Patientinnen bezüglich der klinischen Schwangerschaftsraten etwa halbiert (22 vs. 45 %), und dies trotz GnRH-Analoga-Behandlung [58]. In einem großen Review mit 16 Studien konnte gezeigt werden, dass eine operative Therapie mit anschließender GnRH-Analoga-Therapie eine Spontanschwangerschaftsrate von 40 % vs. 15 % hat [59]. Ein Langprotokoll mit GnRH-Analoga zeigt eine bessere Schwangerschaftsrate.
Die Adenomyosis sollte frühzeitig diagnostiziert werden, und im Gesamtkonzept der Kinderwunschbehandlung sollte diesen Patientinnen unter Beachtung der Kofaktoren auch frühzeitig eine assistierte Reproduktion empfohlen werden. Diese sollte optimaler- weise mit einer Down-Regulation mit GnRH-Analoga vor der Stimulation einhergehen. Auch über eine erhöhte Abortrate und höhere Risiken in der Schwangerschaft wurde berichtet [60].
Literatur
1 Bulun SE. Role of estrogen receptor-β in endometriosis. N Engl J Med 2009; 360: 268–279
2 Burney RO et al. Pathogenesis and pathophysiology of endometriosis. Fertil Steril 2012; 98: 511–519
3 Leyendecker G in Ebert AD: Endometriose. De Gruyter 2019
4 Leyendecker G et al. Uterine hyperperistalsis and dysperistalsis as dysfunctions of the mechanism of rapid sperm transport in patients with endometriosis and infertility. Hum Reprod 1996; 11: 1542–1551
5 Leyendecker G et al. A new concept of endometriosis and adenomyosis: tissue injury and repair (TIAR). Hum Mol Biol Clin Invest 2011; 5: 125–142
6 Mirzatoni A et al. Injury-Induced Regulation of Steroidogenic Gene Expression in the Cerebellum. J Neurotrauma 2010; 27: 1875–1882
7 Bernardi LA et al. The essential role of GATA6 in the activation of estrogen synthesis in endometriosis. Reprod Sci 2018; 26: 60–69
8 Leyendecker G et al. The pathophysiology of endometriosis and adenomyosis: tissue injury and repair. Arch Gynecol Obstet 2009; 280: 529–538
9 Lander AD et al. What does the concept of the stem cell niche really mean today? BMC Biol 2012; 10: 19
10 Hocking HM. Leveraging stem cell homing for therapeutic regeneration. Adv Wound Care 2015; 4: 623–630
11 Gargett CE et al. Endometrial stem/progenitor cells: the first 10 years Hum Reprod Upd 2016; 22: 137–163
12 Miyashita M et al. Dienogest reduces proliferation, aromatase expression and angiogenesis, and increases apoptosis in human endometriosis. Gynecol Endocrinol 2014; 30: 644–648
13 Merz R, Römer T. Serie Endometriose: Pathologie und molekulare Grundlagen. Privatarzt Gynäkol 2020, 11(1): 28-29
14 Johnson NP et al. World Endometriosis Society consensus on the classification of endometriosis. Hum Reprod 2017; 32: 315-324
15 Nnoaham KE et al. Impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries. Fertil Steril 2011; 96: 366-373
16 Dunselman GA et al. ESHRE guideline: management of women with endometriosis. Hum Reprod 2014; 29: 400-412
17 National Institute for Health and Care Excellence. Endometriosis: diagnosis and management 2017. Im Internet: nice. org.uk/guidance/ng73
18 Vercellini P et al. Association between endometriosis stage, lesion type, patient characteristics and severity of pelvic pain symptoms: a multivariate analysis of over 1000 patients. Hum Reprod. 2007; 22: 266-271
19 Singh SS et al. Surgery for endometriosis: beyond medical therapies. Fertil Steril. 2017; 107: 549-554
20 Agarwal SK et al. Clinical diagnosis of endometriosis: a call to action. Am J Obstet Gynecol 2019; 220: 354.e1-12
21 Schäfer SD et al. Diagnostik und Therapie der Endometriose gemäß S2k-Leitlinie. Gynäkol Endokrinol 2020; 18: 21–30
22 Andres MP et al. Transvaginal ultrasound for the diagnosis of adenomyosis: systematic review and meta-analysis. J Minim Invasive Gynecol 2018; 25: 257—264
23 Römer T. Klinische Diagnose der Endometriose. Privatarzt Gynäkol 2020, 11(2): 2624 Keckstein J et al. The #Enzian classification: A comprehensive non-invasive and surgical description system for endometriosis. Acta Obstetr Gynecol Scand 2021; 100: 1165-1175
25 Leitlinie „Diagnostik und Therapie der Endometriose“, Registernummer 015 – 045.Im Internet: https://www.awmf.org/ leitlinien/detail/ll/015-045.html
26 Jensen JT et al. Use of combined hormonal contraceptives for the treatment of endometriosis-relatedpain: a systematic review of the evidence. Fertil Steril 2018; 110: 137–152
27 Chaichian S et al. Comparing the efficacy of surgery and medical therapy for pain management in endometriosis: a systematic review and metaanalysis. Pain Phys 2017; 20: 185–195
28 Janschek E et al. Medikamentöse Behandlung der Endometriose. Gynäkol 2020; 53: 658-665
29 Mde AP et al. Dienogest in the treatment of endometriosis: systematic review. Arch Gynecol Obstet 2015; 292: 523–529
30 Gezer A, Oral E. Progestin therapy in endometriosis. Womens Health 2015; 11: 643–652
31 Römer T. Therapie der Peritonealendometriose. Privatarzt Gynäkol 2020, 11(3): 22-23
32 Goodman LR et al. Effect of surgery on ovarian reserve in women with endometriomas, endometriosis and controls. Americ J Obstetr Gynecol 2016; 215: e581-589
33 Leitlinienprogramm Onkologie: S3-Leitlinie Diagnostik, Therapie und Nachsorge maligner Ovarialtumoren, Langversion 4.0, 2020, AWMF-Registernummer: 032/0350L. Im Internet: www.leitlinienprogramm-onkologie.de/leitlinien/ ovarialkarzinom
34 Römer T. Therapie der Ovarialendometriose. Privatarzt Gynäkol 2020, 11(4): 22-23
35 Muzii L et al. Continous versus cyclic oral contraceptives after laparoscopic excision of ovarian endometriomas: a systematic review and metaanalysis. Am J Obstet Gynecol. 2016; 214: 203-211
36 Murji A et al. Use of dienogest in endometriosis: a narrative literature review and expert commentary. Curr Med Res Opin 2020; 36: 895-907
37 Adachi K et al. Postoperative administration of dienogest for suppressing recurrence of disease and relieving pain in subjects with ovarian endometriomas. Gynecol Endocrinol 2016; 32: 646-649
38 Ota Y et al. Long term administration of dienogest reduces recurrence after excition of endometrioma. J Endometr Pelvic Pain Disord 2015; 7: 63-67.
39 Burghaus S, Beckmann MW. Endometriose – gynäkologische Diagnostik und Therapie. Schmerz 2021; 35: 172-178
40 Angioni S et al. Is dienogest the best medical treatment for ovarian endometriomas? Results of a multicentric case control study. Gynecol Endocrinol 2020; 36: 84-86
41 Fernandes LF et al. Surgical Principles for Disc Resection of Deep Bowel Endometriosis. J Minim Invasiv Gynecol 2020; 27: 262
42 Schutz R et al. Diagnostics and Therapy for Malignant (Degenerate) Colon Endometriosis – Three Case Reports. Geburtsh Frauenheilk 2016; 76: 417-422
43 Singh S et al. Dienogest and bladder endometriosis. Abstract, WES Congress, Sao Paulo 2014
44 Byrne D et al. Laparoscopic excision of deep rectovaginal endometriosis in BSGE endometriosis centres: a multicentre prospective cohort study. BMJ Open 2018; 8: e018924
45 Leonardo-Pinto JP et al. Dienogest and deep intfiltrating endometriosis: The remission of symptoms is not related to endometriosis nodule remission. Eur J Obstet Gynecol Reprod Biol 2017; 211: 108-111
46 Morotti M et al. Dienogest in women with persistent endometriosis-related pelvic pain during norethisterone acetate treatment. Eur J Obstet Gynecol Reprod Biol 2014, 183: 188-192
47 Römer T. Therapie der tiefinfiltrierenden und extragenitalen Endometriose. Privatarzt Gynäkol 2020, 11(5): 32-33
48 Hughes E et al. Ovulation suppression for Endometriosis Cochrane Database Syt Rev 2007: 18: CD155
49 Hodgson RM et al. Interventions for endometriosis-related infertility: a systematic review and network meta-analysis. Fertil Steril 2020; 113: 374-382
50 Hamdan M et al. The impact of endometrioma on IVF/ICSI outcomes: a systematic review and meta-analysis. Hum Reprod Update 2015; 21: 809-825
51 Bafort C et al. Laparoscopic surgery for endometriosis. Cochrane Database Syst Rev 2020; 23: CD011031
52 Korell M, et al. Hormonal treatment of proximal tubal pathology with the GnRH analogue leuprorelin. Zentralbl Gynakol 1998; 120: 56-59
53 Iversen ML et al. Does surgery for deep infiltrating bowel endometriosis improve fertility? A systematic review. Acta Obstetricia et Gynecologica Scandinavica 2017; 96: 688-693
54 Leung AS et al. The benefits of other treatments than in vitro fertilization to aid conception in minimal and mild endometriosis. Minerva Ginecol 2016; 68: 675-686
55 Georgiou EX et al. Long term GnRH agonist therapy for IVF for improving fertility outcomes in women with endometrio- sis. Cochrane Database Syst Rev 2019; CD013240
56 Schüring A, Kiesel L. Endometriose und Kinderwunsch. Gynäkol 2020; 53: 666-670
57 Osada H et al. Surgical procedure to conserve the uterus for future pregnancy in patients suffering from massive adenomyosis. Reprod Biomed Online 2011; 22: 94-99
58 Salim R et al. Adenomyosis reduces pregnancy rates in infertile women undergoing IVF. Reprod Biomed Online 2021; 25: 273-277
59 Pezzin Rocha T et al. Fertility-Sparing Treatment of Adenomyosis in Patients With Infertility: A Systematic Review of Current Options. Reprod Sci 2018; 25: 480-486
60 Römer T. Therapie der Endometriosetherapie bei Kinderwunschpatientinnen. Privatarzt Gynäkol 2020, 11(6): 22-23
Bildquellen
Titel: © nerthuz – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.