Endometriose – Leitlinien-Update 2025
Interessengebiete: Allgemeinmedizin und Innere Medizin, Frauenheilkunde und Geburtshilfe, Endokrinologie
Fortbildungsinhalte und Lernziele
Endometriose ist eine komplexe, multifaktorielle und alle Lebensbereiche der Frau betreffende chronische inflammatorische Erkrankung. Die neue S2K-Leitlinie zur Diagnostik und Therapie der Endometriose von 2025 trägt dieser Komplexität durch die Einbeziehung des bio-psycho-sozialen Krankheitsmodells Rechnung. Dieser Beitrag fasst den aktuellen Stand von Diagnostik und Therapie zusammen und geht explizit auf die Änderungen der neuen Leitlinie 2025 im Vergleich zur Vorversion 2020 ein.
ChatBot für die tutorielle Unterstützung
In diesem arztCME-Modul steht Ihnen ein interaktiver, KI-basierter ChatBot zur Verfügung. Im Dialog mit dem ChatBot können Sie die Inhalte dieses CME-Moduls erkunden.
Wenn Sie den ChatBot für diese arztCME-Fortbildung nutzen möchten, melden Sie sich bitte an.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Ätiologie und Pathogenese
- Diagnose der Endometriose
- Therapie der Endometriose
- Operative Therapie
- Hormonelle Therapie
- Primäre und postoperative hormonelle Therapie
- Multimodale Therapie der Endometriose
- Schmerztherapie
- Psychosomatische Therapie
- Komplementäre Therapien
- Endometriosetherapie bei Kinderwunschpatientinnen
- Fazit
- Literatur
Einleitung
Die Endometriose ist eine chronische inflammatorische Erkrankung und gilt als eine der häufigsten benignen gynäkologischen Pathologien. Allerdings sind die vorliegenden Daten zur Prävalenz und Inzidenz durch eine große Heterogenität gekennzeichnet [1].
Vergleichsweise hohe Prävalenzen sind im Rahmen von Kohortenstudien oder Surveys ermittelt worden. So belegen umfangreiche bevölkerungsbasierte Befragungen in Australien eine Punktprävalenz von 3,7-5,4 % [3] und eine Lebenszeitprävalenz von 7,0 % für Kanada [4]. Der Vergleich aktueller mit früheren Prävalenzangaben aus deutschen Krankenversicherungsdaten zeigt eine moderate Steigerung von 0,53 % in 2010 zu 0,66 % in 2019 [5]. Vom Statistischen Bundesamt sind belastbare Daten in Höhe von gut 32.000 Krankenhausaufenthalten im Jahr 2022 mit der Indikation Endometriose belegt [6].
Ätiologie und Pathogenese
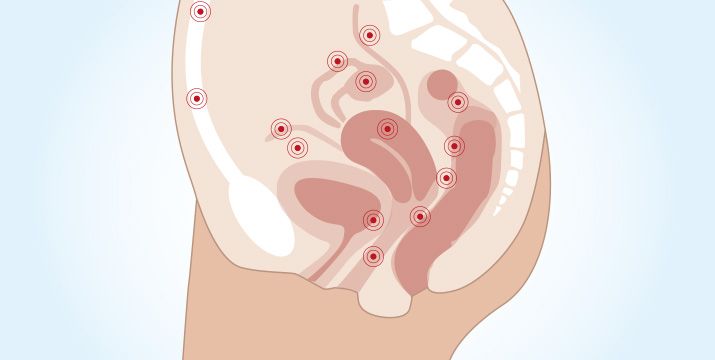
Die Endometriose ist eine benigne Erkrankung, kann sich aber durch infiltratives Wachstum organübergreifend ausbreiten und ausgedehnte Operationen erfordern [1, 7]. Es werden unterschiedliche Theorien zu möglichen Gemeinsamkeiten oder Unterschieden der Endometriose-Lokalisationen diskutiert.
Unter Zusammenführung der unterschiedlichen Konzepte wird davon ausgegangen, dass genetische Defekte und epigenetische Phänomene [8] sowie weitere Einflüsse die Voraussetzungen dafür bilden, dass bei der Implantation sowie der Metaplasie in einem für die Zellen fremden Milieu die für die Ausbildung der jeweiligen Endometrioseherde spezifischen Veränderungen stattfinden [1]. Es gibt eine große Zahl potenzieller Lokalisationen (Abb. 1).
Ausgehend davon, dass umfangreiche inflammatorische Reaktionen vorliegen und multiple immunologische Veränderungen sowohl im Peritoneum als auch in der Peritonealflüssigkeit nachweisbar [38] und mit dem Vorkommen entsprechender Läsionen assoziiert sind, wird mit Blick auf mögliche Therapieansätze der chronischen Inflammation eine zunehmende Bedeutung im Ablauf der Pathogenese zugesprochen [1].
Die Veränderungen und ihre Folgen nehmen die Frauen sehr häufig in Form von Schmerzen wahr. Die International Association for the Study of Pain (IASP) definiert Schmerz als eine unangenehme sensorische und emotionale Erfahrung, die mit tatsächlichen oder potenziellen Gewebeschädigungen assoziiert ist [9]. Endometriosebedingten Schmerzen können nozizeptive, neuropathische und noziplastische Schmerzmechanismen oder Kombinationen dieser Schmerzmechanismen zugrunde liegen.
Endometriose betrifft häufig auch Kinderwunschpatientinnen. Im Vordergrund der Therapie stehen dann in erster Linie operative Maßnahmen sowie Maßnahmen der assistierten Reproduktion. Die Zusammenarbeit mit Reproduktionsmedizinern ist dabei erforderlich.
Diagnose der Endometriose
Ein herausragender Unterschied in der diagnostischen Herangehensweise ist die explizite Einführung des bio-psycho-sozialen Krankheitsverständnisses in der Leitlinie 2025 [1]. Es wird betont, dass nicht nur die biologischen Aspekte der Erkrankung, sondern auch psychologische Faktoren wie Distress, Angst, Hilflosigkeit und Depression sowie soziale Aspekte wie Konflikte im familiären oder beruflichen Umfeld bei der Diagnostik und im Verständnis des Krankheitsverlaufs berücksichtigt werden müssen.
Häufig liegt zwischen erstem Besprechen der Symptome und Diagnose ein langer Zeitraum, in Deutschland derzeit 7 Jahre. Diese Verzögerung der Diagnose hat für die Patientinnen nachteilige Auswirkungen auf die Lebensqualität und ist auch für die Arzt-Patientinnen-Beziehung belastend [10].
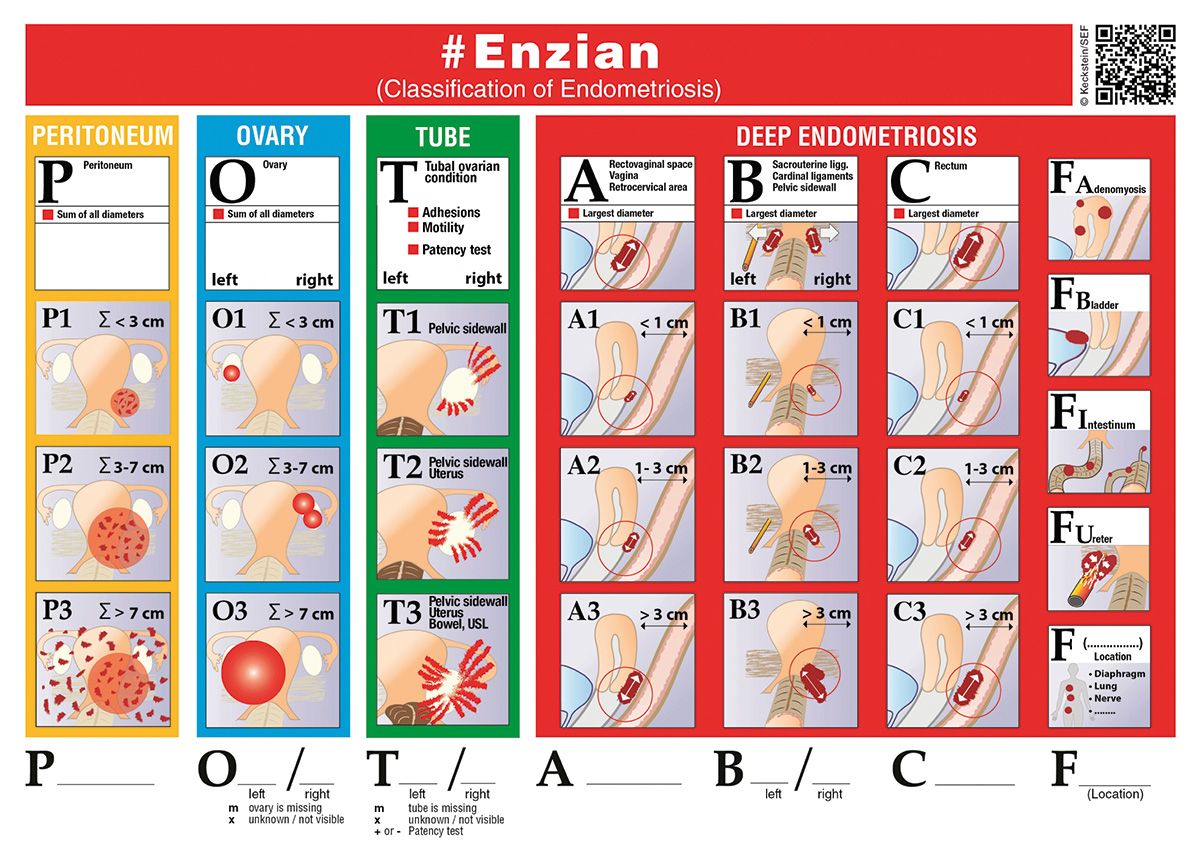
Die Klassifikation der Endometriose ist ein zentraler Pfeiler für die Diagnostik und Therapieplanung. Die Leitlinie 2025 führt hier entscheidende die #Enzian-Klassifikation [11] als umfassendes Instrument ein (Abb. 2). Diese neue Version ermöglicht eine reproduzierbare Gesamtabbildung der Endometriose, da sie nicht nur (wie die Vorversion) die tief infiltrierende Endometriose (TIE) berücksichtigt, sondern erstmals auch die Endometriose des Peritoneums (P) und der Ovarien (O). Die Ausdehnung dieser Manifestationen wird gestuft nach Größe (<3 cm, 3–7 cm, >7 cm). Zudem werden periovarielle und peritubare Adhäsionen (T) in drei Stufen ihrer Ausbreitung beschrieben.
Der zentrale Vorteil der #Enzian-Klassifikation für die Diagnostik ist, dass sie nicht-invasiv erhobene Befunde, insbesondere mittels Ultraschall als #Enzian(u) und MRT als #Enzian(m), abbilden kann. Dies ermöglicht eine präzisere prätherapeutische Erfassung und Individualisierung der Therapieplanung. Die Leitlinie 2020 empfahl die Erfassung des rASRM-Scores bei allen Operationen mit Verdachtsdiagnose Endometriose [2]. Die Leitlinie 2025 bestätigt die fortgesetzte Nutzung des rASRM-Scores für die Vergleichbarkeit mit bisherigen wissenschaftlichen Arbeiten, stellt jedoch klar, dass er für den klinischen Alltag nicht geeignet ist [1].
Beide Leitlinien fordern bei intraoperativem Verdacht auf Endometriose eine histologische Diagnosesicherung. Die primäre histologische Diagnose erfolgt weiterhin durch Hämatoxylin-Eosin-Färbung, und bei negativem Ergebnis werden Zusatzuntersuchungen wie Stufenschnitte, CD10- oder Hämosiderin-Färbung empfohlen. Die Leitlinie 2025 ergänzt hier einen wichtigen Hinweis: Lassen sich nach zusätzlichen Untersuchungen nur reaktive Veränderungen (wie Fibrose, Einblutungen, Histiozyten) nachweisen, kann im Befundkommentar eine „mutmaßliche Endometriose“ erwähnt werden, wenn eine zweifelsfreie morphologische Verifizierung nicht möglich ist. Dies bietet eine klarere Handlungsanweisung für unklare Fälle [1].
Vorrang für die Bildgebung
Die vielleicht bedeutendste Änderung in der Leitlinie 2025 betrifft die Hierarchie der diagnostischen Verfahren: Die Leitlinie 2020 erklärte die Laparoskopie mit intraoperativer Gewebeentnahme zur histologischen Untersuchung als den „Goldstandard“ zur Sicherung der Verdachtsdiagnose Endometriose [2].
Die Leitlinie 2025 vollzieht hier einen Paradigmenwechsel [1]: In der Konsensbasierten Empfehlung 3.E10 (neu 2024) wird festgelegt, dass die Bildgebung mittels transvaginaler Sonographie (TVS) standardmäßig als erstes diagnostisches Verfahren bei Endometriose angewendet werden soll und zusammen mit der individuellen Symptomatik Ausgangspunkt weiterer diagnostischer und therapeutischer Maßnahmen sein soll.
Ein MRT soll als Ergänzung in der zweiten Linie zum Einsatz kommen, wenn die Sonographie allein nicht ausreichend aussagekräftig ist. Die Laparoskopie wird in der 2025er-Version weiterhin als wichtiges diagnostisches/therapeutisches Instrument mit obligaten Operationsschritten beschrieben, aber nicht mehr als primärer Goldstandard für die Diagnosesicherung im Allgemeinen hervorgehoben, sondern als invasiver Schritt, der bei therapierefraktären Schmerzen oder Verdacht auf spezifische Manifestationen indiziert ist [1].
Beide Leitlinienversionen sind sich einig, dass etablierte Biomarker wie CA-125 und CA 19-9 nicht für die Diagnose einer Endometriose geeignet sind. Ihre Spezifität ist unzureichend. Die Leitlinie 2025 geht jedoch einen deutlichen Schritt weiter und widmet sich ausführlich neuen kommerziellen Speicheltests auf Basis von Mikro-RNA (miRNA). Obwohl eine zugrundeliegende Studie hohe Sensitivität und Spezifität angab (96,7 % bzw. 100 %), äußert die Leitlinie 2025 starke Zurückhaltung [1]. Aufgrund der limitierten und unspezifischen Auswahl der Patientinnen sei der Test noch nicht zu empfehlen.
Ein wichtiger Zusatz in der Version 2025 ist die Empfehlung, das Anti-Müller-Hormon (AMH) als Marker der ovariellen Reserve vor Festlegung der Therapiestrategie bei ovarieller Endometriose zu bestimmen. Dies trägt der Erkenntnis Rechnung, dass operative Eingriffe an Endometriomen die ovarielle Reserve beeinträchtigen können.
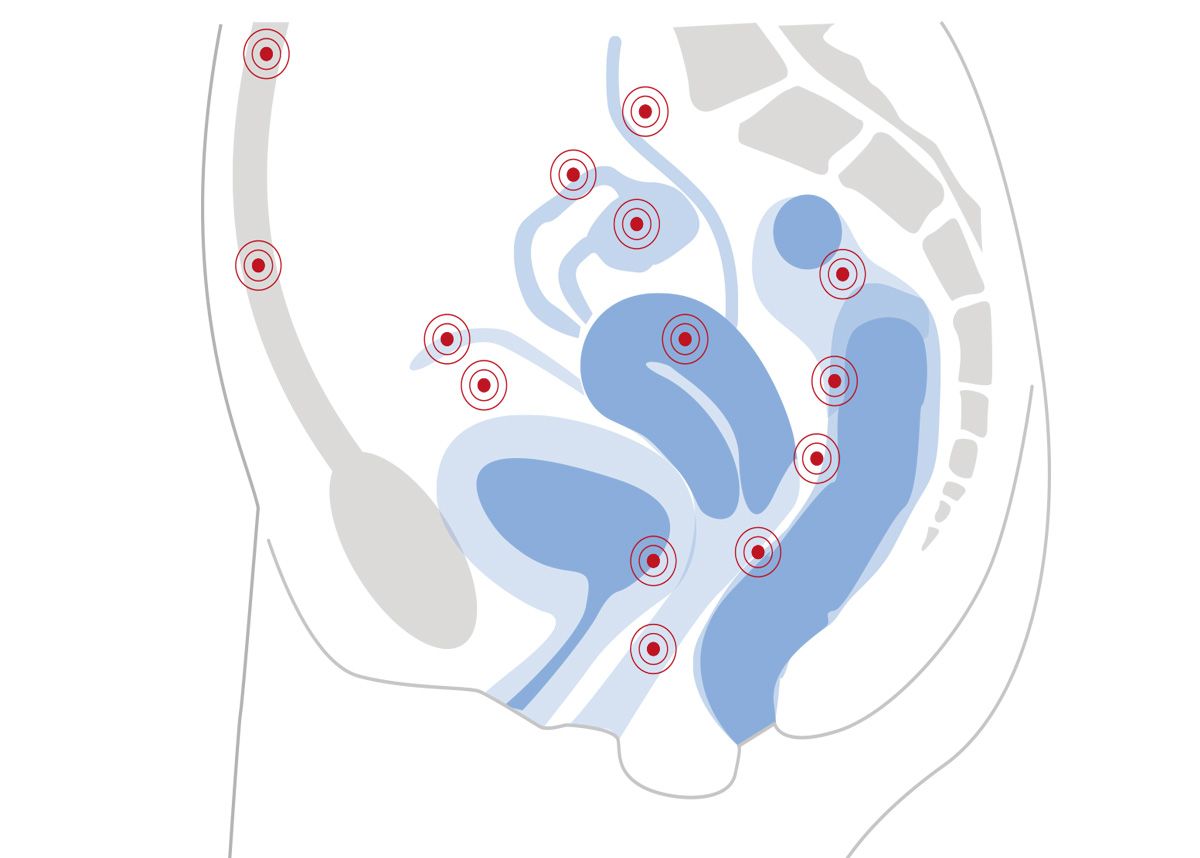
Die Möglichkeiten zur klinischen Diagnose sind in Abb. 3 zusammengefasst [1]. Die im vorgeschlagenen Algorithmus verwendeten Techniken sind auch im niedergelassenen Bereich leicht umsetzbar. Für jeden Schritt enthält er Befunde, die auf eine Endometriose hinweisen und solche, die eher für eine alternative Diagnose sprechen. Im Allgemeinen deuten persistierende oder progrediente Unterleibsschmerzen sowie die 4D-Symptome (Dysmenorrhoe, Dysurie, Dyschezie, Dyspareunie) auf eine Endometriose hin.
Patientenzentrierte Diagnostik und Chronifizierung
Ein zentrales Thema in der Leitlinie 2025 ist die frühe Erkennung und Management der Chronifizierung von Schmerzen und psychischen Begleiterkrankungen, was sich direkt auf die diagnostische Herangehensweise auswirkt. Beide Leitlinien fordern die Erfassung Endometriose-spezifischer Leitsymptome (Dysmenorrhoe, Dysurie, Dyschezie, Dyspareunie, Sterilität) und unspezifischer Symptome wie Unterbauchschmerzen. Die Leitlinie 2025 erweitert dies um die Forderung, in der gynäkologischen Primärdiagnostik Risikofaktoren für Schmerzchronifizierung und Hinweise auf zugrundeliegende Schmerzmechanismen zu erfassen [1].
Als „Praxiswerkzeuge“ empfiehlt die Leitlinie 2025 explizit Gesundheitsfragebögen wie PHQ-15 (körperliche Beschwerden), PHQ-4 (Screening auf Angst und Depression), PHQ-9 (Depressivität) und GAD-7 (Angststörung). Diese sollen zur Primäruntersuchung auf Angst und Depression in der gynäkologischen psychosomatischen Grundversorgung genutzt werden [1].
Die Version 2025 fordert zudem eine strukturierte Schmerzanamnese, um unnötige invasive Eingriffe und Stigmatisierung zu vermeiden. Sie liefert eine detaillierte Liste von Inhalten für diese Anamnese, darunter Schmerzort, -dauer, -variabilität, -charakter, -intensität auf numerischer oder visueller Analogskala, funktionelle Einschränkungen, Ressourcen und Hinweise auf noziplastische Schmerzmechanismen (zentrale Sensibilisierung) sowie Schmerzchronifizierung. Bei Anzeichen einer sich entwickelnden Chronifizierung oder einer manifesten chronischen Schmerzstörung wird in der Leitlinie 2025 ein frühzeitiges interdisziplinäres schmerzmedizinisches Assessment empfohlen [1].
Therapie der Endometriose
Die Peritonealendometriose stellt die häufigste Manifestation der Endometriose dar und spielt sowohl beim Kinderwunsch als auch bei der Schmerzpatientin eine wesentliche Rolle. Wenn es auch zahlreiche Kombinationen der verschiedenen Manifestationen der Endometriose gibt (peritonal, ovariell, tief infiltrierend), findet sich doch auch häufig eine peritoneale Endometriose allein.
Operative Therapie
Während bis vor einigen Jahren in diesen Situationen zwingend eine laparoskopische Diagnostik und histologische Abklärung gefordert wurde, hat sich hier in den vergangenen Jahren auch in den internationalen und nationalen Leitlinien ein Paradigmenwechsel vollzogen [1]. Auch bei einer klinisch suspekten Endometriose wird zunächst eine primär hormonelle Therapie bevorzugt, eine Laparoskopie kommt erst bei Absetzen der Therapie, Auftreten von Nebenwirkungen und bestehendem Kinderwunsch zum Einsatz [1].
Die Entscheidung, ob chirurgisch oder medikamentös, sollte immer individuell gestellt werden – abhängig vom Beschwerdebild und vor allem vom Kinderwunsch der Patientin. Bestehen Kinderwunsch und eine entsprechende Symptomatik, die auf eine Peritonealendometriose hindeutet, ist eine operative Therapie indiziert, ebenso beim Verdacht auf weitere Pathologien (z. B. Adhäsionen), die einer medikamentösen Therapie nicht zugänglich sind. Vorteile der operativen Therapie sind histologische Sicherung, Ausschluss anderer Pathologien und Staging der Läsionen [1].
Die primär hormonelle Therapie ist nicht invasiv, unabhängig von der Erfahrung des Operateurs und vor allem auch als Langzeittherapie möglich [1, 12, 13].
Hormonelle Therapie
Östrogen fördert das Wachstum und die Aktivität der ektopischen Endometriumzellen fördert, indem es die Zellproliferation, Angiogenese und die Expression proinflammatorischer Mediatoren verstärkt. Dies hält die chronischen Entzündungsprozesse und die Hormonabhängigkeit der Erkrankung aufrecht.
Das Hauptprinzip einer effektiven hormonellen Therapie ist daher die Absenkung des Östrogenspiegels, wobei die therapeutische Amenorrhoe (Ausbleiben der Menstruation) als Zielparameter für die Effektivitätsbeurteilung herangezogen werden kann [14]. Häufig werden Hormontherapien aufgrund von Zwischenblutungen, die schmerzhaft sein können, abgebrochen; daher ist es wichtig, eine Blutungsfreiheit durch eine langfristige und ununterbrochene Therapie zu erreichen.
Alle Formen der Hormontherapie reduzieren Endometriose-assoziierte Beschwerden. Sie unterscheiden sich jedoch in ihren Nebenwirkungen. Die Wirkung erfolgt direkt am ektopen Endometrium, was zu einer Reduktion der Proliferation und Läsionsgröße führt, gefolgt von einer abnehmenden Uterusgröße, geringeren Schmerzsymptomen und geringerer Blutungsstärke [1, 14].
In Deutschland sind für die hormonelle Therapie der Endometriose das Gestagen Dienogest, die GnRH-Antagonisten Relugolix-CT und Linzagolix (mit Add-back-Therapie) sowie der GnRH-Agonist Leuprorelinacetat zugelassen. Kombinierte orale Kontrazeptiva (KOK) und weitere Gestagene, einschließlich anderer Applikationsformen (LNG-IUS, Vaginalring etc.), werden im Off-Label-Use eingesetzt.
Die Leitlinie schreibt in der konsensbasierten Empfehlung 4.E12 (modifiziert 2024): In der symptomatischen medikamentösen Therapie Endometriose-assoziierter Schmerzen sollte als Erstliniensubstanz ein geeignetes Gestagen (z. B. Dienogest) oder ein GnRH-Antagonist mit oraler Bioverfügbarkeit, gegebenenfalls mit Add-back-Therapie (z. B. Relugolix + NETA + E2 oder Linzagolix mit Add-back), eingesetzt werden, wenn eine Operation mit Diagnose einer Endometriose vorausgegangen ist [1].
Konsensbasierte Empfehlung 4.E13 (modifiziert 2024): In der Zweitlinientherapie können
- ein GnRH-Antagonist mit oraler Bioverfügbarkeit, gegebenenfalls mit Add-back-Therapie (z. B. Relugolix + NETA + E2 oder Linzagolix mit Add-back),
- kombinierte orale Kontrazeptiva
- andere Gestagene inklusive lokaler Anwendung oder
- GnRH-Agonisten, gegebenenfalls mit Add-back-Therapie, eingesetzt werden [1].
Konsensbasierte Empfehlung 4.E14 (geprüft 2024): Die Behandlung mit GnRH-Analoga sollte durch eine Add-back-Therapie mit geeigneter Östrogen-Gestagen-Kombination ergänzt werden, um Folgen des Östrogenmangels zu minimieren, ohne die therapeutische Wirksamkeit des GnRH-Analogons zu beeinflussen [1].
Für Dienogest liegt umfangreiche Evidenz für die positive Wirkung auf endometriosespezifische Beschwerden bis zu 52 Wochen liegt vor [15, 16]. Es wirkt gleichermaßen effektiv wie GnRH-Analoga bei der Reduktion von Dysmenorrhoe und chronischen Unterbauchschmerzen sowie der Anzahl an Rezidiven nach operativer Laparoskopie. Dienogest ist zur Endometriose-Therapie zugelassen.
GnRH-Analoga wirken über eine Blockade der GnRH-Rezeptoren im Hypophysenvorderlappen, reduzieren Endometriose-assoziierte Schmerzen, Blutungsstärke und uterines Volumen. GnRH-Agonisten sind per subkutaner und intramuskulärer Injektion wirksam. Aufgrund des Nebenwirkungsspektrums (klimakterische Beschwerden, Verringerung der Knochendichte) sind sie nicht als Erstlinientherapeutikum geeignet. Die Behandlung ist in der Regel auf 6 Monate begrenzt, kann aber mit einer Add-back-Therapie über diesen Zeitraum hinaus verlängert werden. Die Add-back-Therapie beeinflusst die Schmerzreduktion nicht [1, 17].
GnRH-Antagonisten können im Gegensatz dazu oral eingenommen werden. In Deutschland ist seit Oktober 2023 Relugolix (in Kombination mit Estradiol und NETA) zur Behandlung Endometriose-assoziierter Beschwerden nach vorheriger medizinischer oder chirurgischer Behandlung verfügbar. Studien (SPIRIT 1 und 2) zeigten eine signifikante Schmerzreduktion (Dysmenorrhoe, nicht-menstrueller Unterbauchschmerz, Dyspareunie) und Besserung der Alltagsbewältigung [18]. Linzagolix wurde im November 2024 in Deutschland in einer Dosierung von 200 mg in Kombination mit einer Add-back-Therapie zugelassen. Es reduziert signifikant Schmerzen (Dysmenorrhoe, Beckenschmerzen, Dyschezie) und verbessert die Fähigkeit zu täglichen Aktivitäten [19].
Der Einsatz von kombinierten oralen Kontrazeptiva (KOK) zur Reduzierung Endometriose-bedingter Beschwerden ist „off label“ möglich. Die Datenlage reicht nicht aus, um Unterschiede zwischen verschiedenen KOKs oder zwischen KOKs und anderen hormonellen Behandlungsoptionen zu demonstrieren [1].
Primäre und postoperative hormonelle Therapie
Es gibt vermehrt Ansätze, Gestagene und orale Kontrazeptiva als Erstlinientherapeutikum vor operativer Diagnostik bzw. Therapie anzuwenden. Zwischen primär medikamentöser und operativer Therapie gab es keinen signifikanten Unterschied bei der Schmerzlinderung. Es fehlen jedoch valide Daten, um langfristig die Symptomlinderung, die Rezidivwahrscheinlichkeit und den Einfluss auf die Fertilität bei primärer hormoneller Therapie zu beurteilen.
Eine postoperative Therapie mit kombinierten oralen Kontrazeptiva im Langzeitzyklus kann die Rezidivrate von Endometriomen und die Rate an Beschwerden (wie Dysmenorrhoe und chronische Schmerzen) reduzieren. Die Rezidivrate nach sechs Monaten liegt bei einer zyklischen KOK-Anwendung bei 14 % und bei einer kontinuierlichen Anwendung bei 8 % vs. 29 % ohne KOK-Anwendung. Andere Studien zeigen beim exspektativen Management Rezidivraten von 75 % und bei der Anwendung von KOK zwischen 20 und 32 %, wobei hier KOK, die Dienogest enthalten, die niedrigste Rezidivrate hat [20].
In einer Metaanalyse konnte bestätigt werden, dass eine kontinuierliche KOK-Anwendung das Rezidivrisiko von Endometriomen deutlicher senkt als eine zyklische Anwendung [35]. In zahlreichen Untersuchungen wurde die hohe Effektivität von Dienogest nach Endometriomen bestätigt. In umfangreichen Studien mit 1.142 Patienten gab es nur 24 Rezidive mit einem unterschiedlichen Follow-up zwischen 18 und 61 Monaten, d. h., die Rezidivrate beträgt nur 2,1 %, wenn eine Rezidivprophylaxe mit Dienogest erfolgte [21].
Konsensbasierte Empfehlung 4.E15 (neu 2024): Hat eine Patientin mit Endometriose bereits zwei hormonelle Therapien ohne ausreichende Besserung der Beschwerden erhalten, sollte eine Reevaluation in einer Einrichtung durchgeführt werden, die auf die Betreuung von Patientinnen mit Endometriose spezialisiert ist [1].
Konsensbasiertes Statement 4.S9 (geprüft 2024): Sowohl zur Behandlung von Endometriose-assoziierten Beschwerden als auch hinsichtlich der Verlängerung des rezidivfreien Intervalls ist eine langfristig, durchgehend angewendete hormonelle Therapie effektiv [1].
Multimodale Therapie der Endometriose
Endometriose ist eine komplexe, multifaktorielle Erkrankung, die alle Lebensbereiche der Frau betreffen kann. Gemäß dem bio-psycho-sozialen Verständnis wirken dabei körperliche, psychologische und soziale Faktoren zusammen, die Krankheitslast und Leidensdruck bestimmen. Da weder eine Prävention noch eine ursächliche Therapie der Endometriose bekannt ist, zielt die Behandlung darauf ab, eine möglichst lange Beschwerdefreiheit zu erreichen, funktionelle Einschränkungen zu reduzieren, Organschäden zu vermeiden und die Therapie an die individuelle Lebenssituation der Patientin anzupassen, um ihre Lebensqualität zu verbessern [1].
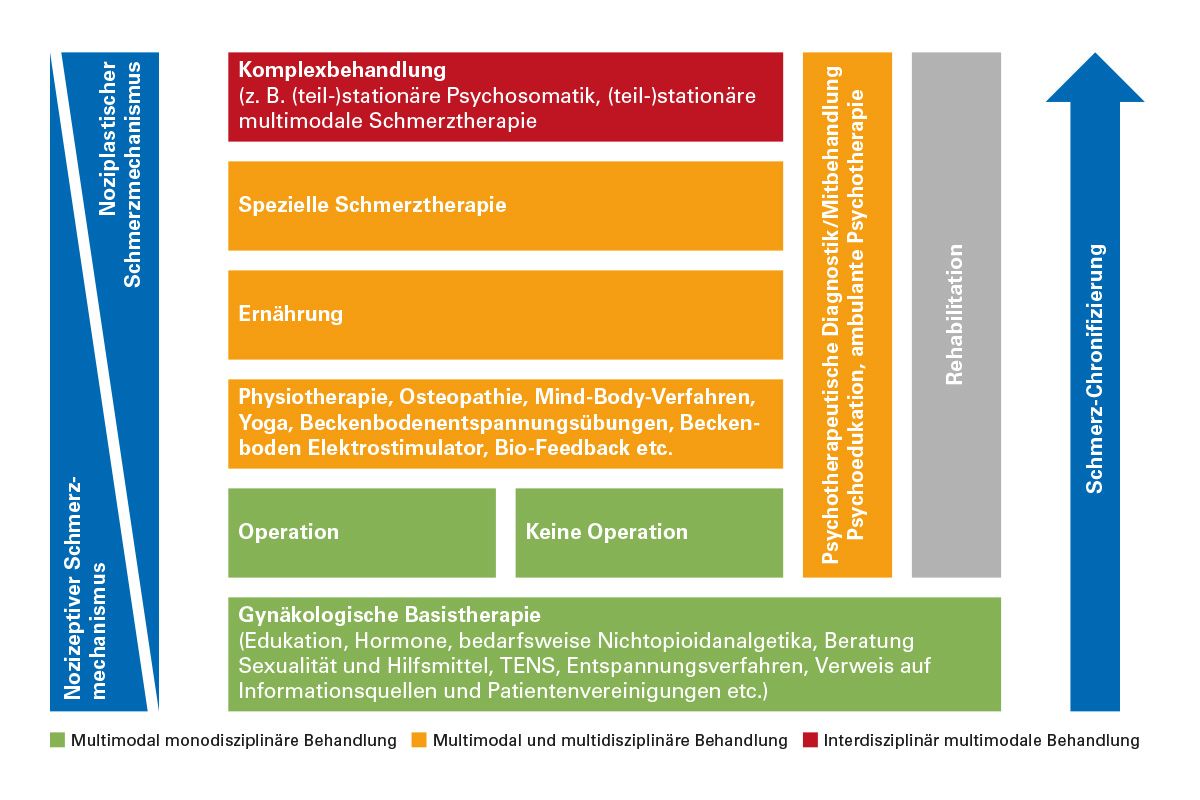
Die Kombination aus unterschiedlichen Therapieverfahren, wie medikamentöse Therapie und Physiotherapie, wird als multimodaler Ansatz bezeichnet. Eine parallele, aber nicht unbedingt in enger Abstimmung erfolgende Behandlung durch unterschiedliche Disziplinen (z. B. Gynäkologe, Schmerztherapeut und Physiotherapeut) entspricht einer multidisziplinären Behandlung.
Im Gegensatz dazu beinhaltet die interdisziplinäre multimodale Therapie eine enge und systematisch abgestimmte Zusammenarbeit zwischen den verschiedenen beteiligten Fachdisziplinen, beispielsweise in Form systematischer Teambesprechungen oder Fallkonferenzen (Abb. 4) [1]. Dieser Ansatz integriert verschiedene Behandlungsmethoden und -techniken, um sowohl körperliche als auch psychische und soziale Komponenten der Erkrankung zu adressieren. Die Kombination der Therapiemaßnahmen wird dabei fortlaufend aufeinander abgestimmt, und es werden räumliche sowie inhaltliche gemeinsame Angebote unterbreitet.
Durch diese eng abgestimmte Koordination und Integration fachlicher Expertise und verschiedener Therapieansätze wird versucht, die bestmögliche Gesamtwirkung auf die Patientin zu erzielen. Der Ansatz der interdisziplinären multimodalen Therapie kann nur in Zentren und/oder abgeschlossenen Teams erfolgen und erfordert eine definierte Team- und Kommunikationsstruktur.
Konsensbasierte Empfehlung 4.E32 (neu 2024): Liegt bei einer Patientin mit Endometriose eine chronische Schmerzstörung vor, sollte die Schmerzbehandlung im Rahmen einer interdisziplinären multimodalen Schmerztherapie angeboten werden [1].
Es ist sinnvoll, dass die Behandlung von Endometriose-assoziierten Schmerzen ab Diagnosestellung bereits frühzeitig im Rahmen eines multimodalen Therapiekonzeptes erfolgt, im Sinne einer Kombination aus verschiedenen Therapieansätzen (z. B. Analgetika, Hormone). Da es bisher keine ausreichende Datengrundlage für die Effektivität spezifischer Effekte für die meisten Therapieansätze im Kontext der multimodalen Schmerzbehandlung Endometriose-assoziierter Schmerzen gibt, insbesondere für den chronischen Schmerz, orientiert sich ein Großteil der Therapie an allgemeinen Prinzipien der Behandlung chronischer Schmerzen [22, 23] sowie der Behandlung chronischer Unterbauchschmerzen der Frau [24].
Neben der medikamentösen und/oder operativen Behandlung der Endometriose selbst kommen bezüglich Endometriose-assoziierter Schmerzen nicht nur Analgetika und ggf. Co-Analgetika, sondern auch nichtmedikamentöse Verfahren, physiotherapeutische sowie frühzeitig psychotherapeutische Therapie zum Einsatz. Die (Psycho-)Edukation der Patientinnen und die Erarbeitung eines sinnvollen Krankheits- und Schmerzverständnisses nach bio-psycho-sozialer Sichtweise hat eine hohe Bedeutung. Dabei ist es wichtig, die Unterstützung katastrophisierender Gedanken, maladaptiver Krankheitskonzepte und Nocebo-Effekte zu vermeiden und ggf. Placeboeffekte in der Kommunikation bewusst zu nutzen [1].
Die Umsetzung interdisziplinärer multimodaler Schmerztherapie erfordert eine interdisziplinäre Schmerzdiagnostik durch mindestens drei Fachdisziplinen, obligatorisch eine psychiatrische, psychosomatische oder psychologische Disziplin. Der deutsche Operationen- und Prozedurenschlüssel (OPS-Ziffer 8-918.x) definiert die Kriterien hierfür [25].
Diese umfassen eine interdisziplinäre Behandlung chronischer Schmerzzustände unter Einbeziehung von mindestens zwei Fachdisziplinen, davon eine psychiatrische, psychosomatische oder psychologisch-psychotherapeutische Disziplin. Die Behandlungsleitung erfolgt durch einen Facharzt mit Zusatzbezeichnung Spezielle Schmerztherapie und nach festgelegtem Behandlungsplan. Täglich ärztliche Visiten oder Teambesprechungen bzw. wöchentliche interdisziplinäre Teambesprechungen sind Voraussetzung.
Zur Anwendung kommen mindestens drei aktive Therapieverfahren (z. B. Psychotherapie, Physiotherapie, Entspannungsverfahren). Die Patienten müssen mindestens drei Merkmale aufweisen, darunter manifest oder drohende Beeinträchtigung der Lebensqualität, Fehlschlag vorheriger unimodaler Schmerztherapie, bestehende Medikamentenabhängigkeit oder -fehlgebrauch, schmerzunterhaltende psychische Begleiterkrankung oder gravierende somatische Begleiterkrankung.
Konsensbasierte Empfehlung 4.E33 (neu 2024): Falls die Endometriose mit chronischen Schmerzen einhergeht, sollten psychotherapeutische Verfahren in ein multimodales Konzept eingebettet werden [1].
Oft entwickeln Frauen mit chronischen Verläufen und Schmerzen Komorbiditäten, besonders im psychologischen Bereich, was zu sozialem Rückzug führen kann. Studien zeigen eine hohe Prävalenz von depressiven Symptomen und Angststörungen bei Endometriose [26, 27]. Die Lebensqualität von Patientinnen mit Endometriose ist signifikant eingeschränkt [28].
Schmerztherapie
Die medikamentöse Schmerztherapie ist zentral in der Behandlung Endometriose-assoziierter Schmerzen und erfolgt individuell angepasst an Intensität, Lokalisation und Charakter der Beschwerden.
Konsensbasierte Empfehlung 4.E16 (modifiziert 2024): Bei Patientinnen mit chronischen Unterbauchschmerzen sollte eine symptomenorientierte Schmerztherapie angeboten werden bei:
- Anhaltender schmerzbedingter Beeinträchtigung unter hormoneller und/oder operativer Therapie.
- Unverträglichkeit und/oder Kontraindikation einer Hormontherapie.
- Kontraindikation für eine Operation.
Nichtsteroidale Antiphlogistika (NSAR) können bei nozizeptivem Schmerzmechanismus zur symptomatischen Schmerztherapie eingesetzt werden. Metamizol kann aufgrund seines Wirkungsspektrums (analgetisch, antipyretisch, spasmolytisch) gut eingesetzt werden. Paracetamol ist zur symptomatischen Behandlung leichter bis mäßig starker Schmerzen und/oder Fieber zugelassen, hat eine geringere analgetische Wirkung im Vergleich zu anderen Nichtopioidanalgetika und eine geringe therapeutische Breite. Jede Substanz sollte mit der niedrigsten notwendigen Dosierung und nur so lange wie unbedingt notwendig verabreicht werden.
Konsensbasierte Empfehlung 4.E18 (neu 2024): Leiden Patientinnen mit Endometriose unter chronischen Schmerzen, können je nach zugrunde liegendem Schmerzmechanismus folgende Substanzen als individueller Therapieversuch erwogen werden:
- Antidepressiva (trizyklische Antidepressiva). Citalopram ist effektiv bei der Reduktion depressiver Symptome und zeigt einen Trend zur Schmerzminderung. Eine empirische Therapie ist gerechtfertigt, da sie die Lebensqualität verbessert.
- Cannabisbasierte Arzneimittel.
- Gabapentinoide (Gabapentin, Pregabalin).
- Opioidanalgetika: Ein Therapieversuch kann erwogen werden, wenn der Effekt von Nichtopioidanalgetika unzureichend ist oder Kontraindikationen bestehen. Der Einsatz kann phasenweise begrenzt sein [1, 29].
Konsensbasierte Empfehlung 4.E19 (neu 2024): Die Notwendigkeit einer Langzeiteinnahme von Substanzen zur symptomatischen Schmerztherapie sollte für jede medikamentöse Schmerztherapie bei Patientinnen mit Endometriose multiprofessionell (z. B. unter Einbezug interdisziplinärer schmerzmedizinischer und psychotherapeutischer Abstimmung) überprüft werden [1].
Psychosomatische Therapie
Bei Endometriose-Patientinnen mit assoziierten Schmerzsyndromen ist es sinnvoll, Therapieoptionen mit Schmerztherapeuten und Fachärzten für Psychosomatische Medizin und Psychotherapie abzustimmen. Zurückhaltung ist bei wiederholten operativen Eingriffen zur Schmerzreduktion geboten, da vorbestehende chronische Schmerzsyndrome ein negativer prognostischer Prädiktor für den Erfolg einer Endometriose-Operation sind.
Konsensbasierte Empfehlung 4.E22 (geprüft 2024): Eine primäre Untersuchung auf Angst und Depression sollte bei Patientinnen mit Endometriose im Rahmen der gynäkologischen psychosomatischen Grundversorgung durchgeführt werden [1].
Mögliche Praxiswerkzeuge sind der Gesundheitsfragebogen PHQ 4 oder in erweiterter Form die Gesundheitsfragebögen PHQ9 und GAD7 [1].
Konsensbasierte Empfehlung 4.E23 (neu 2024): Psychotherapeutische Verfahren, insbesondere die Kognitive Verhaltenstherapie und achtsamkeitsbasierte Interventionen, können bei hoher psychischer und/oder körperlicher Symptombelastung empfohlen werden [1].
Komplementäre Therapien
Es gibt kleinere, prospektive, randomisierte Studien zu verschiedenen integrativen Therapiemethoden hinsichtlich der Effektivität der Schmerzreduktion. Progressive Muskelrelaxation und selbst angewendete Unterbauchmassage können zur Linderung bei Menstruationsschmerzen erwogen werden.
Ein achtwöchiges Bewegungs- bzw. Sportprogramm (aerobes und Krafttraining, Dehnübungen) führte bei Endometriose-assoziierten Beschwerden auch nach 12 Monaten zu einer signifikant höheren Lebensqualität. Regelmäßige körperliche Aktivität (mindestens drei Tage pro Woche) kann Schmerzen reduzieren. Yoga-Programme zeigten eine hohe Effektgröße bei primärer Dysmenorrhoe und waren den Kontrollen überlegen.
Physiotherapie kann Schmerzen und physikalische Funktionen verbessern. Zur Physiotherapie gibt es jetzt die konsensbasierte Empfehlung 4.E27 (neu 2024): Physiotherapie, entsprechend der individuellen Symptomatik, sollte mit in das Therapiekonzept bei Patientinnen mit Endometriose aufgenommen werden [1].
Konsensbasierte Empfehlung 4.E30 (neu 2024): Patientinnen mit Endometriose sollte eine gesunde (vitamin- und ballaststoffreiche) Ernährung empfohlen werden. Spezielle Diäten ohne Indikation (z. B. Nahrungsmittelunverträglichkeit) sollten nicht durchgeführt werden [1].
Studien zu glutenfreier Ernährung, Vitamin-D-Supplementierung, sowie Ernährung reich an Antioxidantien oder Omega-3-Fettsäuren zeigten eine signifikante Schmerzreduktion, die Zuverlässigkeit der Ergebnisse ist jedoch begrenzt [30, 31].
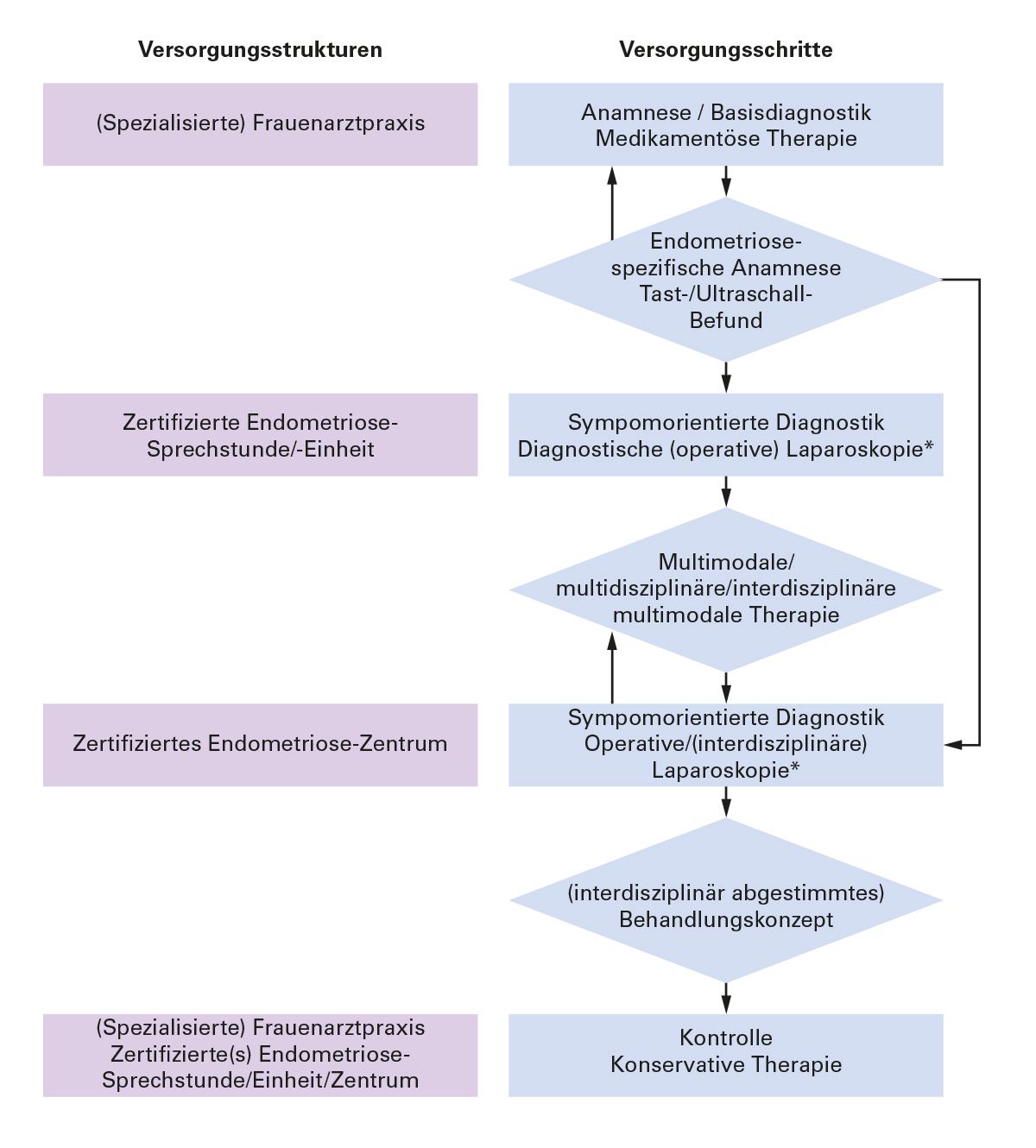
Das Therapieangebot in zertifizierten Rehabilitationseinrichtungen basiert auf dem bio-psycho-sozialen Krankheitsmodell und kann dem Bedarf der Frauen nach Information, Schulung, psychischer und sozialmedizinischer Unterstützung, Physio-, Balneo-, Ernährungs- und sonstiger Therapien durch ein multidisziplinäres und multiprofessionelles Team entsprechen. Die mögliche Zusammenarbeit zwischen gynäkologischen Praxen und spezialisierten Endometriosezentren ist in Abbildung 5 dargestellt.
Frauen mit Endometriose sollen auf Angebote der Kostenträger, sowohl im stationären (hier Anschlussheilbehandlung) als auch im ambulanten Versorgungsbereich und zur Reha-Nachsorge, hingewiesen werden.
Konsensbasierte Empfehlung 8.E72 (geprüft 2024): Zur Unterstützung in der Bewältigung der körperlichen und seelischen Probleme, die auf Frauen mit Endometriose zukommen können, sollen Patientinnen über die Angebote der Selbsthilfe informiert werden [1].
Konsensbasierte Empfehlung 8.E73 (modifiziert 2024): Die Teilnahme von Frauen mit Endometriose an Informationsveranstaltungen über Endometriose sollte angeregt und unterstützt werden [1].
Endometriosetherapie bei Kinderwunschpatientinnen
Die Endometriose betrifft auch viele Kinderwunschpatientinnen [32]. Oft wird die Endometriose erst im Zuge der zur Kinderwunschdiagnostik durchgeführten Laparoskopie entdeckt. Dann stellt sich die Frage, inwieweit es eine relevante Assoziation zwischen Endometriose und Kinderwunsch gibt und welche Therapieansätze relevant sind.
Die Erfolge medikamentöser Therapien bei Infertilität sind begrenzt. Die chirurgische Therapie der Endometriose ist bei Kinderwunschpatientinnen oft noch immer die Therapie der Wahl. Mit der chirurgischen Methode können auch andere Probleme, die die Fertilität beeinträchtigen, beseitigt werden – wie Adhäsionen – und die Anatomie kann wiederhergestellt werden.
Gute Hinweise gibt es dagegen für den Einsatz von Psychotherapie bei unerfülltem Kinderwunsch und Fruchtbarkeitsbehandlungen. Psychotherapeutische Unterstützung (KVT, achtsamkeitsbasierte Interventionen) kann depressive und ängstliche Symptome sowie die Lebensqualität verbessern. Studien zeigen, dass psychologische Interventionen während der Kinderwunschbehandlung mit einer signifikant höheren Schwangerschaftsrate assoziiert waren.
Konsensbasierte Empfehlung 4.E34 (neu 2024): Liegt bei einer Patientin mit Endometriose ein unerfüllter Kinderwunsch vor oder wird eine Kinderwunschbehandlung durchgeführt, sollten psychotherapeutische Interventionen, vor allem kognitiv-behaviorale Therapien oder achtsamkeitsbasierte Interventionen angeboten werden [1].
Konsensbasierte Empfehlung 4.E35 (neu 2024): Bei hoher psychischer Belastung durch die Fruchtbarkeitsstörung sollte den betroffenen Frauen regelhaft eine psychotherapeutische Unterstützung angeboten werden. Endometriose geht mit eingeschränkter Empfängnisfähigkeit, erhöhtem Risiko für Schwangerschaftskomplikationen und häufigerem unerfülltem Kinderwunsch einher [1].
Wenn Ovarialendometriosen diagnostiziert werden, ist eine operative Therapie oft unumgänglich. In der Literatur wird oft eine Größe der Endometriosezysten von 4 cm als OP-Indikation angegeben. Problematisch ist in dieser Situation, dass die Entscheidung zur Operation immer unter dem Aspekt der potenziellen Schädigung der ovariellen Reserve getroffen werden muss, da es bei jeder laparoskopischen Ovaroperation auch zum Verlust von gesundem Gewebe kommen kann.
In großen Metaanalysen von über 2.000 Frauen mit Endometriose und Infertilität wurde gezeigt, dass sowohl eine operative Therapie als auch eine GnRH-Analoga-Therapie zu höheren Schwangerschaftsraten führt [33]. In Reviews mit 33 Studien konnte gezeigt werden, dass die Lebendgeburtrate bei IVF im Vergleich zu Frauen ohne Endometriose gleich ist, und auch die klinische Schwangerschaftsrate ist vergleichbar [50]. Allerdings wird bei Frauen mit Endometriomen eine geringere Zahl von Eizellen gewonnen und es erfolgt häufiger ein Zyklusabbruch.
Der Vorteil der Laparoskopie ist die Mitbehandlung weiterer fertilitätsrelevanter Endometrioseherde und/oder von Begleitpathologien wie Adhäsionen, Myomen oder Tubenverschlüssen. Des Weiteren wird die Punktion bei IVF erleichtert und es erfolgt ein sicherer Ausschluss prämaligner oder maligner Prozesse, die allerdings relativ selten sind (unter 3 %). Nachteile der Operation sind das Operations- und Narkoserisiko und die potenzielle Gefahr für die ovarielle Reserve.
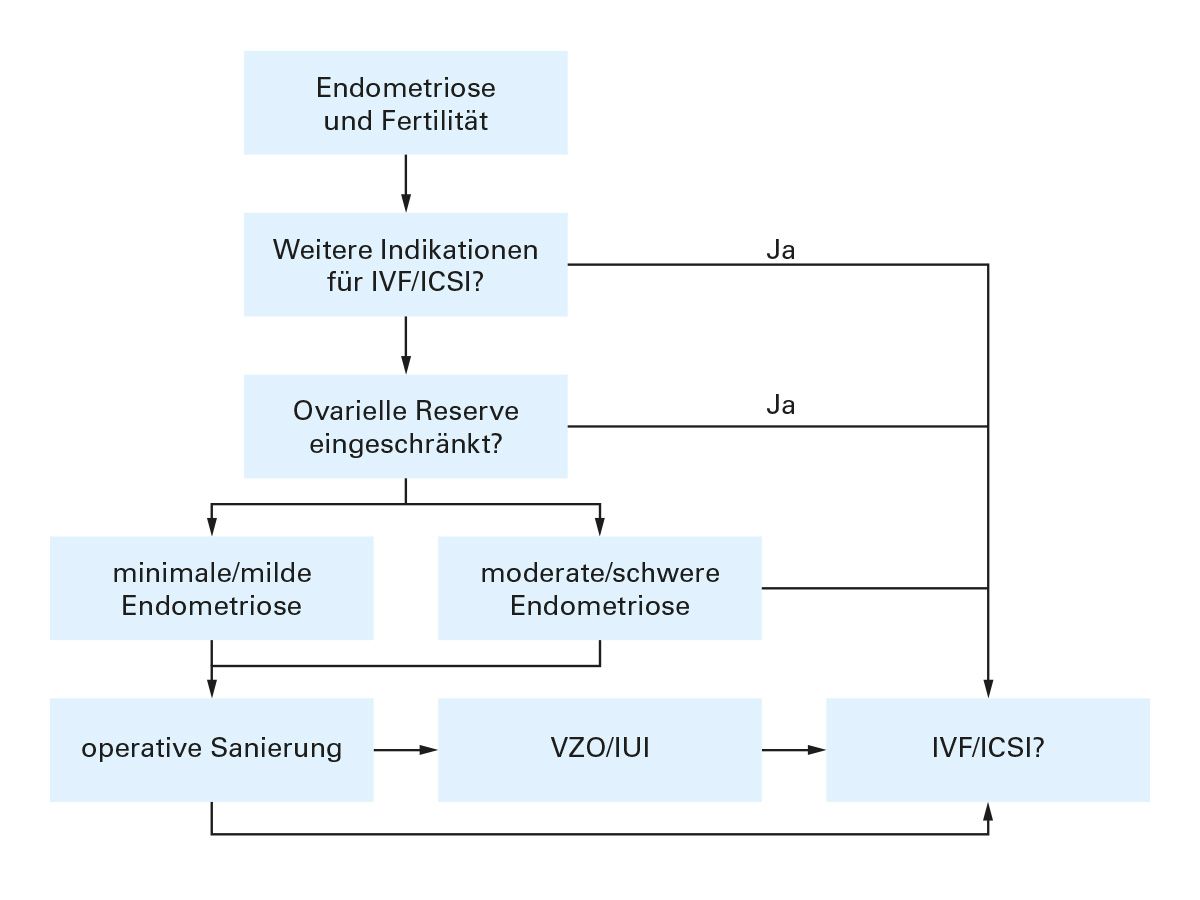
Maßnahmen der assistierten Reproduktion gewinnen zunehmend an Bedeutung. In Studien konnte gezeigt werden, dass bei Inseminationen mit Ovulationsinduktion eine geringe Verbesserung der Schwangerschaftsrate im Vergleich zu Spontanzyklen bei Patientinnen mit Endometriose im Stadium 1 und 2 erreicht wurde [34]. Abbildung 6 gibt eine Übersicht zu Therapieoptionen bei Endometriose und Kinderwunsch.
Häufig stellt sich die Frage, ob die Endometriose unter der Stimulation exazerbieren kann. Dies ist zumindest nicht belegt. Vermutlich ist eher der lange Zeitraum relevant, in dem die Patientin wegen des Kinderwunsches keine adäquate medikamentöse Therapie erhalten kann. Dadurch wird das Rezidivrisiko erhöht. Deshalb wird oft auch eine Vorbehandlung mit GnRH-Analoga bei schweren Endometriosen vor einer IVF durchgeführt. Hier konnte allerdings in einer Cochrane-Analyse kein eindeutiger positiver Effekt auf die Schwangerschaftsrate gezeigt werden [35]. Bei Patientinnen mit schweren Endometriosen sollte die Zeitspanne ohne Hormontherapie bis zur Schwangerschaft so kurz wie möglich gehalten werden [36].
Fazit
Die Endometriose ist eine komplexe, chronisch-inflammatorische Erkrankung, die durch infiltratives Wachstum organübergreifend streuen und alle Lebensbereiche der Frau beeinträchtigen kann. Die 2025er S2K-Leitlinie zur Diagnostik und Therapie der Endometriose trägt dieser Komplexität Rechnung, indem sie explizit das bio-psycho-soziale Krankheitsmodell in den Fokus rückt. Die Leitlinie 2025 ersetzt die Laparoskopie als diagnostischen „Goldstandard“ durch die transvaginale Sonographie (TVS) und die Einführung der #Enzian-Klassifikation ermöglicht auch die Abbildung von Peritoneal-, Ovarial- und tief infiltrierender Endometriose. Die Therapie der Endometriose zielt darauf ab, eine möglichst lange Beschwerdefreiheit zu erreichen und die Lebensqualität zu verbessern, da weder Prävention noch ursächliche Heilung bekannt sind. Eine langfristige, durchgehende hormonelle Therapie ist effektiv zur Symptomkontrolle und Rezidivprophylaxe. Bei ausbleibender Besserung unter zwei hormonellen Therapien ist eine Reevaluation in einem spezialisierten Zentrum indiziert. Für chronische Schmerzstörungen wird die interdisziplinäre multimodale Schmerztherapie als Goldstandard empfohlen. Insgesamt zeigt die Leitlinie 2025 einen Fortschritt in der ganzheitlichen, patientenzentrierten Versorgung von Frauen mit Endometriose.
Literatur
- Leitlinie „Diagnostik und Therapie der Endometriose“ 2025, Registernummer 015 – 045.Im Internet: . (Zugriff am 09.04.2025)
- Leitlinie „Diagnostik und Therapie der Endometriose“ 2020, Registernummer 015 – 045.
- Bell RJ, Robinson PJ, Skiba MA et al. The impact of endometriosis on work ability in young Australian women. AustN Z J Obstet Gynaecol 2023; 63: 556-563
- Singh SS, Gude K, Perdeaux E et al. Surgical Outcomes in Patients With Endometriosis: A Systematic Review. Journal of obstetrics and gynaecology Canada. JOGC 2020; 42: 881-888.e811
- Göhring J, Drewes M, Kalder M et al. Germany Endometriosis Pattern Changes; Prevalence and Therapy over 2010 and 2019 Years: A Retrospective Cross-Sectional Study. Int J Fertil Steril 2022; 16: 85-89
- Gesundheitsberichterstattung des Bundes. Diagnosedaten der Krankenhäuser ab 2000 (Eckdaten der vollstationären Patienten und Patientinnen). Gliederungsmerkmale: Jahre, Behandlungs-/Wohnort, ICD10. Diese Tabelle bezieht sich auf: Region: Deutschland, ICD10: N80 Endometriose,
- Surrey E, Soliman AM, Trenz H et al. Impact of Endometriosis Diagnostic Delays on Healthcare Resource Utilization and Costs. Adv Ther 2020; 37: 1087-1099
- Lamceva J, Uljanovs R, Strumfa I. The Main Theories on the Pathogenesis of Endometriosis. IInt J Mol Sci 2023; 24
- Raja SN, Carr DB, Cohen M et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain 2020; 161: 1976-1982
- Nnoaham KE et al. Impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries. Fertil Steril 2011; 96: 366-373
- Keckstein J, Saridogan E, Ulrich UA et al. The #Enzian classification: A comprehensive non-invasive and surgical description system for endometriosis. cta Obstet Gynecol Scand 2021; 100: 1165-1175
- Jensen JT et al. Use of combined hormonal contraceptives for the treatment of endometriosis-relatedpain: a systematic review of the evidence. Fertil Steril 2018; 110: 137–152
- Chaichian S et al. Comparing the efficacy of surgery and medical therapy for pain management in endometriosis: a systematic review and metaanalysis. Pain Phys 2017; 20: 185–195
- Nagandla K, Idris N, Nalliah S et al. Hormonal treatment for uterine adenomyosis. Cochrane Database Syst Rev 2014; 11
- Strowitzki T, Faustmann T, Gerlinger C et al. Safety and tolerability of dienogest in endometriosis: pooled analysis from the European clinical study program. Int J Womens Health 2015; 7: 393-401
- Takaesu Y, Nishi H, Kojima J et al. Dienogest compared with gonadotropin-releasing hormone agonist after conservative surgery for endometriosis. J Obstet Gynaecol Res 2016; 42: 1152-1158
- Veth VB, van de Kar MM, Duffy JM et al. Gonadotropin-releasing hormone analogues for endometriosis. Cochrane Database Syst Rev 2023; 6: Cd014788
- Giudice LC, As-Sanie S, Arjona Ferreira JC et al. Once daily oral relugolix combination therapy versus placebo in patients with endometriosis-associated pain: two replicate phase 3, randomised, double-blind, studies (SPIRIT 1 and 2). Lancet (London, England) 2022; 399: 2267‐2279
- Donnez J, Taylor HS, Taylor RN et al. Treatment of endometriosis-associated pain with linzagolix, an oral gonadotropin-releasing hormone-antagonist: a randomized clinical trial. Fertil Steril 2020; 114: 44-55
- Römer T. Therapie der Ovarialendometriose. Privatarzt Gynäkol 2020, 11(4): 22-23
- Murji A et al. Use of dienogest in endometriosis: a narrative literature review and expert commentary. Curr Med Res Opin 2020; 36: 895-907
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie Nicht-spezifischer Kreuzschmerz – Kurzfassung, 2. Auflage. Version 1. 2017 [cited: 2024-01-27]. DOI: 10.6101/AZQ/000377. Im Internet unter: www.kreuzschmerz.versorgungsleitlinien.de (Zugriff am 17.02.2024)
- Petzke F, Brückle W, Eidmann U et al. [General treatment principles, coordination of care and patient education in fibromyalgia syndrome : Updated guidelines 2017 and overview of systematic review articles]. Schmerz 2017; 31: 246-254
- S2k-Leitlinie der Deutschen Gesellschaft für Psychosomatische Frauenheilkunde und Geburtshilfe e.V. (2022): Chronischer Unterbauchschmerz der Frau. AWMF-Leitlinien-Register-Nr. 016-001. Im Internet unter: https://register.awmf.org/de/leitlinien/detail/016-001
- OPS Version 2022, Kapitel 8 NICHT OPERATIVE THERAPEUTISCHE MASSNAHMEN, (8-01…8-99), Bundesinstitut für Arzneimittel und Medizin-produkte (BfArM). Im Internet unter: https://klassifikationen.bfarm.de/ops/kode-suche/htmlops2022/chapter-8.htm (Zugriff am 09.04.2025)
- Netzl J, Gusy B, Voigt B et al. Chronic Pelvic Pain in Endometriosis: Cross-Sectional Associations with Mental Disorders, Sexual Dysfunctions and Childhood Maltreatment. J Clin Med 2022; 11
- Pehlivan MJ, Sherman KA, Wuthrich V et al. The effectiveness of psychological interventions for reducing poor body image in endometriosis, PCOS and other gynaecological conditions: a systematic review and meta-analysis. Health Psychol Rev 2024; 18: 341-368
- Szypłowska M, Tarkowski R, Kułak K. The impact of endometriosis on depressive and anxiety symptoms and quality of life: a systematic review. Front Public Health 2023; 11: 1230303
- Häuser W, Bock F, Hüppe M et al. [Recommendations of the second update of the LONTS guidelines : Long-term opioid therapy for chronic noncancer pain]. Schmerz 2020; 34: 204-244
- Nirgianakis K, Egger K, Kalaitzopoulos DR et al. Effectiveness of Dietary Interventions in the Treatment of Endometriosis: a Systematic Review. Reprod Sci (Thousand Oaks, Calif) 2022; 29: 26-42
- Bajalan Z, Alimoradi Z, Moafi F. Nutrition as a Potential Factor of Primary Dysmenorrhea: A Systematic Review of Observational Studies. Gynecol Obstet Invest 2019; 84: 209-224
- Hughes E et al. Ovulation suppression for Endometriosis Cochrane Database Syt Rev 2007: 18: CD155
- Hodgson RM et al. Interventions for endometriosis-related infertility: a systematic review and network meta-analysis. Fertil Steril 2020; 113: 374-382
- Leung AS et al. The benefits of other treatments than in vitro fertilization to aid conception in minimal and mild endometriosis. Minerva Ginecol 2016; 68: 675-686
- Georgiou EX et al. Long term GnRH agonist therapy for IVF for improving fertility outcomes in women with endometriosis. Cochrane Database Syst Rev 2019; CD013240
- Schüring A, Kiesel L. Endometriose und Kinderwunsch. Gynäkol 2020; 53: 666-670



Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.