Inhalationstechnik und Lungendeposition bei Patientinnen und Patienten mit COPD – Voraussetzung für Adhärenz und Therapieerfolg
Interessengebiete: Allgemeinmedizin und Innere Medizin, Hals-Nasen-Ohrenheilkunde, Pneumologie
Die COPD (chronisch obstruktive Lungenerkrankung) ist eine chronische und in der Regel progrediente Atemwegs- und Lungenerkrankung. Sie ist bezüglich Morbidität und Mortalität weltweit eine der häufigsten Erkrankungen. Sie zählt zu den drei häufigsten Todesursachen mit steigender Tendenz. Vor allem das Auftreten von Exazerbationen verschlechtert die Prognose erheblich. Aber auch die Lebensqualität, die für die alltäglichen Aktivitäten der Patient:innen wichtig ist, wird durch Exazerbationen stark beeinträchtigt. Deshalb sind die Krankheitskontrolle sowie die Vermeidung von Exazerbationen und den damit verbundenen Komplikationen, wie Hospitalisierung und Mortalität, wichtige Therapieziele. Neben Raucherentwöhnung und Bewegung spielen inhalative Medikamente eine zentrale Rolle. Fehler bei der Anwendung der Inhalationsgeräte und eine unzureichende Adhärenz erschweren die Kontrolle der Erkrankung. Daher sind die korrekte Anwendung der Inhalationsgeräte sowie die Adhärenz wichtige Faktoren für den Therapieerfolg. Um die Patient:innen umfassend und überzeugend aufklären zu können, müssen Ärzt:innen selbst gut über die Unterschiede sowie Vor- und Nachteile der Inhalationssysteme informiert sein. Mit diesem Ziel bietet diese CME relevante Informationen zu den Grundlagen der korrekten Inhalationstechnik, die entscheidend für eine adäquate Lungendeposition und somit für den Therapieerfolg ist.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Einfluss der COPD auf die gesundheitsbezogene Lebensqualität
- Nicht-medikamentöse Therapie der COPD
- Medikamentöse Therapie der COPD
- Die Rolle des Verabreichungswegs
- Die korrekte Inhalationstechnik
- Die Inhalationssysteme im Überblick
- Der entscheidende Faktor: Periphere Lungendeposition des Wirkstoffs
- Der Einfluss der Atemanhaltezeit auf die Lungendeposition
- Weitere Einflussfaktoren
- Empfehlungen zur Patient:innenschulung in der täglichen Praxis
- Bedeutung nicht-ärztlicher Berufsgruppen in der langfristigen Betreuung
- Patient:innenseitige Kriterien für die Auswahl des Inhalationssystems
- Fazit
- Literatur
Einleitung
Diese CME richtet sich an Pneumolog:innen, Allgemeinärzt:innen, Praktiker:innen und Internist:innen. Die COPD (chronisch obstruktive Lungenerkrankung) ist eine chronische und in der Regel progrediente Atemwegs- und Lungenerkrankung. Sie ist bezüglich Morbidität und Mortalität weltweit eine der häufigsten Erkrankungen. Sie zählt zu den drei häufigsten Todesursachen mit steigender Tendenz [1]. Vor allem das Auftreten von Exazerbationen verschlechtert die Prognose erheblich [1]. Aber auch die Lebensqualität, die für die alltäglichen Aktivitäten der Patient:innen wichtig ist, wird durch Exazerbationen stark beeinträchtigt. Deshalb sind die Krankheitskontrolle sowie die Vermeidung von Exazerbationen und den damit verbundenen Komplikationen, wie Hospitalisierung und Mortalität, wichtige Therapieziele. Neben Raucherentwöhnung und Bewegung spielen inhalative Medikamente eine zentrale Rolle. Fehler bei der Anwendung der Inhalationsgeräte und eine unzureichende Adhärenz erschweren die Kontrolle der Erkrankung. Daher sind die korrekte Anwendung der Inhalationsgeräte sowie die Adhärenz wichtige Faktoren für den Therapieerfolg. Um die Patient:innen umfassend und überzeugend aufklären zu können, müssen Ärzt:innen selbst gut über die Unterschiede sowie Vor- und Nachteile der Inhalationssysteme informiert sein. Mit diesem Ziel bietet diese CME relevante Informationen zu den Grundlagen der korrekten Inhalationstechnik, die entscheidend für eine adäquate Lungendeposition und somit für den Therapieerfolg ist.
Einfluss der COPD auf die gesundheitsbezogene Lebensqualität
Die gesundheitsbezogene Lebensqualität (HRQoL) ist ein multidimensionales Konstrukt aus physischen, psychischen und sozialen Dimensionen, das sich wesentlich an der subjektiven Wahrnehmung durch die Patient:innen orientiert. Hierbei spielen Alltagsaktivitäten und das allgemeine Wohlbefinden der Patient:innen eine entscheidende Rolle. Neben dem negativen Einfluss auf die Progression der COPD und die Hospitalisierungsrate beeinträchtigen Exazerbationen vor allem auch die gesundheitsbezogene Lebensqualität der Betroffenen: Patient:innen mit häufigen Exazerbationen haben eine schlechtere Lebensqualität als Patient:innen mit weniger häufigen Exazerbationen (Abb. 1) [1, 2].
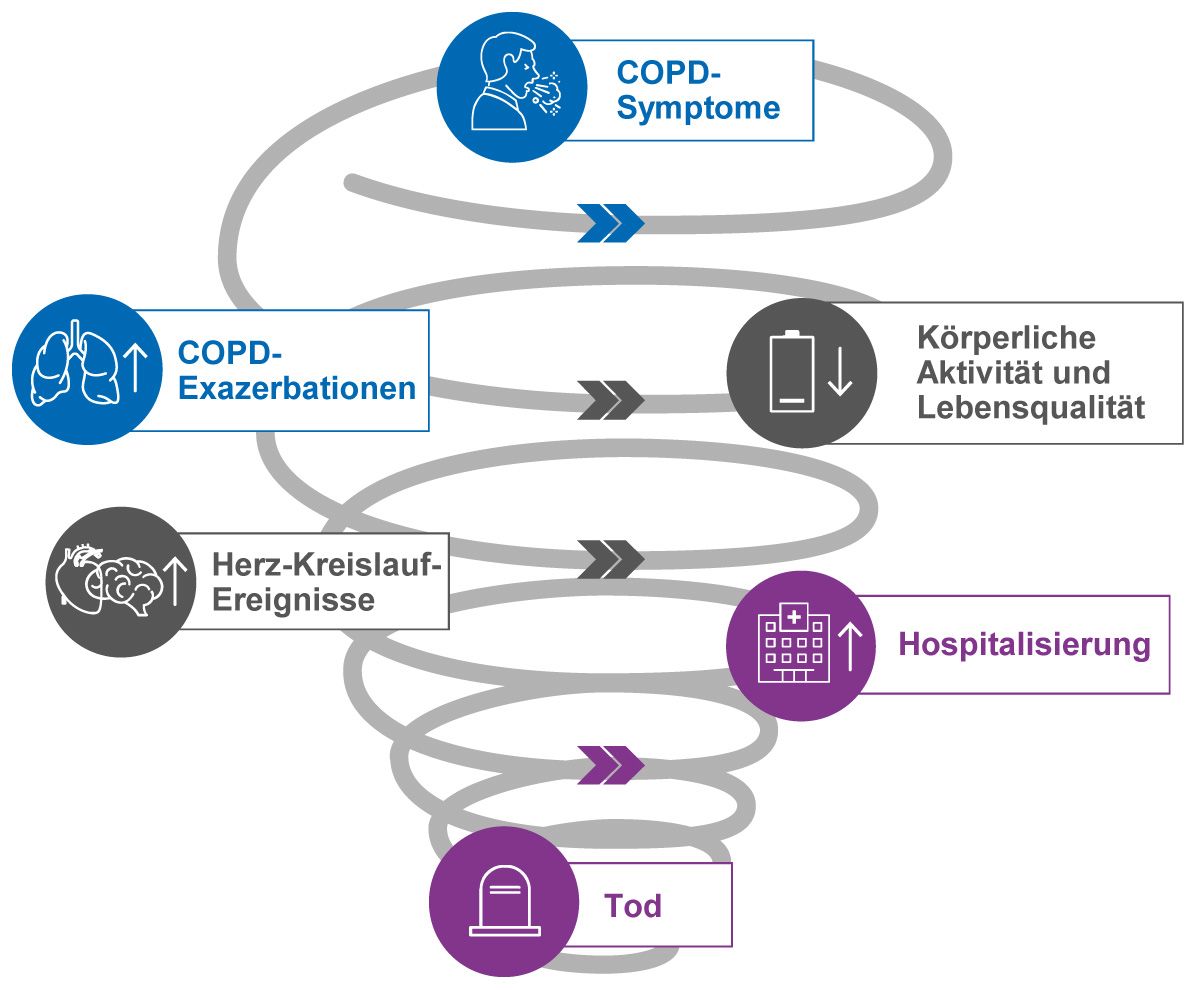
Abb. 1: Chronisch-progredienter Verlauf der COPD mit Auswirkung der Exazerbationsrate auf die gesundheitsbezogene Lebensqualität, Herz-Kreislauf-Ereignisse, Hospitalisierung und Mortalität (modifiziert nach [3-5]).
Der St George‘s Respiratory Questionnaire für COPD-Patient:innen (SGRQ-C) ist ein validierter und etablierter Fragebogen zur Messung der Lebensqualität als Patient Reported Outome (PRO) bei COPD. In einer Studie konnte ein signifikanter Unterschied im SGRQ-C- Gesamtscore bei Patient:innen ohne Exazerbation im Vergleich zu Patient:innen mit ≥ 1 Exazerbation gezeigt werden, wobei mittelschwere und schwere Exazerbationen einen größeren negativen Einfluss auf die HRQoL hatten. Zudem wurde nachgewiesen, dass eine Steigerung der Lebensqualität mit einem höheren Anteil an exazerbationsfreien Tagen korrelierte [6].
Somit ist die Verringerung der mit Exazerbationen assoziierten Morbidität unmittelbar mit einer Verbesserung der Lebensqualität bei Patient:innen mit COPD sowie langfristig mit der Vermeidung von Hospitalisierungen und der Verringerung des Mortalitätsrisikos assoziiert [2].
Nicht-medikamentöse Therapie der COPD
Die Rauchentwöhnung ist bislang die wirksamste Intervention, um die Progression der COPD zu verlangsamen [1]. Deshalb soll rauchenden COPD-Patient:innen dringend die vollständige und dauerhafte Abstinenz empfohlen werden [7].
Eine weitere nicht-medikamentöse Therapiemaßnahme stellt das körperliche Training dar: Laut der Nationalen VersorgungsLeitlinie (NVL) COPD sollen alle Patient:innen unabhängig vom Krankheitsstadium über die hohe Relevanz und den Nutzen von körperlicher Aktivität im Alltag und von körperlichem Training aufgeklärt werden [7].
Pneumologische Rehabilitation bei COPD ist ein evidenzbasiertes, interdisziplinäres und multimodales Maßnahmenpaket, welches die Re-Hospitalisierungsrate und das Mortalitätsrisiko signifikant senken kann [7, 8, 9]. Die Initiierung der pneumologischen Rehabilitation innerhalb von 90 Tagen nach Krankenhausentlassung war in einer Studie mit einem signifikant geringeren Mortalitätsrisiko über ein Jahr verbunden als bei Patient:innen ohne oder mit einer späteren pneumologischen Rehabilitation (Hazard Ratio: 0,63 [95 %-Konfidenzintervall [KI]: 0,57; 0,69]; p < 0,001) [9].
Chancen und Möglichkeiten bieten auch Telemedizin und digitale Gesundheitsanwendungen bzw. Apps wie z. B. Kaia COPD [10] oder Aktiv mit COPD [11]. So können COPD-Patient:innen dank digitaler Helfer beim Selbstmanagement ihrer chronischen Erkrankung unterstützt werden und einen Benefit durch eine medizinische Betreuung via Telemedizin erfahren – vor allem, wenn sie im ländlichen Bereich wohnhaft sind und sich mit schwächeren Versorgungsstrukturen konfrontiert sehen [7].
Ferner soll zur Erhaltung, Verbesserung und Wiederherstellung der Atemfunktion eine Atemphysiotherapie angewendet werden. Vor allem Selbsthilfetechniken bei Atemnot sollen allen Patient:innen mit COPD im Rahmen von Schulungen, Lungensport, physiotherapeutischen oder rehabilitativen Interventionen vermittelt werden [7].
Weiterhin soll untergewichtigen oder adipösen Patient:innen mit COPD eine Ernährungsberatung angeboten werden [7], während interventionelle Verfahren (u. a. endoskopische Lungenvolumenreduktion, Rheoplastie, Denervation) bei ausgewählten Patient:innenkollektiven eine sinnvolle nicht-medikamentöse Therapieoption darstellen können [1, 12, 13].
Medikamentöse Therapie der COPD
Für die medikamentöse Dauertherapie der COPD steht heute ein breites Spektrum an Wirkstoffen zur Verfügung, das im Wesentlichen aus langwirksamen Beta2-Rezeptoragonisten bzw. Muskarin-Rezeptorantagonisten (LABA bzw. LAMA) oder kurzwirksamen Beta2-Rezeptoragonisten bzw. Muskarin-Rezeptorantagonisten (SABA bzw. SAMA) zur Bronchodilatation sowie aus oralen bzw. inhalativen Corticosteroiden (OCS bzw. ICS) besteht [1, 7]. Diese kommen vorrangig in inhalativer Form entweder als Einzelsubstanzen oder in Wirkstoffkombinationen zur Anwendung. Eine Besonderheit der medikamentösen COPD-Therapie stellt das enge Zusammenspiel zwischen Wirkstoffkombination, Galenik und Inhalationsgerät dar. Die Vielfalt verfügbarer Inhalationssysteme ist im praktischen Alltag mitunter schwer zu überblicken, fundierte Kenntnisse über die einzelnen Systemen sind für die Differentialtherapie der COPD jedoch von erheblicher Bedeutung, um eine patient:innenindividuelle Therapie zu ermöglichen.
Die Rolle des Verabreichungswegs
Im Vergleich zu anderen Applikationsformen bietet die Inhalation eine Reihe von Vorteilen bei der Behandlung von Lungenerkrankungen. So wird ein Medikament direkt an das Zielorgan abgegeben, was zu hohen pulmonalen und gleichzeitig niedrigen systemischen Wirkstoffkonzentrationen führt. Dies ist in der Regel mit einer hohen Wirksamkeit bei einem geringen systemischen Nebenwirkungsprofil verbunden [14, 15]. Die Inhalationstherapie stellt somit die fundamentale Säule der Krankheitskontrolle bei COPD- Patient:innen dar und kann entscheidend zur Symptomlinderung, Reduktion der Häufigkeit und des Schweregrades von Exazerbationen und ferner zu einer Verbesserung der Lebensqualität sowie der körperlichen Leistungsfähigkeit beitragen.
Eine pharmakokinetische Studie untersuchte in Abhängigkeit des Verabreichungsweges die Wirkstoffkonzentrationen in verschiedenen Kompartimenten der Lunge und verglich diese mit der Blutplasmakonzentration. Für die eingesetzten Medikamente wurden pharmakokinetische Profile aus verschiedenen Lungenkompartimenten (Epithelflüssigkeit, Parenchym) sowie dem Plasma erstellt. Die Inhalation des häufig als Bedarfsmedikation angewendeten Salbutamol (SABA) führte beispielsweise zu einer über 100-fach höheren Konzentration in der Lunge als im Plasma. Für die inhalativ als Dauertherapie verwendeten Substanzen Salmeterol (LABA) und Fluticason (ICS) ließen sich sogar noch größere Unterschiede zwischen Lungen- und Plasmakonzentration nachweisen (Tab. 1) [14].
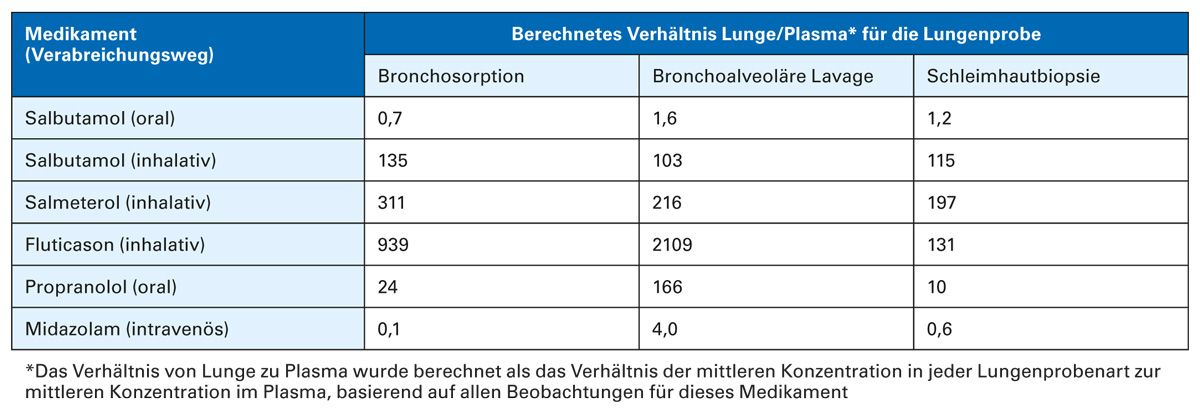
Tab. 1: Verhältnis der Lungen-/Plasma-Wirkstoffkonzentration nach inhalativer, oraler oder intravenöser Verabreichung (modifiziert nach [14])
Dies lässt sich durch die zahlreichen pharmakokinetischen Besonderheiten der Lunge erklären. Diese umfassen neben der pulmonalen Deposition der Wirkstoffpartikel auch deren Freisetzung in der Lunge, die mukoziliäre und phagozytotische Clearance, die Absorption in das Lungengewebe, die Retention im Lungengewebe und schließlich die Medikamenten-Clearance in die systemische Perfusion [15]. Diese Prozesse können durch unterschiedliche Faktoren beeinflusst werden. Neben der Substanz selbst spielen vor allem die Galenik, das Inhalations-Device und das Verhalten der Patient:innen eine wesentliche Rolle [15]. Der Erfolg der Inhalationstherapie hängt entscheidend von der korrekten Anwendung ab, so dass der Auswahl des geeigneten Devices eine wichtige Rolle zukommt. Wann immer möglich, sollte der inhalativen Applikationsform der Vorzug gegeben werden, selbst dann, wenn die orale Gabe der gleichen Substanz möglich ist.
Die korrekte Inhalationstechnik
Für die optimale Wirksamkeit, Verträglichkeit und Sicherheit der inhalativen Therapie ist eine korrekte Inhalationstechnik unabdingbar. Die Voraussetzung dafür ist ein individuell an den:die Patient:in angepasstes System. Die Auswahl des Inhalationssystems sollte sich daher neben dem inspiratorischen Fluss im Wesentlichen auch an den kognitiven, visuellen und motorischen Fähigkeiten sowie den Präferenzen der Patient:innen orientieren [7].
Die Inhalationssysteme im Überblick
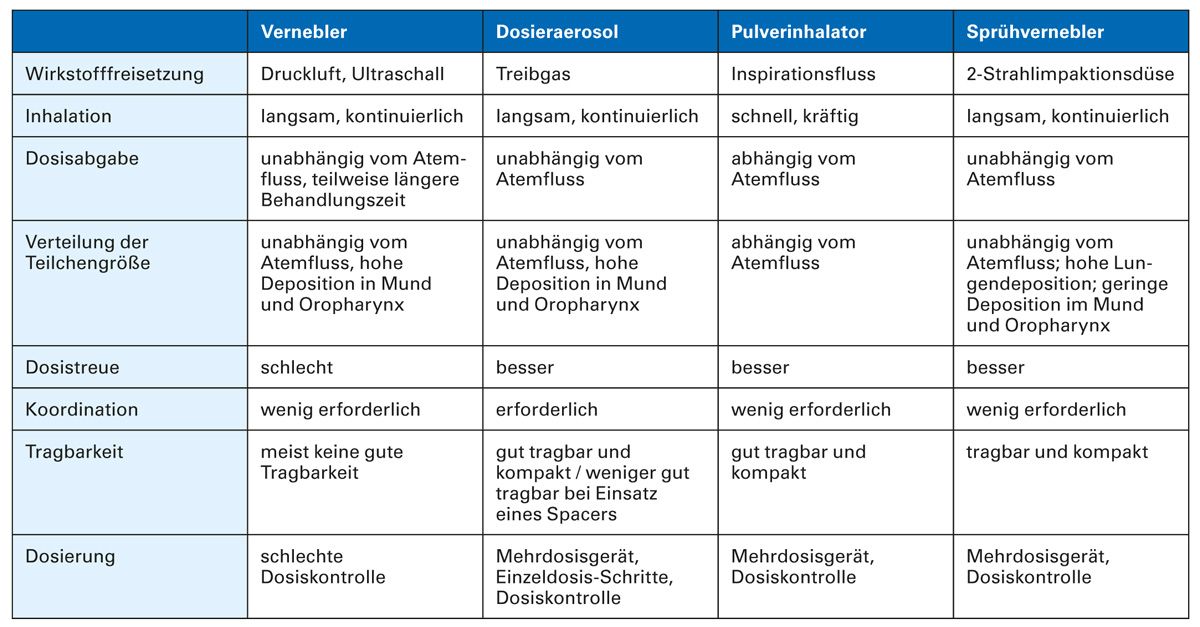
Die Feuchtinhalation durch Vernebler stellt die älteste Inhalationsform dar. Sie bietet den Vorteil der breiten Anwendbarkeit, auch im Notfallsetting und bei eingeschränkter Mitarbeitsfähigkeit (geriatrische Patient:innen, Kinder). Demgegenüber stehen jedoch eine schlechte Dosiskontrolle, häufige Anwendungen aufgrund der überwiegend kurzwirksamen Substanzen sowie eine eingeschränkte Portabilität der oftmals schweren Geräte. Dies hat zur Entwicklung der Dosieraerosole (pMDI), Pulverinhalatoren (DPI) und Sprühvernebler geführt. Heute sind vielfältige Kombinationen aus diesen Inhalations-Devices und Wirkstoffklassen kommerziell verfügbar, die sich sowohl in der Anwendung als auch den physikalischen Eigenschaften teils erheblich unterscheiden (Tab. 2) [7, 16].
Dosieraerosole (pressurized metered dose inhaler, pMDI)
Dosieraerosole ermöglichen eine gute Dosiskontrolle und definierte Partikelgrößen. Ebenso sind sie für die meisten inhalativen Substanzen verfügbar und weisen eine portable, kompakte Bauform auf. Die Anwendung stellt jedoch höhere Anforderungen an die koordinativen Fähigkeiten der Patient:innen. Diese Problematik lässt sich beispielsweise durch Verwendung eines Spacers oder atemzuggetriggerter Geräte adressieren. In jüngster Vergangenheit sind auch die bei Dosieraerosolen verwendeten Treibgase Gegenstand umweltpolitischer Diskussionen geworden. Dieses sensible Thema erfordert eine differenzierte Betrachtung und lässt sich zum gegenwärtigen Zeitpunkt nicht abschließend bewerten. Eine aktuelle Analyse von Daten zum Gebrauch von Inhaler-Devices bei Asthma und COPD in fünf europäischen Ländern weist jedoch darauf hin, dass die damit verbundene Umweltbelastung geringer ist, als gemeinhin angenommen wird: Demnach sind Dosieraerosole nur für <0,1 % der weltweiten Treibhaus-Emissionen verantwortlich [17]. Dem gegenüber steht ein Anteil von etwa 20 % durch das Transportwesen [18]. Zusätzlich sollte neben der reinen CO2-Bilanz der gesamte Lebenszyklus der Inhalatoren berücksichtigt werden, wie beispielsweise der Plastikanteil sowie der Anteil wiederverwertbarer Rohstoffe.
Pulverinhalatoren (dry-powder inhaler, DPI)
Pulverinhalatoren weisen ebenfalls eine portable, kompakte Bauform auf und erfordern weniger Koordination als Dosieraerosole. Entscheidend für die Anwendung ist das Zusammenspiel aus Gerätewiderstand und inspiratorischem Fluss. Für die aktive Aerosolerzeugung und die Dispergierung in lungengängige Aerosolpartikel ist ein hinreichender Druckabfall im Pulverinhalator erforderlich, der durch den internen Gerätewiderstand und/oder durch die Scherkräfte bei forcierter Einatmung erzeugt wird [7]. So erfordern Systeme mit geringem Gerätewiderstand und einem geringen Druckabfall hohe Flussraten, die gerade Patient:innen mit schlechter Lungenfunktion oft nicht erreichen. Werden sie erreicht, resultiert dies in einer hohen Partikelbeschleunigung in den oberen Atemwegen mit der Gefahr unerwünschter Prallverluste. Dem steht die subjektive Wahrnehmung entgegen: Patient:innen empfinden Systeme mit geringem Widerstand als angenehm leicht zu bedienen, auch wenn der Wirkungsgrad oft niedrig ist. Der Gebrauch von Systemen mit hohem Widerstand wird als anstrengend wahrgenommen, die Aerosolqualität ist aber trotz niedriger Flüsse gut [7]. Zusätzlich spielt die Galenik eine wichtige Rolle für die Wirkstoffdeposition in der Lunge. Das komplexe Zusammenspiel zwischen Flussrate, Gerätewiderstand und Wirkstofffreisetzung ist exemplarisch in Abbildung 2 dargestellt.
Sprühvernebler (soft mist inhaler, SMI)
Die Abhängigkeit vom Inspirationsfluss ist bei Sprühverneblern deutlich geringer als bei Pulverinhalatoren. Das derzeit kommerziell verfügbare Gerät weist einen hohen Anteil an lungengängigen Partikel auf, ist wiederverwertbar und kommt ohne Treibgas aus. Mitunter wird das Gerätehandling jedoch als komplexer empfunden.
Inhalationshilfen
Bei Dosieraerosolen und Sprühverneblern besteht die Möglichkeit der additiven Verwendung eines Spacers. Hierbei wird die Medikamentendosis zunächst in eine zwischen Device und Mund geschaltete Kammer abgegeben, aus der dann die Inhalation erfolgt.
Dies vereinfacht das Inhalationsmanöver und erfordert patient:innenseitig weniger Koordination. Zudem werden größere Partikel im Spacer gebunden, die nicht zur pulmonalen Arzneimittelwirkung beitragen und sonst überwiegend im Mund/Rachenbereich deponiert würden. Hierdurch lassen sich typische Nebenwirkungen wie beispielsweise Heiserkeit und Mundsoor bei ICS minimieren.
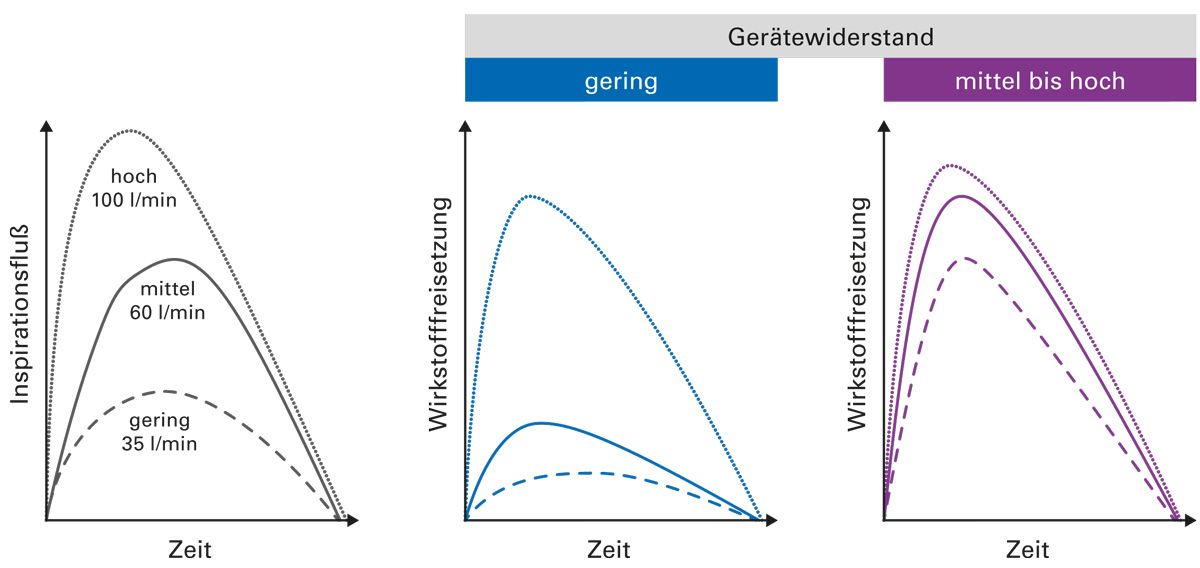
Abb. 2: Zusammenhang zwischen Flussrate, Gerätewiderstand und Wirkstofffreisetzung (modifiziert nach [19, 20])
Der entscheidende Faktor:
Periphere Lungendeposition des Wirkstoffs
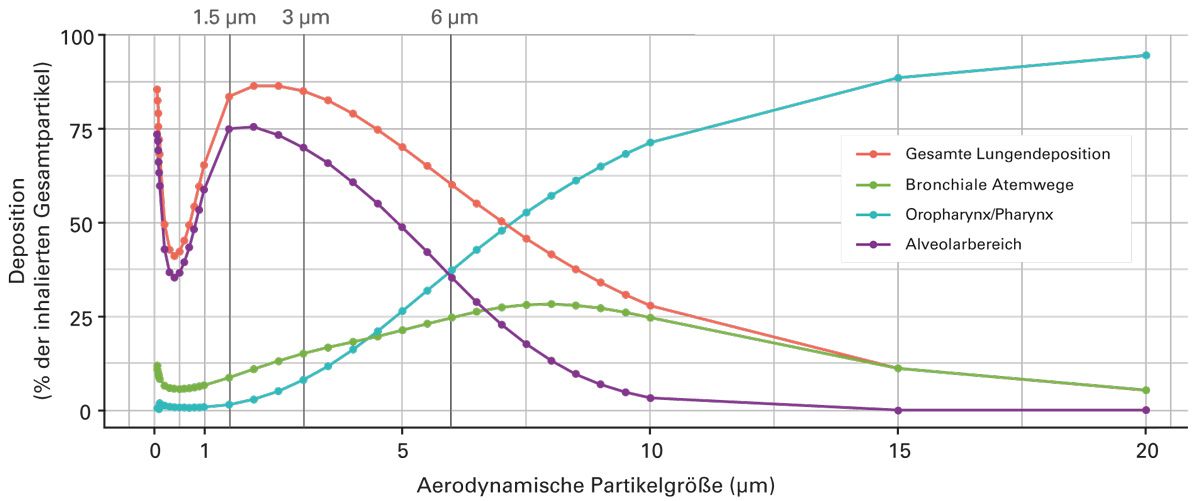
Entscheidend für die Wirkung eines inhalativen Arzneimittels ist der Anteil des Wirkstoffs, der die peripheren Lungenabschnitte erreicht. Bei obstruktiven Atemwegserkrankungen befinden sich hier die betroffenen Bereiche mit Inflammationsprozessen und verengten Atemwegen. Im Wesentlichen basiert die Abscheidung der inhalierten Partikel auf drei verschiedenen Mechanismen: der Impaktion, der Sedimentation und der Diffusion. Diese Mechanismen werden von verschiedenen Faktoren, wie der Inhalationstechnik der:des Patient:in, der Geometrie der Atemwege sowie den physikalischen Eigenschaften der Partikel beeinflusst. Wesentlicher physikalischer Faktor ist das Zusammenspiel aus Partikelgröße (aerodynamischer Durchmesser) und der Geschwindigkeit (Abb. 3) [15].
Zu den wesentlichen Depositionsmechanismen gehören die [15]:
- Impaktion: Partikel mit einer Größe > 5 µm und hoher Geschwindigkeit können aufgrund der Massenträgheit den anatomischen Biegungen im Atemtrakt schlechter folgen und prallen deshalb auf die Wände des Atemtrakts. Noch größere Partikel (> 10 µm) verbleiben in den oberen Atemwegen und werden oftmals geschluckt.
- Sedimentation: Kleinere und langsamere Partikel können den anatomischen Biegungen besser folgen und setzen sich aufgrund der Gravitation nach unten ab und erreichen so die Atemwegswand. Neben der Partikelgröße (> 0,5 µm) begünstigen auch die durch eine lange und tiefe Inhalation verursachte Verweildauer in den Atemwegen, der abnehmende Durchmesser der Atemwege sowie die Strömungsgeschwindigkeit die Sedimentation.
- Diffusion: Sehr kleine Teilchen unterliegen der Brown‘schen Molekularbewegung. Die Richtung dieser kleinen Teilchen wird stets durch Kollisionen mit den Gasmolekülen der Luft geändert. Sie werden entweder ins Blut aufgenommen und können so systemische Nebenwirkungen verursachen oder werden, ohne eine Arzneimittelwirkung zu entfalten, wieder ausgeatmet.
Etablierte Inhalationssysteme erzeugen in der Regel Aerosole mit einem ausreichend hohen Anteil an Feinpartikeln zwischen 1 und 5 μm.
Partikel mit einem Durchmesser < 5 µm werden als Feinpartikelfraktion (FPF) bezeichnet. Etablierte Inhalationssysteme erzeugen in der Regel Aerosole mit einem ausreichend hohen Anteil an Feinpartikeln zwischen 1 und 5 µm. Neben der Feinpartikelfraktion enthalten Aerosole auch große Teilchen, die extrathorakal abgeschieden werden. Da diese größeren Teilchen den Hauptanteil der Masse transportieren, gelangt nicht der gesamte Wirkstoff in die Lunge. Die optimale Partikelgröße für die periphere Deposition liegt im Bereich von etwa 1-3 µm.
Lungendeposition, Device und Galenik
Neben dem komplexen Zusammenspiel strömungsphysikalischer Aspekte trägt auch das Inhalationsgerät selbst erheblich zum Therapieerfolg bei. So variieren die Lungendepositionsraten zwischen den Gerätearten und auch innerhalb der gleichen Klassen sowie Inhalierhilfen zeigt sich eine mitunter große Spannbreite (Abb. 4) [21].
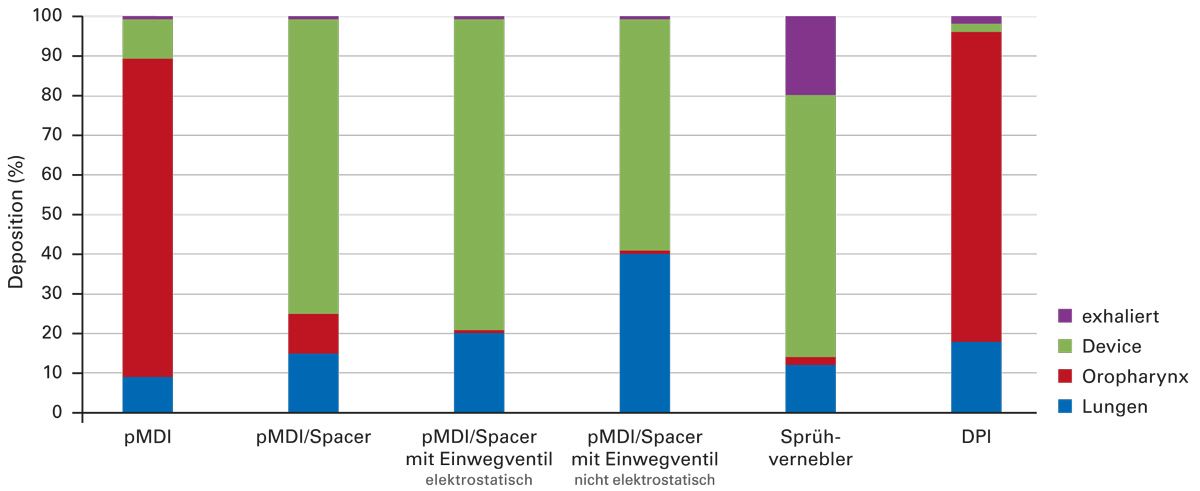
Abb. 4: Wirkstoffdeposition der verschiedenen Inhalationsgeräte: Farblich dargestellt sind die unterschiedlichen Prozentsätze der Lungendeposition und der Verluste im Oropharynx, im Device sowie beim Ausatmen (modifiziert nach [21])
Dies lässt sich unter anderem auf die unterschiedliche galenische Aufbereitung bei den Inhalationssystemen zurückführen, die umfassend untersucht wurden.
So wurden die Effekte von wirkstoffgleichen ICS bei Patient:innen mit Asthma bronchiale ausgewertet, die sich jedoch in der Partikelgröße unterscheiden. Anhand sensitiver Lungenfunktionsdiagnostik konnte in vivo gezeigt werden, dass die Galenik mit hoher peripherer Deposition den peripheren Atemwegswiderstand signifikant gesenkt hat [22].
Gleichsam konnte bei Patient:innen mit COPD nachgewiesen werden, dass sich der periphere Atemwegswiderstand um etwa 30 % durch einen alleinigen Wechsel der Galenik (Trockenpulver → Sprühvernebler) bei bioäquivalenter Wirkstoffdosis reduzieren lässt [23].
Eine Untersuchung zur Deposition von Beclometasondipropionat/Formoterol (FORM) – in Hydrofluoralkan (HFA) gelöst und mit einem pMDI verabreicht – zeigte bei gesunden Proband:innen (34,1 ± 9,3 %), Asthma-Patient:innen (30,9 ± 8,9 %) und COPD- Patient:innen (33,1 ± 8,9 %) keine signifikanten Unterschiede in der Lungendeposition [24].
Der Einfluss der Atemanhaltezeit auf die Lungendeposition
Im Allgemeinen wird empfohlen, dass die Patient:innen nach der Inhalation den Atem so lange wie möglich anhalten sollen – bis zu 10 Sekunden. Allerdings sind Patient:innen mit erheblich eingeschränkter Lungenfunktion möglicherweise nicht in der Lage, den Atem über eine solche Zeitspanne anzuhalten. Diese Patient:innen erreichen eher eine Atemanhaltezeit von 3 bis 5 Sekunden [25].
Die Atemanhaltezeit hat einen entscheidenden Einfluss auf die zentrale und periphere Lungendeposition. Untersuchungen mit einem Dosieraerosol-Inhalator (pressurised Metered Dose Inhaler; pMDI) zeigten, dass die Lungendeposition nach einer Atemanhaltezeit von 1, 3 bzw. 5 Sekunden bei 22,8 %, 36,1 % bzw. 41,6 % der verabreichten Dosis lag und die Ratio zentrale/periphere Deposition 1,81, 0,86 bzw. 0,61 betrug [26].
Innovative Entwicklungen
Die Lungendepositionsrate wurde ebenfalls beim Einsatz einer innovativen Technologie untersucht. Die innovative Galenik basierte hier auf aerodynamischen Partikeln aus Phospholipiden, die ein natürlicher Bestandteil des Lungensurfactants sind. Die Partikel zeichnen sich durch ihre geringe Dichte, eine poröse gewellte Oberfläche und eine schaumförmige Nanostruktur aus. Zudem haben sie einen MMAD (mass median aerodynamic diameter) von ca. 3 μm und damit eine optimale aerodynamische Größe. Die Phospholipidpartikel fungieren als Träger für Wirkstoffkristalle. Die inhalierten Partikel transportieren die Wirkstoffe über den gesamten Atemtrakt in die großen und kleinen Atemwege. Sie haften gut am Bronchialepithel, verschmelzen am Wirkort vollständig mit dem Lungensurfactant und setzen die gebundenen Wirkstoffe frei [27-29].
Unter dieser innovativen Galenik betrug die Lungendepositionsrate von Budesonid (BUD)/Glycopyrronium (GLY)/Formoterol-Fumarat (FORM) bei gesunden Proband:innen 37,7 % [25]. Auch bei Patient:innen mit mittelschwerer bis schwerer COPD ließ sich eine sehr gute mittlere Lungendeposition von 32,1 % erreichen. Die Subgruppenanalyse ergab eine Lungendeposition von 35,2 % bei Patient:innen mit mittelschwerer COPD und von 28,7 % bei Patient:innen mit schwerer bis sehr schwerer COPD [30]. Die Ergebnisse dieser Studie zeigten, dass die Lungendeposition von BUD/GLY/FORM unabhängig vom COPD-Schweregrad vergleichbar war und auch vergleichbar zu gesunden Proband:innen [30]. Dies deutet darauf hin, dass trotz signifikanter Atemwegserkrankung BUD/GLY/FORM unter Verwendung der innovativen Galenik in der gesamten Lunge zu einer hohen Deposition führt, einschließlich der peripheren Atemwege [25, 30].
Neben der hohen Lungendeposition zeigten sich bei Patient:innen mit mittelschwerer bis schwerer COPD statistisch signifikante und klinisch bedeutsame Vorteile bei der funktionellen Bildgebung der Atemwege (FRI, functional respiratory imaging), die sensitiver als herkömmliche spirometrische Untersuchungen auf Veränderungen reagiert [31].
Klinisch translatierte dies bei Patient:innen mit mittelschwerer bis schwerer COPD bei Verwendung der innovativen Galenik zu einem signifikanten Anstieg des Atemwegsvolumens um 72 % bei Verwendung von BUD/GLY/FORM und 53 % bei Verwendung von GLY/FORM MDI im Vergleich zu Baseline. Gleichzeitig sank der Atemwegswiderstand signifikant um 50 % (BUD/GLY/FORM) bzw. 48 % (GLY/FORM) [31].
In einer weiteren Studie wurden die abgegebene Dosis und die Aerosoleigenschaften von GLY/FORM-Dosieraerosolen (GLY/FORM MDI) unter Anwendung dieser innovativen aerodynamischen Trägerpartikel bestimmt [29]. Mit GLY/FORM MDI konnte eine reproduzierbare Dosisabgabe und eine Feinpartikelfraktion von mehr als 55 % erreicht werden – unabhängig davon, ob die Wirkstoffe als Monokomponenten oder als Fixkombination verabreicht wurden. Darüber hinaus war die Wirkstoffabgabe bei GLY/FORM MDI im Gegensatz zu einer reinen GLY/FORM-Wirkstoffkristallsuspension auch dann konsistent, wenn Fehler bei der Handhabung durch die Patient:innen simuliert wurden (z. B. vermindertes Schütteln vor der Verabreichung oder Verzögerungen zwischen Schütteln und Dosisabgabe). Diese Ergebnisse verdeutlichen, dass die Co- Suspensions-Technologie bekannte Ursachen für die Variabilität der Wirkstoffabgabe bei Dosieraerosolen überwinden kann [29].
Bei pMDI ist die Sprühgeschwindigkeit eine weitere entscheidende Eigenschaft, die die Wirkstoffdeposition in der Lunge beeinflusst. Durch niedrige Geschwindigkeiten lässt sich die oropharyngeale Deposition der inhalativen Medikamente reduzieren und die Koordination erleichtern. Idealerweise sind diese Geschwindigkeiten konstant und unabhängig vom Abstand zum Düsenende. Abbildung 5 zeigt die Sprühgeschwindigkeiten verschiedener pMDI. Die Anwendung der innovativen Galenik mit aerodynamischen Trägerpartikeln (GLY/FORM und BUD/GLY/FORM) zeigt eine konstante und niedrige Sprühgeschwindigkeit, die in Kombination mit der hohen Feinpartikelfraktion die Grundlage einer hohen Lungendeposition bei COPD-Patient:innen darstellt [32]. Auch der Sprühvernebler weist im Vergleich zu herkömmlichen pMDI eine sehr langsame Ausbreitung der Aerosolwolke im Bereich um 0,8 m/s sowie eine verlängerte Aerosolfreisetzung auf (< 0,3 s vs. 1,5 s bei herkömmlichen pMDI) [15].
Auch bezüglich der Atemanhaltezeiten zeigte die innovative Galenik vielversprechende Ergebnisse. In einer Studie wurde die pulmonale und extrathorakale Deposition untersucht [25]. Mittels Szintigraphie konnte kein wesentlicher Unterschied in der Lungendeposition bei einer Atemanhaltezeit von 3 bzw. 10 Sekunden nachgewiesen werden. Die mittlere pulmonale Deposition betrug 37,7 % bei der 10-Sekunden-Atemanhaltezeit und 34,5 % bei der 3-Sekunden-Atemanhaltezeit (Abb. 6) [25].
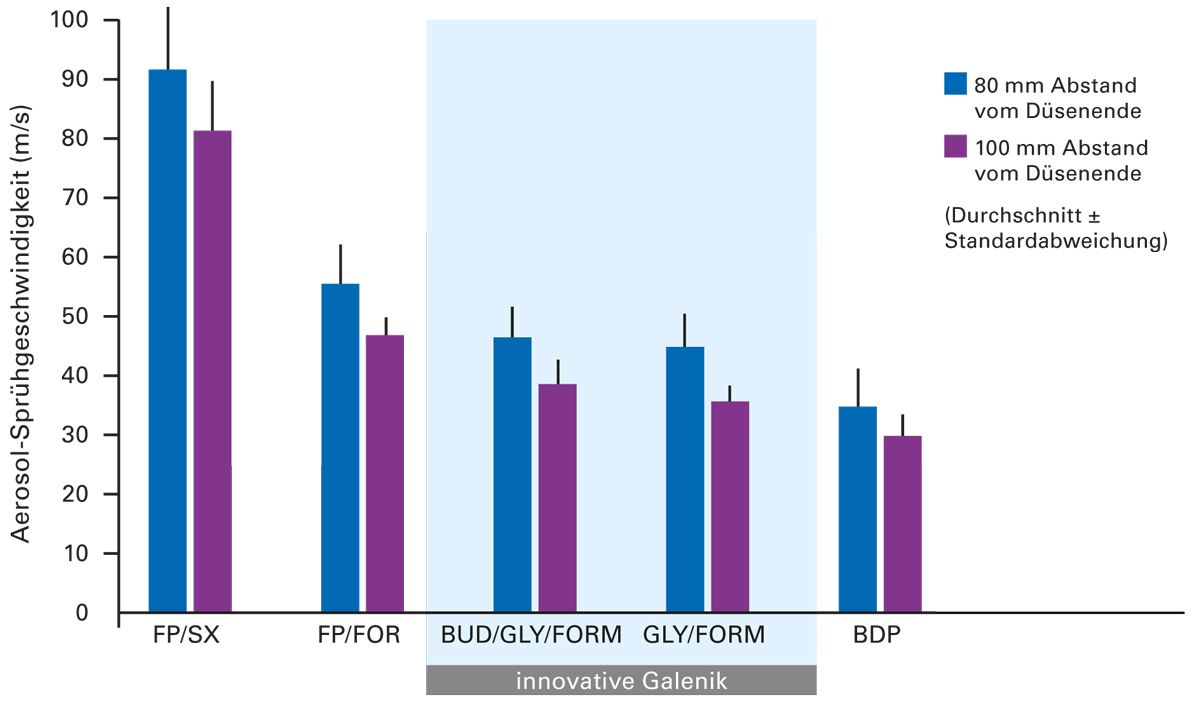
Abb. 5: Sprühgeschwindigkeiten (Mittelwert ± SD) von zwei pMDI (BUD/GLY/FORM und GLY/FORM) unter Verwendung der innovativen Galenik mit aerodynamischen Trägerpartikeln und von drei weiteren pMDI mit FP/SX, FP/ FOR und BDP (modifiziert nach [32]) BDP = Beclometasondipropionat; BUD = Budesonid; FORM = Formoterol; FP = Fluticasonpropionat; GLY = Glycopyrronium; SX = Salmeterolxinafoat
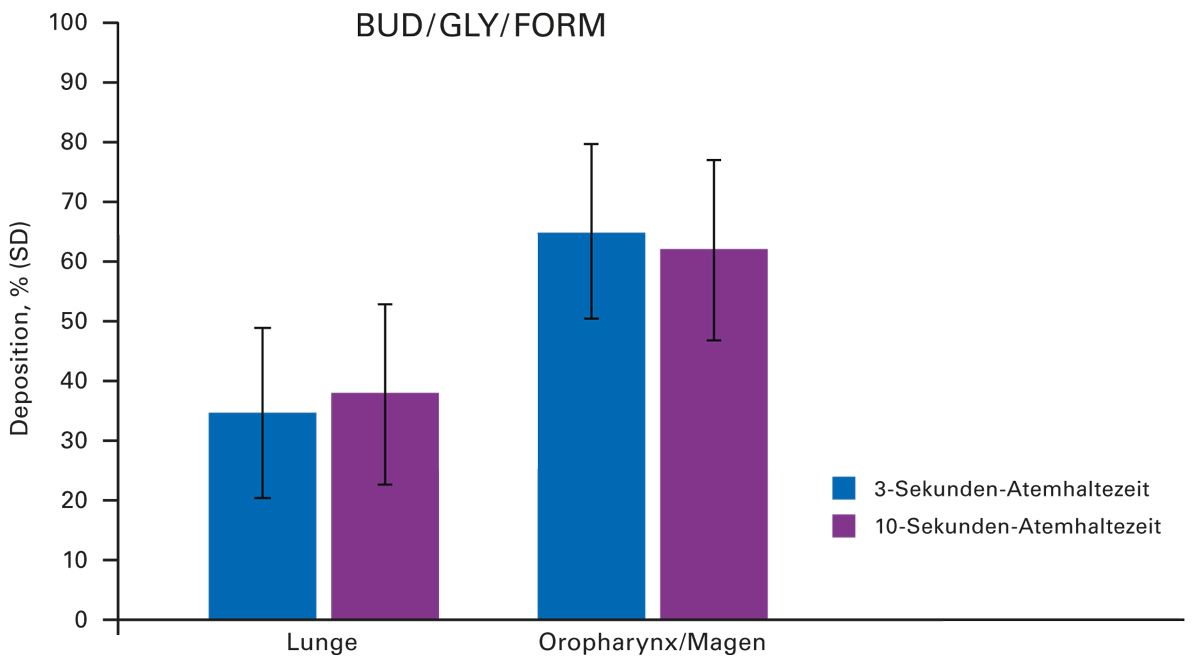
Abb. 6: Deposition in der Lunge und im Oropharynx-/Magenbereich nach einer Atemanhaltezeit von 3 bzw. 10 Sekunden (modifiziert nach [25]) BUD = Budesonid; FORM = Formoterol; GLY = Glycopyrronium
Weitere Einflussfaktoren
Der Fokus in diesem CME-Modul liegt auf der Inhalationstechnik und Lungendeposition. Darüber hinaus gibt es weitere relevante Einflussfaktoren auf die Wirkung inhalativer Arzneimittel, die hier nicht näher behandelt werden. Hierzu zählt unter anderem das Mischungsverhältnis der Wirkstoffe. Dieser Aspekt ist vor allem bei LAMA/LABA-Fix- kombinationen relevant [33]. Außerdem hängt der therapeutische Index vor allem bei ICS von deren Potenz und Selektivität bei der Rezeptorbindung ab [34].
Empfehlungen zur Patient:innenschulung in der täglichen Praxis
Die Patient:innenschulung ist eine wichtige Säule in der Behandlung aller Schweregrade der COPD-Erkrankung. Ein zentraler Bestandteil der Patient:innenschulung ist die Erläuterung der Anwendung des verordneten Inhalationssystems. Hierzu gibt die NVL COPD wichtige Empfehlungen [7]:
Die wichtigsten Schritte einer Erstunterweisung in ein Inhalationssystem (Instruktion) sind [7]:
- die Funktionsweise des Devices anhand eines Demogerätes oder des eigenen
Inhalationsgerätes erläutern und dabei Einzelschritte soweit möglich begründen; - den korrekten Gebrauch unter Zuhilfenahme eines Demogerätes oder des eigenen
Inhalationsgerätes demonstrieren; - die:den Patient:in bitten, das Gehörte/Gezeigte mit dem Demogerät oder dem
eigenen Inhalationsgerät zu reproduzieren.
Der Abstand der Intervalle zur Überprüfung der Inhalationstechnik hängt vom Umgang des:der Patient:in mit dem verordneten Inhalationssystem ab. Häufigere Kontrollen sind bei unzureichender Symptomkontrolle und bei offensichtlichen Handhabungsfehlern empfehlenswert. Im Gegensatz zur Erstinstruktion soll beim regelmäßigen und engmaschigen Monitoring der:die Patient:in die geübte Praxis zunächst demonstrieren, im Anschluss werden die Auffälligkeiten besprochen [7]. Den hohen Stellenwert und Einfluss der Patient:innenschulung auf die Lebensqualität bestätigte eine prospektive, randomisierte Studie, die den Effekt einer Schulungsmaßnahme auf die Lebensqualität untersuchte. Nach einem Jahr konnte in der Interventionsgruppe (Schulungsgruppe) eine relevante Besserung der Lebensqualität nachgewiesen werden [35]. Bei Patient:innen mit leichter bis schwerer COPD konnte gezeigt werden, dass mittels eines ambulanten, strukturierten Schulungsprogramms die Inhalationstechnik verbessert und damit die Selbstkontrolle der Erkrankung gesteigert sowie die Zahl akuter Exazerbationen reduziert werden konnte. Auch hier zeigte sich gleichzeitig eine Steigerung der Lebensqualität [1, 36, 37]. Diese positiven Effekte verdeutlichen, dass im Praxisalltag mögliche Fehlerquellen in der Anwendung frühzeitig identifiziert und gemeinsam mit den Patient:innen erörtert und zielführend behoben werden müssen.
Auch Nachschulungen werden im Bedarfsfall von der Leitlinien-Expertengruppe mit einem starken Empfehlungsgrad gefordert, beispielsweise wenn der klinische Verlauf darauf hinweist, dass Wissenslücken oder Selbstmanagementdefizite vorliegen [7]. Deshalb ist bei der Patient:innenedukation die Patient:innenschulung mit einem strukturierten Schulungsprogramm von der Einweisung in die Inhalationstechnik und in das verordnete Inhalationssystem abzugrenzen. Die Instruktion ersetzt nicht die Schulung und vice versa [1, 7]. Zudem sind Nachschulungen obligat [5] und mittlerweile stehen auch digitale Hilfsmittel zur Überwachung des Inhalationsmanövers zur Verfügung, wie beispielsweise die KATA-App [38].
Auch Zusammenfassungen in leicht verständlicher Sprache, wie beispielsweise die Patient:innenleitlinie zur NVL COPD, sind wichtige Informationsquellen [39]. Zusätzlich stellt die Atemwegsliga zur Unterstützung der Beratung und Einweisung in Inhalationssysteme verschiedene Videos über alle derzeit verfügbaren Devices kostenlos zur Verfügung (www.atemwegs-liga.de/richtig-inhalieren.html) [40].
Tabelle 3 fasst die wichtigsten Anwendungsfehler zusammen und definiert kritische, also therapierelevante Fehler, im Gegensatz zu akzeptablen Fehlern. Letztere können zwar den Therapieerfolg teilweise minimieren, verhindern ihn jedoch im Gegensatz zu den kritischen Fehlern nicht [20, 41-43].
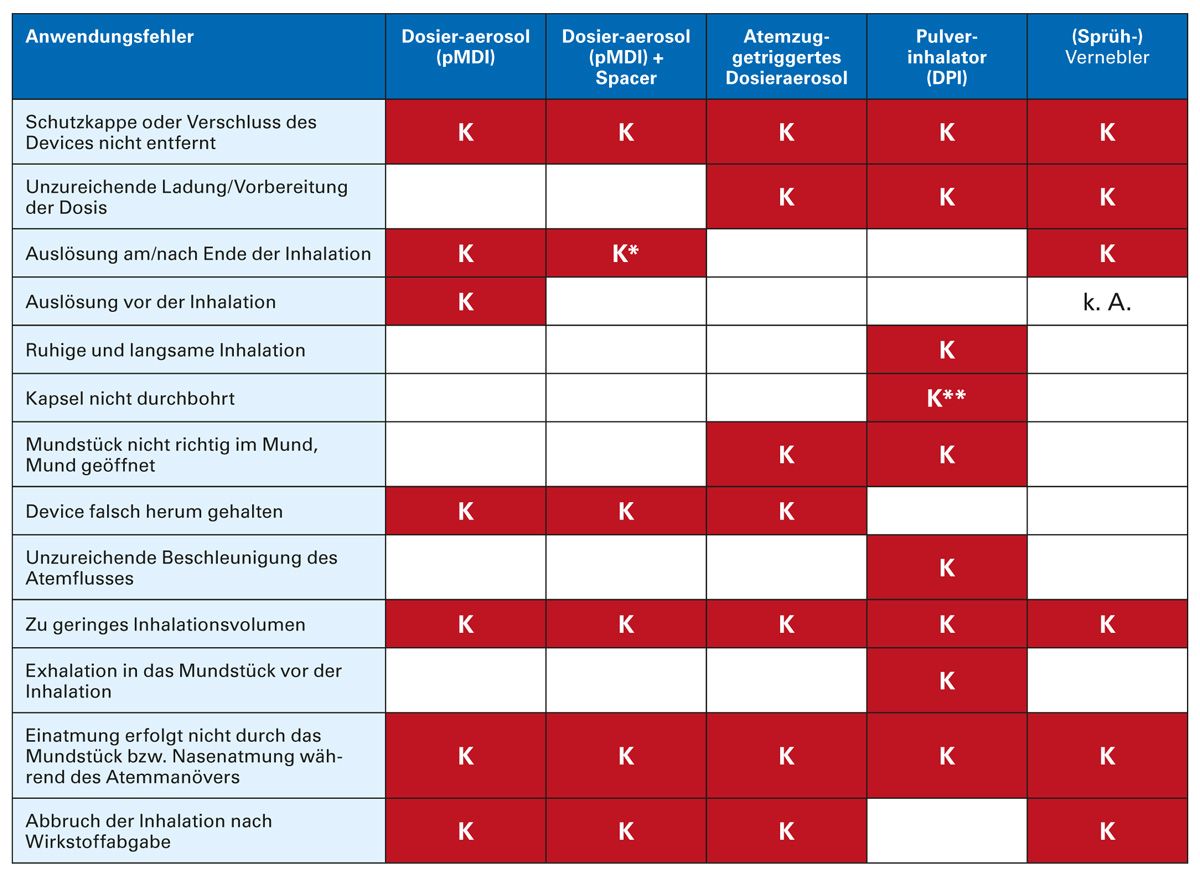
Tab. 3: Übersicht der Fehler bei der Anwendung von Inhalationssystemen (modifiziert nach [20, 41-43])
Der Anteil der Patient:innen, die mindestens einen kritischen Fehler bei der Anwendung von Inhalationssystemen machen, steigt mit der Anzahl der genutzten Gerätemodelle: Bei der Nutzung von 1, 2 bzw. ≥ 3 verschiedenen Modellen lag die Quote der kritischen Fehler bei 43 %, 70 % bzw. 86 % [44]. Zusätzlich berücksichtigen manche Patient:innen nicht die Häufigkeit der empfohlenen Anwendungen. Dies kann dazu führen, dass das Medikament unterdosiert, überdosiert oder nicht regelmäßig angewendet wird [45]. Hieraus kann abgeleitet werden, dass eine Vereinfachung der Therapie, beispielsweise durch die Kombination aller Wirkstoffe in einem einzelnen Gerät, eine der wesentlichen Stellschrauben zur Reduktion von Anwendungsfehlern darstellt.
Bedeutung nicht-ärztlicher Berufsgruppen in der langfristigen Betreuung
Mögliche Bedenken der Patient:innen können sich negativ auf die Therapieadhärenz auswirken, was zu einer verminderten Krankheitskontrolle und zu Exazerbationen führen kann [46]. Hier ist vor allem die Rolle der medizinischen Fachangestellten (MFA) gefragt, die häufig für die langfristige Betreuung und Begleitung der Patient:innen verantwortlich sind: Sie sind in der Regel die Hauptansprechpartner:innen und erfahren meist direkt von den Herausforderungen, mit denen die Patient:innen konfrontiert sind. Die regelmäßige Interaktion zwischen MFA und Patient:in in verschiedenen Phasen der Krankheitsbewältigung versetzt MFA in eine wichtige Schlüsselposition, vor allem wenn es darum geht die Inhalationstechnik zu überwachen, um so die Adhärenz zu steigern [46].
In einer Studie mit COPD-Patient:innen zeigte sich, dass eine vom medizinischen Fachpersonal geleitete Patient:innenschulung zu einer signifikanten Verbesserung der Inhalationskompetenz und zu einer Verringerung der Fehlerrate führte [47]. Solche Verbesserungen können sich folgend auch positiv auf die Adhärenz und letztlich die klinischen Ergebnisse auswirken [46].
Patient:innenseitige Kriterien für die Auswahl des Inhalationssystems
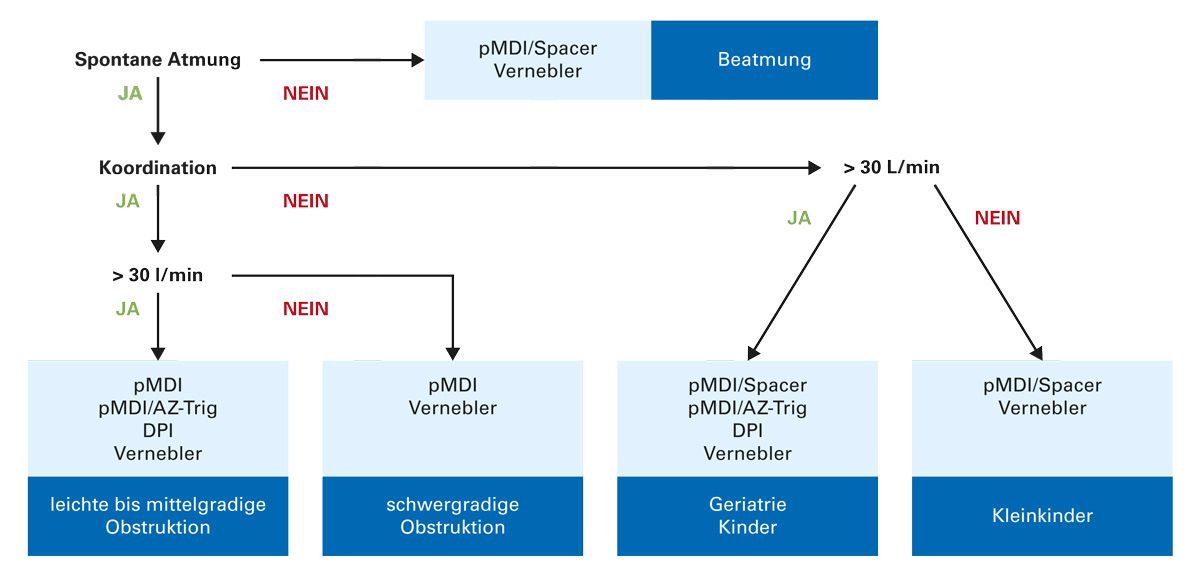
Die Auswahl des Inhalationssystems hängt von zahlreichen patient:innenseitigen Faktoren ab (Abb. 7):
- Bei guter Koordination und gutem inspiratorischem Fluss stehen prinzipiell pMDI und alle anderen Devices zur Auswahl.
- Ist eine gute Koordination gegeben, aber der Inspirationsfluss niedrig (< 30 l/ min), dann können pMDI und Vernebler zum Einsatz kommen (z. B. bei schwerer Atemwegsobstruktion).
- Bei eingeschränkter Koordination (z. B. bei geriatrischen Patient:innen oder Kindern), aber bei ausreichendem inspiratorischen Fluss von mehr als 30 l/min, sind neben Verneblern, pMDI mit Spacer und atemzuggetriggerten Dosieraerosolen auch DPI anwendbar.
- Bei eingeschränkter Koordination und einem inspiratorischen Fluss unter 30 l/min (v. a. bei Kleinkindern) sind pMDI mit Spacer und Vernebler ratsam.
Neben persönlichen Präferenzen muss bei der Geräteauswahl ein grundlegender Unterschied zwischen pMDI und DPI berücksichtigt werden. Im Allgemeinen ist bei der Anwendung von pMDI ein ruhiger und tiefer Atemzug erforderlich, während DPI einen von Anfang an kräftigen Atemzug mit ausreichendem Inspirationsfluss erfordern. Im Einzelnen hängt dieses komplexe Zusammenspiel wesentlich vom verwendeten Inhalationssystem ab.
Fazit
Ziele der COPD-Behandlung umfassen die Linderung der Symptome, die Reduktion von Frequenz und Schweregrad der Exazerbationen sowie die Verbesserung der gesundheitsbezogenen Lebensqualität [1, 7]. Außerdem gilt bei stabiler COPD, das Risiko für das Auftreten zukünftiger Exazerbationen und damit Hospitalisierungen sowie das Mortalitätsrisiko zu minimieren [48]. Dabei ist die inhalative Therapie Basis der medikamentösen COPD-Therapie. Die Wirkstoffdeposition in der Lunge ist von der Interaktion zahlreicher pharmakologischer und patient:innenseitiger Einflussfaktoren abhängig. Hierzu zählen unter anderem die Art des Inhalationsgerätes, koordinative Fähigkeiten der Patient:innen, Inspirationsfluss- und Zeit sowie die Partikelgröße. In den vergangenen Jahren konnten insbesondere auf Seite der pharmakologischen Faktoren zahlreiche Verbesserungen erreicht werden. Im Fokus der inhalativen Therapie stehen die peripheren Lungenabschnitte. Bei obstruktiven Atemwegserkrankungen befinden sich hier die betroffenen Bereiche mit Inflammationsprozessen und verengten Atemwegen. Durch Innovationen mit Verbesserungen der Galenik und der Inhalationsgeräte lässt sich die periphere Wirkstoffdeposition beträchtlich erhöhen.
Schulungsmaßnahmen sowie eine Vereinfachung der Therapieschemata stellen wesentliche patient:innenseitige Einflussfaktoren dar. Bei richtiger Anwendung bieten moderne Inhalationstherapien die Möglichkeit, hohe Wirkstoffkonzentrationen unmittelbar in den betroffenen Regionen der Lunge zu erreichen und gleichzeitig das Nebenwirkungsspektrum erheblich zu reduzieren.
Literatur
1. Vogelmeier C et al. S2k-Leitlinie zur Diagnostik und Therapie von Patienten mit chronisch obstruktiver Bronchitis und Lungenemphysem (COPD). AWMF-Register-Nr. 020/006. Stand: Januer 2018. Online veröffentlicht unter: https:// www.awmf.org/leitlinien/detail/ll/020-006.html (Letzter Zugriff: 18.11.2022).
2. Wedzicha JA, Seemungal TA. COPD exacerbations: defining their cause and prevention. Lancet 2007; 370:786-796. doi: 10.1016/S0140-6736(07)61382-8.
3. Lindberg A et al. Subjects with COPD and productive cough have an increased risk for exacerbations and death. Respir Med. 2015;109:88–95.
4. Kunisaki KM et al. Exacerbations of Chronic Obstructive Pulmonary Disease and Cardiac Events. A Post Hoc Cohort Analysis from the SUMMIT Randomized Clinical Trial. Am J Respir Crit Care Med. 2018;198:51–57.
5. Rothnie KJ et al. Natural History of Chronic Obstructive Pulmonary Disease Exacerbations in a General Practice-based Population with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med. 2018;198:464–471.
6. Roche N et al. COPD exacerbations significantly impact quality of life as measured by SGRQ-C total score: results from the FLAME study. Eur Respir J 2017;50:Suppl.61:OA1487.
7. Nationale VersorgungsLeitlinie COPD. Teilpublikation der Langfassung. 2. Auflage Version 1; AWMF-Register-Nr. nvl- 003; Stand: 2021. Online veröffentlicht unter: https://www.awmf.org/leitlinien/detail/ll/nvl-003.html (Letzter Zugriff: 18.11.2022).
8. Stefan MS et al. Association between Initiation of Pulmonary Rehabilitation and Rehospitalizations in Patients Hospitalized with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2021;204(9):1015-1023.
9. Lindenauer PK et al. Association Between Initiation of Pulmonary Rehabilitation After Hospitalization for COPD and 1-Year Survival Among Medicare Beneficiaries- JAMA 2020;323(18):1813-1823.
10. https://diga.bfarm.de/de/verzeichnis/01329/fachkreise (Letzter Zugriff: 21.01.2023)
11. https://apps.apple.com/de/app/aktiv-mit-copd/id1631954303 (Letzter Zugriff: 18.11.2022).
12. Gesierich W. Interventionelle Pneumologie – Guter Start für bronchiale Rheoplastie als neue Option bei chronischer Bronchitis. Pneumo News 2020;12:17-19.
13. Pison C et al. Safety of denervation following targeted lung denervation therapy for COPD: AIRFLOW-1 3-year outcomes. Respir Res 2021;22(1):62.
14. Sadiq M et al. Lung pharmacokinetics of inhaled and systemic drugs: A clinical evaluation. Br J Pharmacol 2021;178(22):4440-4451.
15. Borghardt JM et al. Inhaled Therapy in Respiratory Disease: The Complex Interplay of Pulmonary Kinetic Processes. Can Respir J. 2018; 2018:2732017. doi: 10.1155/2018/2732017.
16. Kaplan A und Price D. Matching Inhaler Devices with Patients: The Role of the Primary Care Physician. Can Respir J 2018;2018:9473051.
17. Pernigotti D et al. Reducing carbon footprint of inhalers: analysis of climate and clinical implications of different scenarios in five European countries. BMJ Open Respir Res. 2021;8(1):e001071. doi: 10.1136/bmjresp-2021-001071.
18. https://de.statista.com/statistik/daten/studie/167957/umfrage/verteilung-der-co-emissionen-weltweit-nach-bereich/
(Letzter Zugriff: 18.11.2022).
19. Laube BL et al. What the pulmonary specialist should know about the new inhalation therapies. Eur Respir J 2011;37:1308-1331.
20. Haidl P et al. Inhalation device requirements for patients‘ inhalation maneuvers. Respir Med 2016;118:65-75.
21. Gardenhire DS et al. Guide to Aerosol Delivery Devices for Respiratory Therapists. American Association for Respira- tory Care; 4th Edition; 2017.
22. Yamaguchi M et al. Effect of inhaled corticosteroids on small airways in asthma: investigation using impulse oscillometry. Pulm Pharmacol Ther 2009;22:326-332.
23. Biddiscombe M et al. Efficacy of the device in targeting tiotropium to the small airways in COPD. Eur Respir J 2018;52(Suppl. 62):PA1017.
24. De Backer W et al. Lung Deposition of BDP=Formoterol HFA pMDI in Healthy Volunteers, Asthmatic, and COPD Patients. J Aerosol Med Pulm Drug Deliv 2010;23:137-148.
25. Israel S et al. Pulmonary deposition of budesonide/glycopyrronium/formoterol fumarate dihydrate metered dose inha- ler formulated using co-suspension delivery technology in healthy male subjects. Eur J Pharm Sci 2020;153:105472.
26. Van Holsbeke C et al. Use of functional respiratory imaging to characterize the effect of inhalation profile and particle size on lung deposition of inhaled corticosteroid/long-acting β2-agonists delivered via a pressurized metered-dose
inhaler. Ther Adv Respir Dis 2018:1753466618760948.
27. Lechuga-Ballesteros D et al. Novel cosuspension metered-dose inhalers for the combination therapy of chronic obstructive pulmonary disease and asthma. Future Med Chem 2011;3:1703-1718.
28. Wauthoz N et al. Phospholipids in pulmonary drug delivery. Eur J Lipid Sci Technol 2014;116:1114-1128.
29. Doty A et al. Drug Delivery from an Innovative LAMA/LABA Co-suspension Delivery Technology Fixed-Dose Combina- tion MDI: Evidence of Consistency, Robustness, and Reliability. AAPS PharmSciTech 2018;19:837-844.
30. Usmani O et al. A scintigraphy study of budesonide/glycopyrrolate/formoterol fumarate metered dose inhaler in patients with moderate-to-very severe chronic obstructive pulmonary disease. Respir Res 2021;22:261.
31. Van den Berge M et al. Functional respiratory imaging assessment of budesonide/glycopyrrolate/formoterol fumarate and glycopyrrolate/formoterol fumarate metered dose inhalers in patients with COPD: the value of inhaled corticoste- roids. Respir Res 2021;22:191.
32. Tamura G et al. Aerosol velocity of two pressurized metered-dose inhalers using Aerosphere Delivery Technology. Respir Investig 2021;59:153-154.
33. Calzetta L et al. Pharmacological mechanisms leading to synergy in fixed-dose dual bronchodilator therapy. Curr Opin Pharmacol 2018;40:95-103.
34. Fath R. Asthmatherapie mit inhalativen Kortikosteroiden Fluticasonfuroat: geringere systemische Nebenwirkungen. MMW – Fortschritte der Medizin 2021;163:73.
35. Wittmann M et al. Patient education in COPD during inpatient rehabilitation improves quality of life and morbidity. Pneumologie 2007; 61(10):636642. doi: 10.1055/s-2007-980106
36. Dhein Y, Münks-Lederer C, Worth H. Evaluation of a structured education programme for patients with COPD under outpatient conditions– a pilot study. Pneumologie 2003;57(10):591-597. doi: 10.1055/s-2003-43019.
37. Worth H, Dhein Y. Does patient education modify behaviour in the management of COPD? Patient Educ Couns 2004;52:267-270.
38. https://kata-inhalation.com/de/ (Letzter Zugriff: 22.09.2022).
39. Patientenleitlinie zur Nationalen VersorgungsLeitlinie COPD; 2. Auflage, Version 1, 2022. Online veröffentlicht unter: https://www.patienten-information.de/patientenleitlinien/copd (Letzter Zugriff: 30.09.2022).
40. Deutsche Atemwegsliga e.V.; Richtig inhalieren. Online veröffentlicht unter: https://www.atemwegsliga.de/richtig- inhalieren.html (Letzter Zugriff: 22.09.2022).
41. Newman SP. Inhaler treatment options in COPD. Eur Respir Rev 2005;14(96):102–108.
42. Voshaar T et al. Spacer, Aerosol Therapy through Space and Time. Pneumologie 2017;71:437-453.
43. Price DB et al. Inhaler Errors in the CRITIKAL Study: Type, Frequency, and Association with Asthma Outcomes. J Allergy Clin Immunol Pract 2017;5:1071-1081.e9.
44. Sulku J et al. Critical inhaler technique errors in Swedish patients with COPD: a cross-sectional study analysing video- recorded demonstrations. NPJ Prim Care Respir Med 2021;31:5.
45. Inhalation von Medikamenten bei Asthma und COPD. Deutsche Atemwegsliga e.V. Online veröffentlicht unter: https:// www.atemwegsliga.de/tl_files/eigene-dateien/Apotheken/00-2018-Deviceschulung_Stand%20_2018-08-16.pdf (Letzter Zugriff: 22.09.2022).
46. Scullion J. The Nurse Practitioners‘ Perspective on Inhaler Education in Asthma and Chronic Obstructive Pulmonary Disease. Can Respir J 2018:2525319.
47. Al-Kalaldeh M et al. Effectiveness of Nurse-Driven Inhaler Education on Inhaler Proficiency and Compliance Among Obstructive Lung Disease Patients: A Quasi-Experimental Study. Can J Nurs Res 2016;48:48-55.
48. Global Initiative for Chronic Obstructive Lung Disease. GOLD Report 2023. Online verfügbar unter: https://goldcopd. org/2023-gold-report-2/ (letzter Zugriff: 08.12.2022).
Bildquellen
Titel: © Prostock-studio – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.