Bluthochdruck und Dyslipidämie bei kardiometabolischen Patienten aus kardiologischer und diabetologischer Sicht
Interessengebiete: Allgemeinmedizin und Innere Medizin, Diabetologie, Kardiologie
Bluthochdruck und Fettstoffwechselstörung sind die häufigsten kardiovaskulären Risikofaktoren, insbesondere bei Patienten mit Übergewicht, Prädiabetes und Diabetes mellitus. Die besondere Herausforderung bei dieser Patientengruppe besteht darin, dass eine spezielle Therapieauswahl getroffen werden muss, um kardiovaskuläre Folgeerkrankungen wie Herzinfarkt, Schlaganfall, Vorhofflimmern oder Herzinsuffizienz zu verhindern.
Diese Fortbildung beleuchtet die Therapie des Bluthochdrucks und der Dyslipidämie bei kardiometabolischen Risikopatienten sowohl aus kardiologischer als auch aus diabetologischer Sicht. Die Ausführungen basieren auf den Leitlinien der ESC zur Therapie des Bluthochdrucks sowie zum Diabetes, Prädiabetes und kardiovaskulären Erkrankungen.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Bluthochdruck und Fettstoffwechselstörung sind die häufigsten kardiovaskulären Risikofaktoren, insbesondere bei Patienten mit Übergewicht, Prädiabetes und Diabetes mellitus. Die besondere Herausforderung bei dieser Patientengruppe besteht darin, dass eine spezielle Therapieauswahl getroffen werden muss, um kardiovaskuläre Folgeerkrankungen wie Herzinfarkt, Schlaganfall, Vorhofflimmern oder Herzinsuffizienz zu verhindern.
Dieser Beitrag beleuchtet die Therapie des Bluthochdrucks und der Dyslipidämie bei kardiometabolischen Risikopatienten sowohl aus kardiologischer als auch aus diabetologischer Sicht. Die Ausführungen basieren auf den Leitlinien der ESC zur Therapie des Bluthochdrucks [1] sowie zum Diabetes und Prädiabetes und kardiovaskulären Erkrankungen [2].
Die Definition der arteriellen Hypertonie empfiehlt für die meisten Patienten ein Blutdruckziel von < 140 / 90 mmHg. Bei den Hochrisikopatienten sollte man jedoch < 120 / 80 mmHg für alle < 65-Jährigen anstreben, wenn dieses Blutdruckziel subjektiv tolerierbar ist und es dem Patienten darunter gut geht.
Ebenso ist es mit den Lipidzielen [2], deren Erreichen auch bei der Behandlung von KHK-Patienten eine Herausforderung ist. Patienten mit Diabetes mellitus gehören in die Hochrisikogruppe, deshalb sollte bei ihnen ein LDL-Wert von 55 mg/dl (1,4 mmol/l) oder weniger als Zielwert angestrebt werden.
Bei Patienten mit sehr hohem kardiovaskulären Risiko steht die Gabe von Statinen in maximal tolerierter Dosierung an erster Stelle (IA-Empfehlung). Wenn damit der Ziel- wert nicht erreicht wird, ist die Kombination mit Ezetimib die Empfehlung (IB). Bei Statinintoleranz, die gerade in der Hochdosierung nicht selten auftritt, wird alternativ die Gabe eines PCSK9-Hemmers empfohlen. Bempedoinsäure ist in der Leitlinie von 2019 [2] noch nicht erwähnt, da sie erst 2020 durch die EMA zur Behandlung der Dyslipidämie zugelassen wurde. Ihr Einsatz ist jetzt vor den PCSK9-Hemmern empfohlen.
Medikamentöse Therapie bei arterieller Hypertonie mit Begleit- und Folgeerkrankungen
Bei der Therapie der arteriellen Hypertonie stellt die Leitlinie [1] eine Lebensstiländerung mit dem Ziel voran, die Hypertonie zu verhindern oder ihren Beginn zu verzögern, um somit kardiovaskuläre Ereignisse zu reduzieren. Eine Lebensstiländerung zur Verhinderung der diabetischen Stoffwechsellage als auch zur Prävention einer Entwicklung von Prädiabetes zu Diabetes findet sich ebenfalls in der Diabetes-Leitlinie [2] wieder. In der medikamentösen Therapie werden RAAS-Blocker bevorzugt, da sie im Gegensatz zu Betablockern und den meisten Diuretika keine negativen Auswirkungen auf den Glukosestoffwechsel haben. Ist die Monotherapie mit dem RAAS-Blocker unzureichend, wird die Kombination mit einem Kalziumantagonisten oder einem Thiazid bzw. einem Thiazid-Analogon empfohlen.
Die Therapietreue der Patienten ist kritisch bei der Therapie der Hypertonie. Sie sinkt mit der Zahl der verordneten Tabletten. Die Therapieadhärenz liegt bei 3 Tabletten bei 60 %, bei 6 Tabletten sinkt sie auf 20 % [1]. Zur Verbesserung der Therapieeffektivität wird deshalb in der Leitlinie zunächst eine Zweier-Fixkombination in niedriger Dosierung empfohlen, z. B. einen RAAS-Blocker mit einem Kalziumantagonisten oder Diuretikum. Ist das Blutdruckziel noch nicht erreicht, wird der Einsatz einer Dreier-Fixkombination aus RAAS-Blocker, Kalziumantagonist plus Diuretikum empfohlen.
Ist auch unter der Dreier-Fixkombination die Einstellung des Blutdruckes noch ungenügend, kann es sich um eine resistente Hypertonie handeln. Bevor man von einer resistenten Hypertonie ausgeht, sollte man den Patienten aber nach möglichen Ursachen für den mangelnden Behandlungserfolg befragen: Nimmt er die Tabletten wie verordnet ein? Ist der abendliche Alkoholkonsum deutlich gestiegen? Liegt eine Schlafapnoe vor? Hat sich sein Kaliumspiegel reduziert und bemerkt er Herzrhythmusstörungen? Leidet er unter vermehrten Muskelkrämpfen durch Magnesiummangel? Können diese Ursachen ausgeschlossen werden, erfolgt die Eskalation mit Spironolacton oder einem anderen Diuretikum, einem Alpha- oder Betablocker.
Ein weiteres Problem der Therapie besteht in der Dauer der Medikation: Sobald der Blutdruck im Zielbereich ist, möchten viele Patienten die Einnahme beenden. Allerdings handelt es sich um eine Regulationsstörung, die eine Dauertherapie notwendig macht, bis durch Lebensstiländerungen die Risikofaktoren (Gewicht, Alkoholkonsum, Rauchen oder Bewegungsmangel) reduziert werden. Bis zur Lebensstiländerung bleibt die Therapie-Adhärenz daher ein wichtiger Aspekt. Auch Nebenwirkungen der Therapie wie Sturzdiurese, Muskelkrämpfe, Schwindelgefühl oder verstärkte Herzrhythmusstörungen können Patienten dazu bringen, die Therapie unregelmäßig fortzusetzen oder abzubrechen.
Diuretika in Mono- und Kombinationstherapie
Trotz der bekannten Nebenwirkungen sind Diuretika die häufigsten Antihypertensiva, die in Kombinations- oder Monotherapien verwendet werden. Von den Thiaziden ist vor allem Hydrochlorothiazid (HCT) zu nennen. Bendroflumethiazid, das auch zu dieser Gruppe gehört, ist in Deutschland noch wenig verbreitet – im Gegensatz zu den skandinavischen Ländern und Großbritannien, wo der Wirkstoff einen deutlich höheren Stellenwert hat.
Dazu kommen Thiazid-Analoga wie Xipamid, Indapamid und Chlortalidon.
HCT ist der fast ausschließliche Kombinationspartner der RAAS-Blocker. Indapamid und Piretanid sind nur in Kombination mit einem ACE-Hemmer auf dem Markt. Eine weitere Gruppe sind die kaliumsparenden Diuretika. Man unterscheidet die aldosteron- abhängigen (Spironolacton, Eplerenon) und aldosteronunabhängigen (Amilorid und Triamteren) Vertreter. Des Weiteren sind die kaliumneutralen Diuretika-Kombinationen zu nennen.
Mit dem Einsatz von Diuretika wird eine erhöhte Natriumchlorid-Ausscheidung angestrebt. Ziel sollte aber gleichzeitig auch eine neutrale Kalium- und Magnesiumbilanz sein. Das lässt sich nur durch den Einsatz einer kaliumneutralen Fixkombination erreichen.
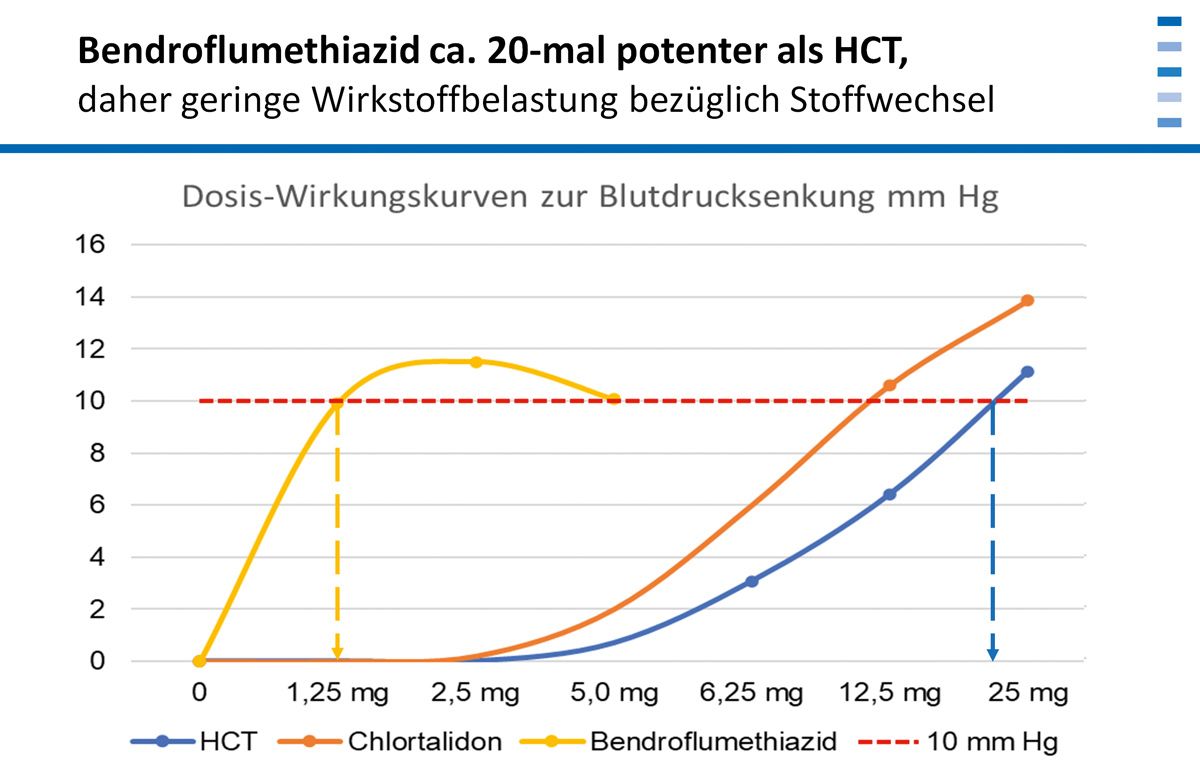
Wegen seines sehr gutes Wirkungsprofils ist hierbei die Fixkombination aus Bendroflumethiazid und Amilorid hervorzuheben, die schon lange am Markt ist. In einer vergleichenden Metaanalyse überschreitet Bendroflumethiazid die Messlatte einer Blutdrucksenkung um 10 mmHg bereits bei einer Dosierung von 1,25 Milligramm während man bei HCT dafür 25 Milligramm braucht. Bendroflumethiazid hat also eine etwa 20-fach stärkere Dosis-Wirkungsbeziehung, d.h. es ist circa 20-mal potenter als HCT und verursacht bei gleichem blutdrucksenkendem Effekt eine wesentlich geringere Wirkstoffbelastung in Bezug auf die Stoffwechselparameter [3].
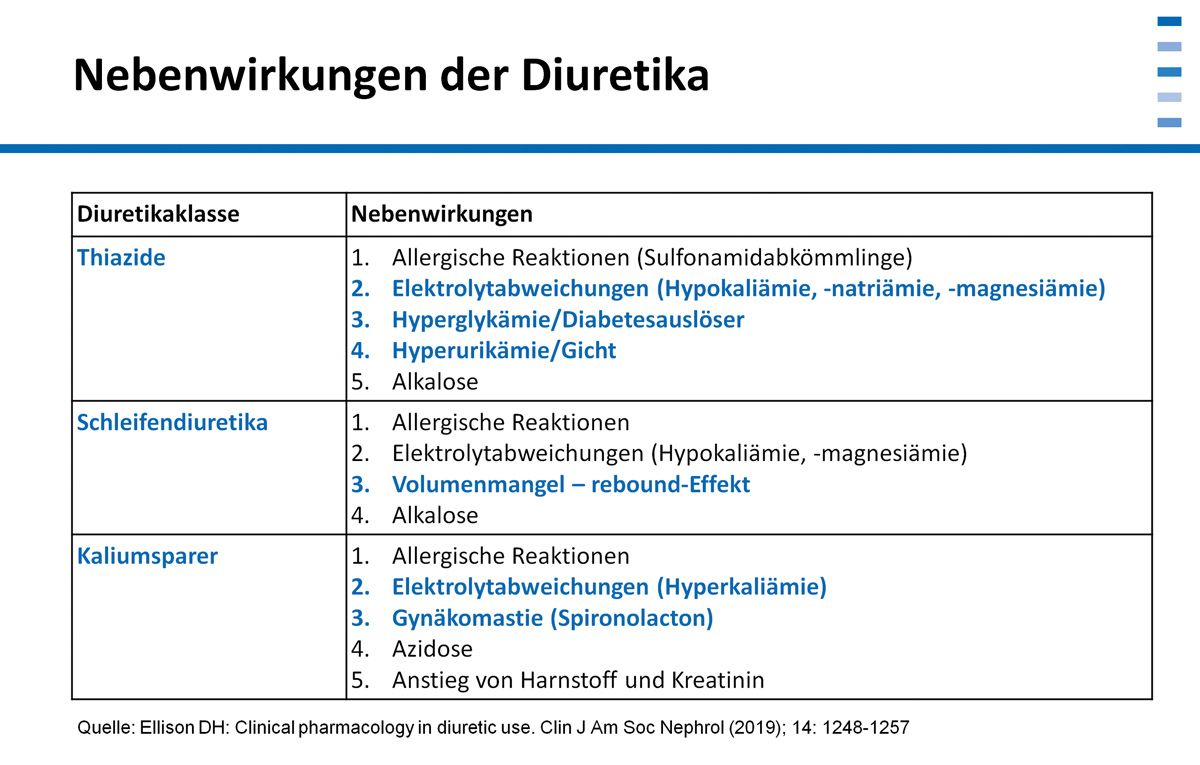
Beim Einsatz von Diuretika sehen wir klinische und metabolische Folgen, welche die Adhärenz der Patienten beeinflussen können. Bei den Nebenwirkungen zu nennen sind vor allem die Elektrolytabweichungen: Hypokaliämie, Hyponatriämie, Hypomagnesiämie sowie Stoffwechselveränderungen, wie das Auftreten von Hyperurikämie, Hyperglykämie oder die Manifestation eines Diabetes mellitus. Bei vorbelasteten Patienten können auch Gichtanfälle ausgelöst werden.
Bei den Schleifendiuretika steht ein Volumenmangel für die möglicherweise reduzierte Adhärenz im Vordergrund. Wenn der Patient wegen der Sturzdiurese das Medikament nicht regelmäßig nimmt, setzt ein Rebound-Effekt ein. Die Körperwassereinlagerung nimmt wieder zu. Bei isoliert verabreichten kaliumsparenden Diuretika treten Nebenwirkungen wie Hyperkaliämie (verstärkt durch die kombinierte Gabe mit einem ACE-Hemmer) sowie bei aldosteronabhängigen Kaliumsparern auch eine schmerzhafte Gynäkomastie beim Mann auf, was in beiden Fällen eine Therapieänderung erforderlich macht. Ebenfalls zu beachten ist ein Anstieg der Nierenwerte, besonders bei älteren Patienten, Diabetikern und bei unzureichender Flüssigkeitszufuhr.
Eine weitere Nebenwirkung der Thiazide und Schleifendiuretika ist ein Kalium- und Magnesiumverlust. Dadurch kommt es neben Muskelkrämpfen zum Auftreten bzw. zur Zunahme von Herzrhythmusstörungen. Die EKG-Verlaufsbeurteilung ist zur Erfassung der Kaliumsenkung hilfreich. Man findet eine Abflachung bzw. eine Inversion der T- Welle, ST-Strecken-Senkungen, erhöhte und breite biphasische U-Wellen. Die P-Welle ist erhöht, das PQ-intervall kann verlängert sein [4].
Die Hyperkalzämie zeigt anfangs keine sicheren klinischen Symptome. Im Zusammenhang mit der Grunderkrankung (z. B. Niereninsuffizienz, Diabetes mellitus) oder bei gleichzeitiger Gabe von Thiaziden mit Kalzium oder / und Vitamin D ist aber daran zu denken. Eine Hilfe bei der Beurteilung ist auch hier der Verlauf des EKG, das einen Rückgang der Herzfrequenz, PQ-Verlängerungen (AV-Block I. bis III. Grades), Zunahme der QRS-Dauer, QT-Verlängerung sowie T-Wellen-Überhöhung zeigt [4].
Therapie von Bluthochdruck und Dyslipidämie aus diabetologischer Sicht
Bei Patienten mit Diabetes mellitus sollte wegen der metabolischen Folgen kein HCT in der Langzeittherapie verordnet werden. Darunter kann es zur Abschwächung der Antidiabetika-Wirkung und damit zu einem negativen Einfluss auf den Zuckerstoffwechsel kommen. Regelmäßige Laborkontrollen sollten aus diesem Grunde auch unter der Therapie mit Schleifendiuretika vorgenommen werden.
Bei der großen Gruppe der adipösen Patienten besteht unter HCT die Gefahr der Diabetes-mellitus-Manifestation, zudem kann es zu Gichtanfällen durch die Harnsäureerhöhung kommen. Auch hier ist die Fixkombination aus Bendroflumethiazid und dem Kaliumsparer Amilorid eine gute Alternative, da sie aufgrund der wesentlich geringeren Wirkstoffbelastung und des ausgeglichenen Elektrolythaushalts blutzuckerneutral ist, keine Hyperkaliämie, keine Hyperurikämie und keine Erhöhung des LDL- oder Triglycerid-Spiegels verursacht.
Bei metabolisch-vaskulären Risikopatienten geht es aus diabetologischer Sicht vor allem um die Insulinresistenz. Hausärzten fällt dabei die Rolle des Risikomanagers zu. In der Hausarztpraxis finden sich vielfach Patienten mit einer reduzierten physischen Aktivität. Diese Patienten leiden an Hypertonie, endothelialer Dysfunktion, Arteriosklerose, Dyslipidämie und Hyperglykämie. Schlafapnoe gehört häufig auch dazu. All das wird durch Über- und Fehlernährung sowie durch den sozialökonomischen Status beeinflusst [5].
Die Komplikationen durch Bluthochdruck, Diabetes mellitus Typ 2 oder Adipositas sind dabei vergleichbar. Solche Patienten haben ein erhöhtes Risiko für Schlaganfall, Herzinfarkt, Niereninsuffizienz, Durchblutungsstörung und Erblindung. Die Deutsche Diabetes Gesellschaft hat die wichtigsten Punkte in einer Leitlinie zusammengefasst [6]: Wie alt ist der Patient? Welche Stoffwechselwerte hat er? Welche Laborparameter weichen ab?
Manche Berufsgruppen sind statistisch gesehen einem höheren Risiko ausgesetzt als andere. Zu achten gilt es demnach besonders auf Berufskraftfahrer, Fabrikarbeiter und Reinigungskräfte. Patienten mit einem geringen Bildungsniveau und schlechter Bezahlung haben ein deutlich erhöhtes Risiko, an Diabetes mellitus Typ 2 zu erkranken. Es ist leider unstrittig, dass der sozioökonomische Status eine große Rolle für unsere Patienten spielt [7].
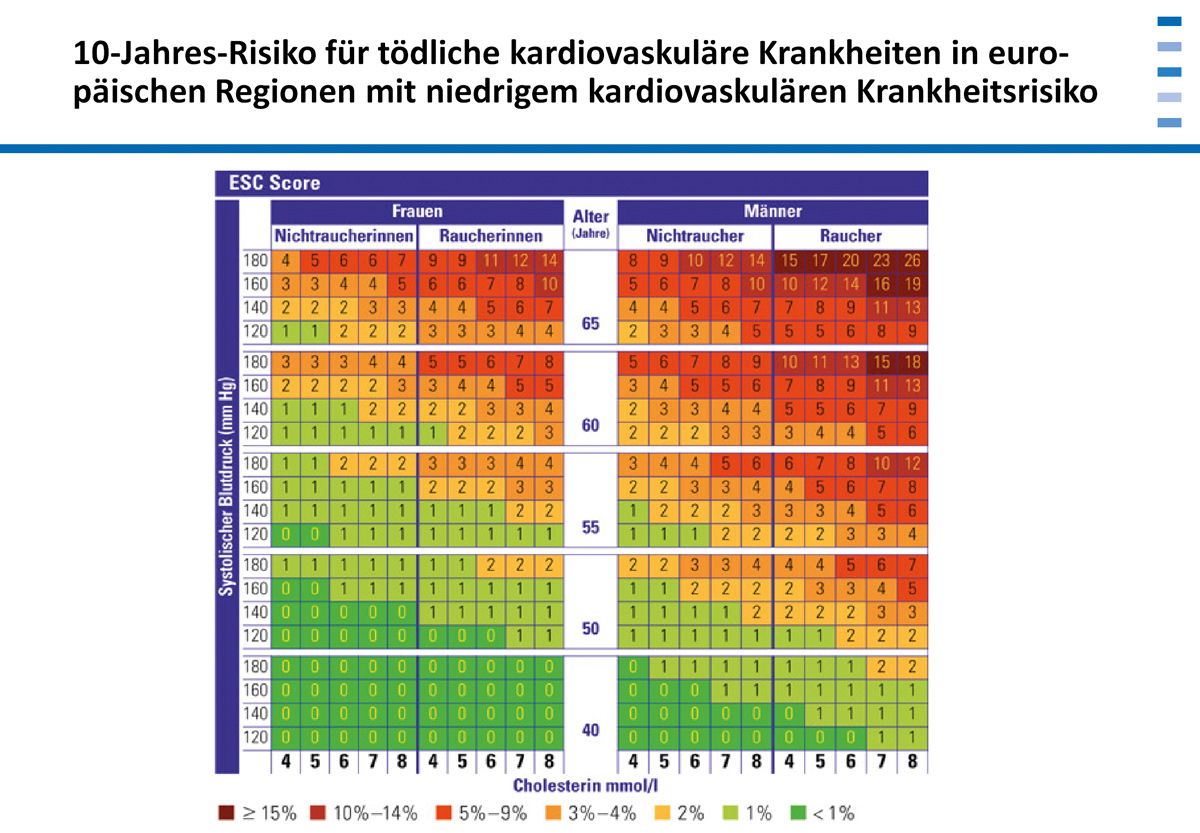
Die Risikostratifizierung wird in Scores zusammengefasst. Gebräuchliche Algorithmen in Deutschland sind zum Beispiel der Framingham-Risiko-Score und der PROCAM- Score der Assmann-Stiftung. Der ESC-Score2 erlaubt eine bessere Differenzierung nach länderspezifischem Risiko und Alter. Dabei gehört Deutschland zu den Ländern mit moderatem Risiko, es ist kein Low-Risk-Land.
Es sind also verschiedene Scores im Einsatz, die das Risiko der Patienten, Komplikationen zu erleiden, quantifizieren [8]. Allen Scores gemeinsam sind die Risiken Alter und Geschlecht sowie der Raucherstatus. Das Gesamtrisiko lässt sich in den Tabellen an der Farbigkeit ablesen. Und um das kardiovaskuläre Risiko eines Patienten abzuschätzen, fließt auch der Zielwert des LDL mit ein [9]. Das vorliegende Beispiel zeigt das 10-Jahres-Risiko für tödliche kardiovaskuläre Erkrankungen. Neben Alter und Geschlecht spielen Blutdruck und Cholesterin ein Rolle.
Nicht beeinflussbare Faktoren sind das Alter und die Familienanamnese. Beeinflussen können wir bei den Patienten dagegen den Raucherstatus, die Hypertonie und das Übergewicht [10]. Die Bedeutung dieser drei Parameter sollte man im Patientengespräch immer herausstellen: „Wir haben es mit Erkrankungen zu tun, die wir beeinflussen können. Wir geben Ihnen Werkzeuge an die Hand, mit denen Sie selbst etwas verändern können.“ Die Behandlungsziele ändern sich im Lauf der Zeit. Die ESC-Leitlinien sind immer vier Jahre gültig und die aktuelle Version ist von 2019. Die DDG hat die Ziele moderner formuliert, wenn sie auch nicht sehr von den ESC-Leitlinien abweichen. Dort sind Zielbereiche für HbA1c, Blutdruck und Lipide definiert.
Je früher mit der glykämischen Kontrolle, der Blutdruckkontrolle und der Kontrolle der Fettstoffwechsel-Parameter begonnen wird, umso geringer ist das Risiko für Folge- Komplikationen [11, 12]. Was frühzeitig versäumt wurde, lässt sich später kaum noch korrigieren.
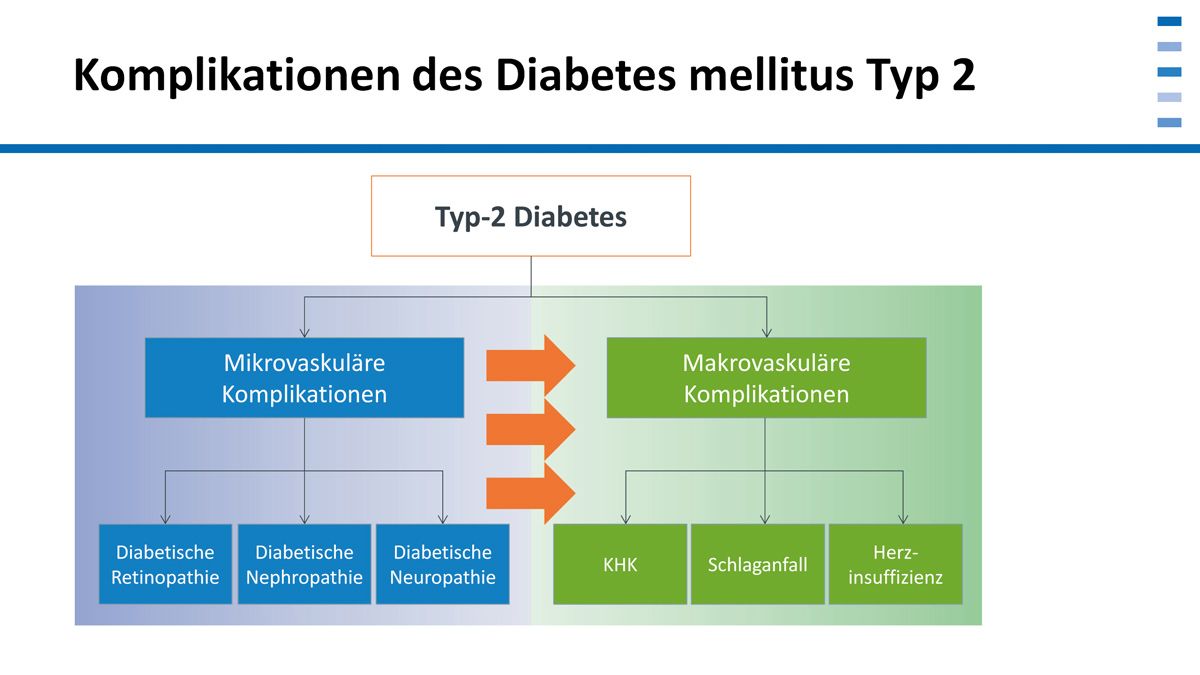
Es gilt zu verhindern, dass Patienten mikrovaskuläre oder makrovaskuläre Komplikationen aufgrund des Diabetes mellitus Typ 2 erleiden. Für die makrovaskulären Faktoren Schlaganfall, Herzinfarkt oder Herzinsuffizienz gibt es eine gute Studienlage und sehr viele Antidiabetika [13]. Man muss aber festhalten: Mikrovaskuläre Komplikationen sind für den Patienten genauso schlimm, egal ob Erblindung, Dialyse oder Fußsyndrom.
Daher ist die frühzeitige Therapie so wichtig. Bis die Diagnose final gestellt ist, können die Schäden bereits manifest sein. So haben zum Beispiel 60 % der Patienten bereits eine Folgeerkrankung, wenn durch den oralen Glukosetoleranztest, den HbA1c-Wert oder den mehrfach erhöhten Nüchtern-Blutzucker die Diagnose „Diabetiker“ gestellt wird.
Das Fortschreiten der Erkrankung hängt mit der zunehmenden Insulinresistenz zusammen. Definiert ist sie als verminderte Wirkung von Insulin, Glukose aus dem Blut in die Zielgewebe zu transportieren, zum Beispiel in die Muskeln [14]. Dazu gehört aber auch die verminderte Wirkung von Insulin, Lipide im Fettgewebe zu speichern und die fehlende Hemmung der Lipolyse mit der Folge der Verfettung weiterer Organe. Die damit assoziierte Hyperinsulinämie hat negativen Einfluss auf die Verfettung der Leber, aber auch auf den Herzmuskel und auf endotheliale Funktionen. Selbst für das Krebswachstum gilt, dass Insulinresistenz einen negativen Einfluss hat.
Um zu entscheiden, ob ein Patient wirklich an einer Insulinresistenz leidet, kann man den HOMA-Index hinzuziehen. Dieser Wert für die Insulinresistenz wird aus dem Nüchtern-Insulinspiegel und dem Nüchtern-Glukose-Spiegel berechnet. Der Wert sollte im klinischen Alltag beim PCO-Syndrom, bei Zyklusstörungen und Infertilität, aber natürlich auch beim Diabetiker Typ 2 und bei Adipositas erhoben werden. Gebraucht wird nur ein Milliliter Serum. Der Test ist jedoch nicht aussagekräftig, wenn der Patient bereits Insulin oder Sulfonylharnstoffe erhält.
Um die therapeutischen Ziele zu erreichen, ist auch bei den Lipiden die Kombinationstherapie ein probates Mittel. Wie bei den Antihypertensiva und in der Diabetologie sind es Kombinationen, die dem Patienten die Adhärenz erleichtern und somit auch die Zielwerterreichung.
Neben den ESC-Leitlinien existieren in Deutschland nationale Versorgungsleitlinien (NVL): Die NVL KHK von 2022 [15] und die NVL Diabetes von 2021 [16]. Beide stellen noch einmal die Selbstverantwortung des Patienten in den Vordergrund. An erster Stelle steht bei all diesen Erkrankungen die Lebensstiländerung, weil ansonsten Risikopatienten unter lipidsenkender Therapie ihre Zielwerte nicht erreichen, genauso bei den antihypertensiven oder antidiabetischen Therapien.
Prävention
Es ist die ureigenste Sprechstunden-Motivation des Hausarztes zu sagen: Ich begleite meinen Patienten, ich motiviere ihn, ich nutze alle Chancen in Kenntnis seiner Anamnese, seiner Familienanamnese, seiner sozioökonomischen Situation. Es ist ein gesetzliches Ziel, die primäre, sekundäre und tertiäre Prävention zu implementieren.
Primärprävention beginnt bereits vor einer Behandlung, etwa im Rahmen des Check-up. Die Sekundärprävention betrifft dann die Früherkennung zur Vermeidung von Folgeerkrankungen. Zu dieser Stufe der Prävention gehören auch die Disease-Management-Programme in ihrer Vielfalt (DMP), die schon alle eingeführt und im nächsten Jahr wahrscheinlich noch um ein DMP Adipositas ergänzt werden. Die Erklärung zur Teilnahme ist ein Vertrag, den wir mit unserem Patienten schließen und in dem wir auch gegenseitig Forderungen stellen dürfen.
Dazu gehört es, Ziele zu formulieren. Im diabetologischen Umfeld ist der Gesundheitspass Diabetes der Deutschen Diabetes Gesellschaft zu empfehlen. So können alle Beteiligten die Ziele einsehen, auch der Nephrologe und der Kardiologe. Diese Ziele werden jedes Jahr neu formuliert und die Patienten wissen: Hier können sie nachschauen, ob sie im Zielbereich sind oder nicht, ob sie alle Untersuchungen wahrgenommen oder etwas vergessen haben. Für die Adhärenz des Patienten ist das sehr wichtig.
Schulungen sind in der Schwerpunktpraxis kontinuierliche Angebote. Dazu gehört auch eine spezielle Schulung für Hypertonie mit vier Unterrichtseinheiten, in der Patienten unter anderem Hilfestellungen zur Durchführung ihrer medikamentösen Therapie erhalten. Wir sollten Patienten dabei auch auf die Informationsangebote von Fachgesellschaften, wie der Deutschen Hochdruckliga, hinweisen. Dazu gehören Tipps zur Gewichtsreduktion sowie zur Ernährungsumstellung und Lebensstiländerung als Unterstützung der medikamentösen Therapie.
Metabolische Effekte von Thiaziden
Die pathophysiologischen Vorgänge hinter den metabolischen Effekten von Thiaziden sind immer noch nicht vollständig bekannt. Wir kennen das Potenzial der Thiazide, die Stoffwechselparameter negativ zu beeinflussen [17], wissen aber auch, dass zum Beispiel Betablocker eine noch größere Wirkung auf den Glukosestoffwechsel haben [18]. Ausgenommen ist hier Nebivolol.
Mangelnde Bewegung gilt als ein Hauptfaktor für die Entstehung der Fettleber [19]. Dazu kommt der Faktor Überernährung, insbesondere durch zu viele Kohlenhydrate. Dies führt zur Insulinresistenz mit dem erhöhten Insulinspiegel. Wenn die Speicherkapazität der Muskeln erschöpft ist, erfolgt die Einlagerung als Fett in Leber, Pankreas, Bauchraum und Herz, wo es das Auftreten von Vorhofflimmern fördert. Mit der Fettleber, als Teil des metabolischen Syndroms, erhöhen sich der Blutzucker, die Blutfette, der Blutdruck und der Insulinbedarf weiter.
Diese Auswirkungen sehen wir auch beim HCT, wobei man nochmal festhalten muss: Auslöser der Fettleber sind Überernährung und Bewegungsmangel, die durch die langfristige Zugabe von HCT jedoch weiter befeuert werden kann und damit die klinischen Auswirkungen verstärkt: Typ-2-Diabetes, Herzgefäßerkrankung, Nierenerkrankung sowie Veränderung im Knochenstoffwechsel. Obwohl HCT seit 1961 bekannt ist, hat erst 2008 eine Studie die Auswirkungen auf den Fettgehalt in der Leber im Vergleich zu Candesartan untersucht [20].
Der Aspekt der Fettleber sollte in der Praxis mehr in den Vordergrund rücken. Bereits 25-30 % der Erwachsenen in den westlichen Ländern weisen eine Fettleber auf (Deutschland 25,4 %) sowie 50-75 % der Typ-2-Diabetiker und 80-90 % aller Adipösen [21, 22]. Der Taillenumfang sollte verstärkt in den Alltagsfokus rücken, da wir so das viszerale Fett abschätzen können. Nach WHO werden Männern nur 94 cm zugestanden (und nicht 102 cm) und Frauen nur 80 cm (und nicht 88 cm).
Die nicht-alkoholische Fettleber ist auch mit der Erhöhung von hochsensitiven CrP, CrP, HOMA-Index, LDL, Triglyceride und Harnsäure verbunden. Deshalb sollte man aus prognostischen und therapeutischen Gründen in der Praxis den Fettleberindex (FLI) häufiger zur Erfassung der Fettleber nutzen.
Ein anderer möglicher Mechanismus zur Entwicklung einer Hyperglykämie ist die durch die Thiazide (HCT) ausgelöste Hypokaliämie [23, 24]. Demnach kommt es in den Betazellen des Pankreas durch Herabregulierung der Insulinproduktion zum Auftreten der Hyperglykämie. Vermutlich ist das nicht der alleinige Mechanismus, sondern ein Zusammenspiel mit der Fettleber.
Hinweise für die tägliche Praxis
All diese Dinge kann man in der Ernährungsberatung verwenden: HOMA-Index, Bestimmung des Gewichts und des Bauchumfangs. Ein Bandmaß mit einem roten und grünen Bereich macht dem Patienten sehr klar, wann es wirklich rot wird. Die Botschaft an den Patienten lautet: „Hier ist Ihr Risiko, bitte versuchen Sie jetzt, das mit uns zu verbessern. Wir helfen dabei, die geeignetsten Medikamente auch richtig einzusetzen und durch eine Lebensstiländerung bessere Rahmenbedingungen zu erreichen.“
Die Adhärenz-Probleme einer Diuretika-Gabe sind je nach Diuretikum unterschiedlich. Im Vordergrund steht die Sturzdiurese, insbesondere bei den Schleifendiuretika. Wenn Patienten uns mitteilen: „Ich kann dadurch nicht zum Einkaufen oder zur Arbeit gehen“, ist das problematisch. Auch Schwindel, Unwohlsein und Mundtrockenheit reduzieren die Therapietreue, nicht zu vergessen die Muskelkrämpfe in den Händen und Beinen aufgrund von Elektrolytverschiebungen, die ziemlich störend sein können. Auch Sturzgefahr (hypotone Zustände durch Volumenmangel bei älteren und gebrechlichen Patienten), Rebound-Effekt und Herzrhythmusstörungen gehören dazu.
Eine höhere Compliance in der Diuretika-Langzeittherapie ist zu erreichen, wenn man die Thiazide mit einem kaliumsparenden Diuretikum kombiniert, z. B. mit der Kombination aus Bendroflumethiazid und Amilorid. Damit ist die Harnproduktion kontinuierlich, es tritt keine Sturzdiurese auf, kein Rebound-Effekt und keine Muskelkrämpfe. Die Blutdrucksenkung liegt im Bereich von 10-25 mmHg und diese Substanzkombination ist aufgrund der ca. 20-fach geringeren Wirkstoffbelastung metabolisch neutral bezüglich Blutzucker, Harnsäure und Blutfetten.
Zur besseren Einschätzung der Adhärenz sollten sich Patienten regelmäßig wiegen und ihren Blutdruck messen. Gewicht und Blutdruck erlauben eine gute Beurteilung der Dosis, können Nebenwirkungen verhindern und dokumentieren einen möglichen Rebound-Effekt. Eine solche Gewichtszunahme gibt den Hinweis, dass die Tabletteneinnahme nicht entsprechend Verordnung durchgeführt wurde – und damit keine „therapieresistente“ Hypertonie vorliegt.
Wenn wir von Lebensstiländerungen sprechen, müssen wir das für die Patienten auch konkretisieren: Dazu gehören die Salzrestriktion, die Alkoholeinschränkung, die Einstellung des Rauchens, die Ernährungsumstellung und gegebenenfalls die Gewichtsreduktion. „Sport“ hört sich für Patienten oft schwierig an, deshalb sprechen wir besser von Bewegung.
Die Ernährungsumstellung ist am schwierigsten zu vermitteln. Letztlich geht es darum, seit Jahrzehnten bekannte Empfehlungen in die tägliche Ernährung zu übernehmen [25], wie zum Beispiel die DASH-Diät mit mehr Gemüse, Obst, Milchprodukten, Fisch, Salzreduktion und weniger Kohlenhydraten. 40 Energieprozent sollen als Eiweiß aufgenommen werden und je 30 Energieprozent als pflanzliche Fette und Kohlenhydrate.
Wer es schafft, seine Kalorienzufuhr um 200 bis 300 Kcal pro Tag zu reduzieren, kann den Blutzuckerspiegel und das Gewicht positiv beeinflussen. Und je Kilogramm Gewichtsreduktion kann man den Blutdruck 2 mmHg systolisch senken. Hier gilt: Je mehr Gewicht reduziert wird, umso deutlicher ist die Blutdrucksenkung. Gewichtsreduktion ist die einfachste und effektivste Möglichkeit, sowohl den Diabetes als auch den Blutdruck in den Griff zu bekommen.
Unser ärztliches Bemühen sollte schon im Vorfeld sein, auch Patienten mit normalem Körpergewicht darauf hinzuweisen: „Bitte bleiben Sie in dieser Gewichtsklasse, dann bleiben auch Ihr Blutdruck und Ihr Blutzucker normal.“ Ebenso lässt sich durch Bewegung und Sport eine gute Blutdrucksenkung erreichen, wobei die Summe der Maßnahmen letztlich das Entscheidende ist.
Zum Schluss noch ein Hinweis an alle Kolleginnen und Kollegen: Eine amerikanische Studie hat das Lebensstilverhalten von Ärzten untersucht und herausgefunden: Leider ist es auch nicht viel besser als in der Gesamtbevölkerung. Denken Sie daher – auch in Ihrem eigenen gesundheitlichen Interesse – an Ihre Vorbildfunktion für all die empfohlenen Maßnahmen, denn das ist für Patienten ein wesentlicher Motivationsfaktor.
Literatur
- ESC/ESH Guidelines for the management of arterial hypertension. Europ. Heart J 2018; 39: 3021‑3104
- ESC Guidelines on diabetes, pre‑diabetes, and cardiovascular disease developed in collaboration with EASD. Europ Heart J 2019; 40: 1‑69
- Peterzan MA et al. Hypertension 2012; 59: 1104‑1109
- Parsi RA, Parsi E. Kardiologie Angiologie, Urban & Fischer, München‑Jena, 2001
- Scholz GH, Hanefeld M. Visc Med 2016; 32: 319‑326
- Landgraf R et al. Diabetol Stoffw 2020; 15 / Suppl 1): S65‑S92
- Carlsson S et al. Diabetologia 2020; 63: 95‑103
- SCORE2‑OP working group. Eur Heart J 2021; 42: 2455‑2467
- Mach F et al. Eur Heart J 2020; 41: 111‑188
- Mahley RW et al. In: Brunton L. Goodman & Gimans Pharmacological Basis of Therapeutics. 11 ed. 2006; 933‑966
- Del Prato S et al. Int J Clin Pract 2005; 59: 1345‑1355
- Stratton IM et al. BMJ 2000, 321: 405‑412
- Grobbee DE. Metabolism 2003; 52 (8 Suppl 1): 24‑28
- Eckel RH et al. Lancet 2005; 365: 1415‑1428
- Nationale Versorgungsleitlinie KHK, Version 6 2022
- Nationale Versorgungsleitlinie Diabetes, Version 2 2021
- Ellison DH et al. Clin J Am Soc Nephrol 2019; 14: 1248‑1257
- Elliott WJ, Meyer PM. Lancet 2007; 369: 201‑207
- Worm NJ et al. Ernährung Med 2016; 31: 67‑72
- Erikson JW et al. Hypertension 2008; 52: 1030‑1037
- Riazi K et al. Lancet Gastroenterol Hepatol 2022; 7: 851‑861
- Roeb E et al. Z Gastroenterol 2022; 60: 1346‑1421
- Zillich AJ et al. Hypertension 2006; 48: 219‑224
- Carter BL et al. Hypertension 2008; 52: 30‑36
- Appel LJ et al. N Engl J Med 1997; 336: 1117‑1124
Bildquellen
Titel: © AnnaStills – iStockphoto.com










Guten Tag,
als Augenarzt begegnet mir häufig das Problem, daß der Blutdruck gerade nachts zu gut eingestellt ist und die Diastole < 60 mm Hg beträgt. Diese ist allerdings bei Glaukompatienten fatal, weil im Tiefschlaf der Augeninnendruck relativ. am höchsten ist und bei niedriger Diastole der Sehnerv schlecht durchblutet wird. Gibt es Antihypertonika mit niedriger HWZ, die man tagsüber einsetzen kann um dieses zu verhindern? Für Ihre Antwort haben Sie recht herzlichen Dank.
Mit freundlichen Grüßen
Johannes Staab
Augenarzt
49324 Melle
Gute information
meine erwartung der ziele und themen der fortbildung haben sich erfüllt
während des durcharbeitens habe ich fachlich gelernt
der text hat relevanz für meine praktische tätigkeit
die didaktik , die eingängigkeit und die Qualität des textes sind sehr gut
gemessene am zeitlichen u organsatorisatorischen aufwand hat sich dei bearbeatung gelohnt
in der fortbildung wurde die firmen und produktneuraliätt gewahrt