Perioperative medikamentöse Therapie des muskelinvasiven Blasenkarzinoms
Interessengebiete: Allgemeinmedizin und Innere Medizin, Chirurgie, Urologie, Onkologie
Das muskelinvasive Blasenkarzinom (MIBC) ist eine Erkrankung mit einer hohen Morbidität und Mortalität, die trotz Fortschritten in der Therapie weiterhin eine Herausforderung darstellt. Diese CME-Fortbildung vermittelt Ihnen das notwendige Wissen, um die aktuelle Diagnostik und Therapie des MIBC zu verstehen und die aktuellen Leitlinienempfehlungen in der Praxis umzusetzen.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Das muskelinvasive Blasenkarzinom (MIBC) ist eine Erkrankung mit einer hohen Morbidität und Mortalität, die trotz Fortschritten in der Therapie weiterhin eine Herausforderung darstellt. Diese CME-Fortbildung vermittelt Ihnen das notwendige Wissen, um die aktuelle Diagnostik und Therapie des MIBC zu verstehen und die aktuellen Leitlinienempfehlungen in der Praxis umzusetzen.
Epidemiologie
Das muskelinvasive Blasenkarzinom (MIBC) ist die fortgeschrittene Form des Blasenkrebses. In Deutschland erkranken jährlich etwa 7.000 bis 8.000 Menschen neu an einem MIBC [1]. Männer sind signifikant häufiger betroffen als Frauen, mit einem Verhältnis von ungefähr 3:1. Die Inzidenz des MIBC variiert regional, wobei in Industrienationen die Fallzahlen tendenziell höher liegen.
In den Jahren 2017 / 2018 erkrankten in Deutschland jährlich durchschnittlich rund 23.600 Männer und 7.500 Frauen an einem Harnblasentumor (ICD-10 C67, D09.0, D41.4). Jeweils rund 60 % der Tumoren waren histologisch invasiv (ca. 12.900 bzw. 4.700). Das Erkrankungsrisiko für invasive und nichtinvasive Formen steigt mit dem Alter an (Abb. 1). Das mediane Erkrankungsalter lag bei den invasiven Formen (Männer: 75 Jahre, Frauen: 76 Jahre) leicht über dem der nichtinvasiven Formen (Männer: 73 Jahre, Frauen: 72 Jahre) [2].
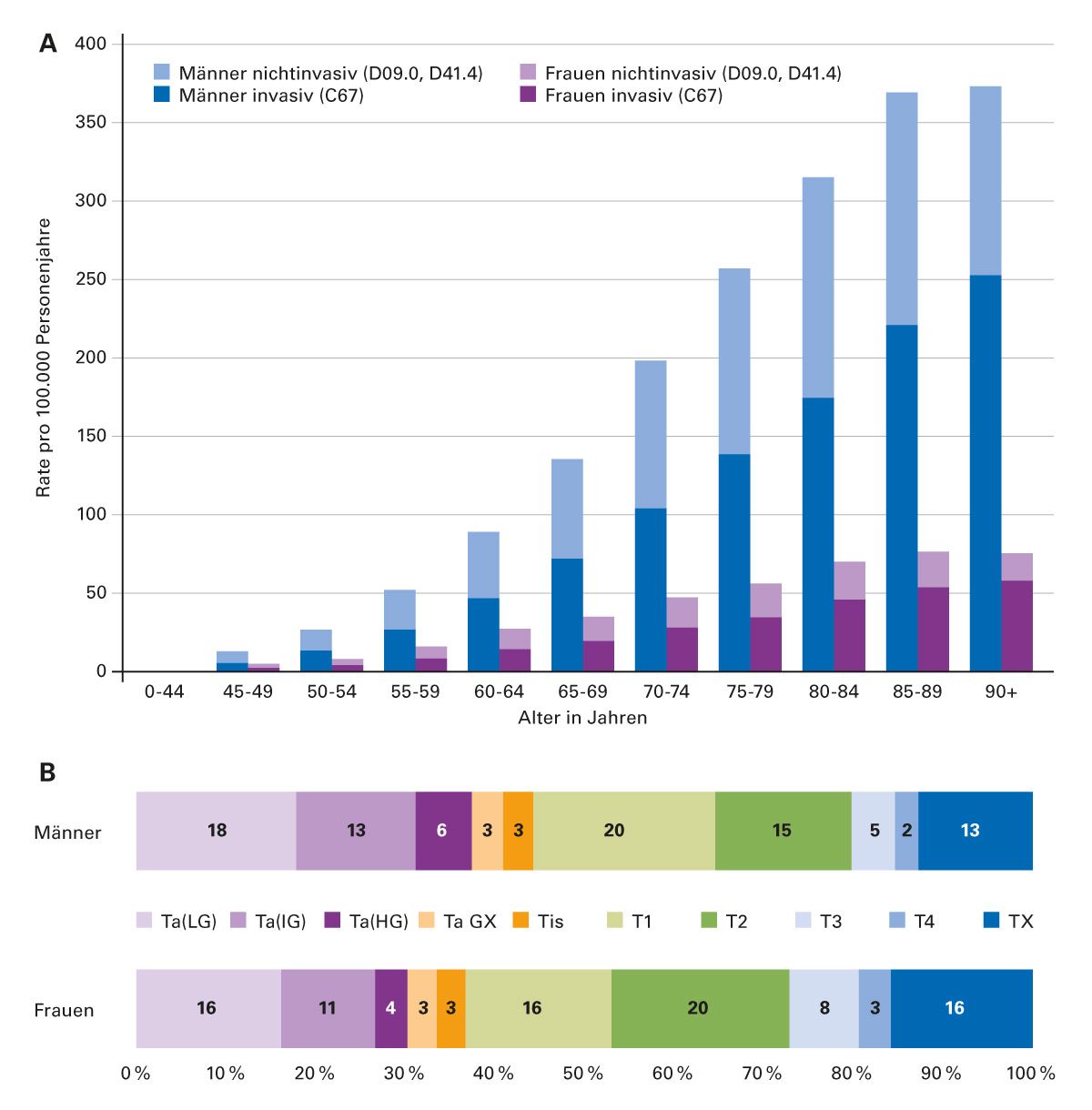
Abb. 1A: Altersspezifische Neuerkrankungen der Blase 2017–2018 nach Geschlecht [2].
Abb. 1B: Verteilung der Tumorstadien. LG „low grade“, IG „intermediate grade“,HG „high grade“, GX/TX Grad, T unbekannt
Der bedeutendste modifizierbare Risikofaktor für die Entwicklung eines MIBC ist das Rauchen, das das Risiko, an Blasenkrebs zu erkranken, um das Zwei- bis Dreifache erhöht. Weitere wesentliche Risikofaktoren umfassen die berufliche Exposition gegenüber bestimmten Chemikalien, insbesondere aromatischen Aminen, die in der Chemie-, Leder- und Textilindustrie verwendet werden.
Auch chronisch entzündliche Schädigungen der Blasenschleimhaut erhöhen das Erkrankungsrisiko, wobei hier auch atypische Histopathologien wie Plattenepithelkarzinome möglich sind. Familiäre Häufungen werden beobachtet: Es gibt Hinweise, dass genetische Faktoren eine Rolle bei der Entstehung von Blasenkrebs spielen, indem sie die Empfindlichkeit gegenüber Karzinogenen beeinflussen.
Pathophysiologie
Das MIBC entsteht durch die Invasion eines ursprünglich oberflächlichen Blasentumors in die Muskelschicht der Blasenwand, die sogenannte Muscularis propria. Diese Invasion markiert den Übergang von einem nicht-muskelinvasiven zu einem muskelinvasiven Tumor und ist ein kritischer Wendepunkt in der Krankheitsprogression, da sie das Risiko für Metastasen signifikant erhöht [3]. Histologisch handelt es sich bei den meisten MIBC um Urothelkarzinome, die aus den Zellen des Urothels, der innersten Schicht der Blasenwand, hervorgehen. Urothelkarzinome zeichnen sich durch eine hohe Heterogenität aus, sowohl hinsichtlich ihrer genetischen als auch ihrer morphologischen Merkmale. Wichtige genetische Alterationen umfassen Mutationen in den Genen FGFR3, TP53 und RAS, die eine Rolle bei der Tumorprogression und der Resistenz gegenüber bestimmten Therapien spielen [3].
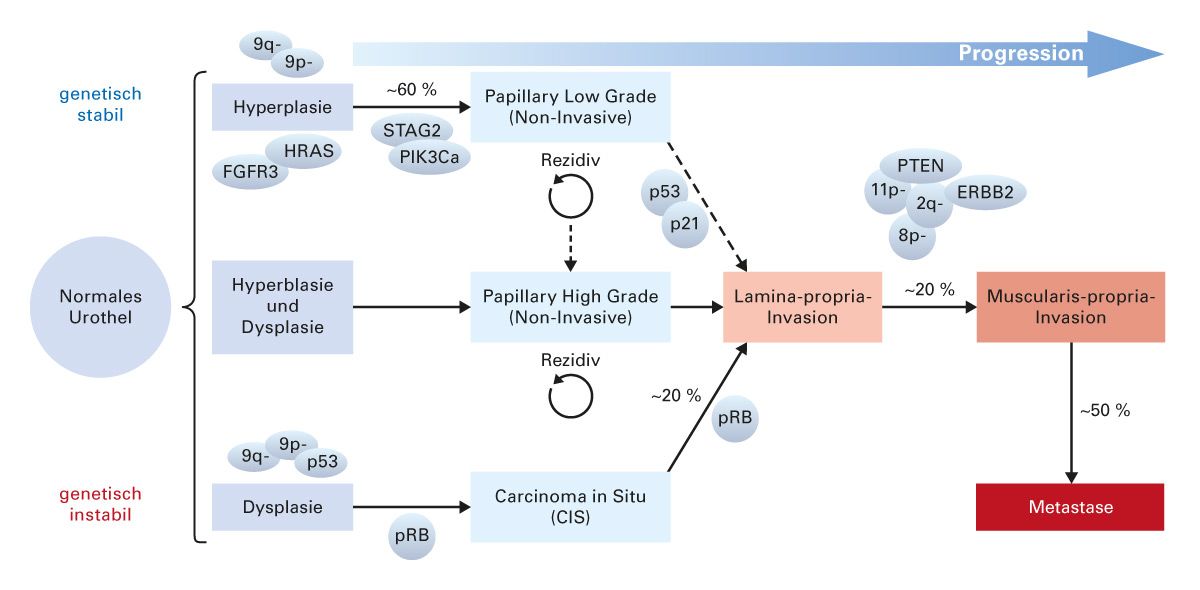
Das invasive Wachstum des Tumors wird durch eine Reihe von molekularen Veränderungen begünstigt, die zu einer erhöhten Zellproliferation, einer verminderten Apoptose und einer gesteigerten Fähigkeit zur Angiogenese führen. Ein charakteristisches Merkmal von MIBC ist die Fähigkeit des Tumors, die Basalmembran zu durchbrechen und in die darunterliegende Muskelschicht einzudringen. Diese Invasion führt zu einer erhöhten Gefahr der lymphogenen und hämatogenen Metastasierung, was die Prognose deutlich verschlechtert [3]. Die Karzinogenese des Urothelkarzinoms lässt sich in einem dualen Modell darstellen, welches die zugrunde liegenden molekularen Alterationen zusammenfasst (Abb. 2) [4–6]:
- Nichtinvasive papilläre low-grade Karzinome entstehen durch eine Hyperplasie und sind auf molekularer Ebene durch beispielsweise den Verlust der Heterozygotie (LOH) von Chromosom 9 und aktivierende-Mutationen von FGFR3, PIK3CA (Phosphoinositid-3-Kinase, die für p110α kodiert) und Stroma-Antigen 2 (STAG2) gekennzeichnet. Diese nichtinvasiven Tumoren rezidivieren häufig, sind aber genetisch stabil.
- MIBC gehen häufig aus den aggressiveren Formen des oberflächlichen Urothelkarzinoms hervor. Bei CIS, pTa/G3 bzw. pT1/G3 besteht die größte Gefahr bzgl. der Entwicklung eines MIBC.
- Bei der Entstehung von nicht-invasiven papillären high-grade Karzinomen wird sowohl eine Entwicklung aus nicht-invasiven low-grade Karzinomen wie auch aus einer oberflächlichen Hyperplasie oder Dysplasie diskutiert.
Klassifikation
Die Klassifikation des MIBC erfolgt nach dem TNM-System (Tumor, Node, Metastasis) der Union for International Cancer Control (UICC) [7].
- T-Stadium (Tumor): Das T-Stadium beschreibt die Ausdehnung des Primärtumors. Ein T2-Tumor infiltriert die Muskelschicht der Blasenwand (Muscularis propria), während T3-Tumoren darüber hinaus in das perivesikale Gewebe eindringen. T4-Tumoren befallen angrenzende Organe wie die Prostata, die Gebärmutter oder die Vaginalwand.
- N-Stadium (Node): Das N-Stadium beschreibt den Befall der regionalen Lymphknoten. Ein N1-Tumor zeigt eine Metastase in einem einzelnen regionalen Lymphknoten, während N2 oder N3 mehre Lymphknoten im kleinen Becken bzw. einen höherliegende Lymphknotenbeteiligung kennzeichnen.
- M-Stadium (Metastasis): Das M-Stadium gibt das Vorhandensein von Fernmetastasen an. M1 bedeutet, dass Fernmetastasen in Organen bzw. in nicht-regionären Lymphknoten vorhanden sind, was die Prognose signifikant verschlechtert.
Zusätzlich zur TNM-Klassifikation ist das Tumorgrading ein weiterer wichtiger prognostischer Faktor. Das Grading wird nach den Kriterien der Weltgesundheitsorganisation (WHO) 2016 durchgeführt und klassifiziert den Differenzierungsgrad des Tumors in [7]:
- G1 (gut differenziert): Diese Tumoren sind histologisch gut differenziert und haben ein geringeres Metastasierungsrisiko.
- G2 (mäßig differenziert): Diese Tumoren weisen eine intermediäre Differenzierung und ein moderates Risiko auf.
- G3 (schlecht differenziert): Diese Tumoren sind schlecht differenziert, neigen zu einem aggressiveren Verhalten und haben eine schlechtere Prognose.
Das Verständnis der TNM-Klassifikation und des Tumorgradings ist für die Therapieplanung entscheidend. Es hilft den Ärzten, die bestmögliche Therapieoption für ihre Patienten zu wählen und eine präzise Prognose abzugeben.
Diagnostik und Stadieneinteilung
Die präzise Diagnostik und Stadieneinteilung des MIBC ist der Schlüssel zu einer erfolgreichen Therapieplanung und Prognoseabschätzung. Sie ermöglicht die genaue Bestimmung des Tumorstadiums, das sowohl die lokale Ausdehnung des Primärtumors als auch das Vorhandensein von Lymphknotenmetastasen und Fernmetastasen umfasst.
Bildgebende Verfahren
Die Bildgebung ist ein zentraler Bestandteil der Diagnostik bei MIBC und dient der genauen Beurteilung der Tumorausdehnung sowie der Suche nach Metastasen. Verschiedene bildgebende Verfahren werden in der klinischen Praxis eingesetzt: Die Computertomografie (CT), insbesondere die CT-Urografie, ist die Standardmethode zur Beurteilung des Primärtumors der regionalen Lymphknoten und der Fernmetastasen. Sie bietet detaillierte Schnittbilder des Abdomens und des Beckens und ermöglicht die Visualisierung von Tumorinvasionen in die Blasenwand sowie von vergrößerten Lymphknoten. Die CT-Urografie kann auch Harnleiterobstruktionen und Anomalien im oberen Harntrakt aufzeigen, die durch den Tumor verursacht werden könnten [3, 8].
Die Magnetresonanztomografie (MRT) bietet im Vergleich zur CT eine überlegene Weichteildarstellung und ist besonders nützlich für die Beurteilung der lokalen Tumorausdehnung, insbesondere bei Patienten, die für eine CT-Kontrastmittelgabe ungeeignet sind. Das multiparametrische MRT, das Sequenzen wie T2-gewichtete Bilder, diffusionsgewichtete Bilder (DWI) und dynamische Kontrastmittel-Sequenzen kombiniert, kann die Infiltrationstiefe des Tumors in die Blasenwand präzise beurteilen. Es ist auch hilfreich bei der Beurteilung der Tumorinfiltration in benachbarte Organe wie die Prostata oder das Rektum [3, 8, 9].
Die Positronen-Emissions-Tomographie / CT (PET-CT), insbesondere unter Verwendung von 18F-Fluordeoxyglukose (FDG), kann eine ergänzende Diagnostik sein und ist besonders nützlich bei der Suche nach Fernmetastasen, da sie Bereiche mit erhöhter metabolischer Aktivität identifiziert, die auf Tumoraktivität hinweisen können. Die PETCT kann in Fällen, in denen die konventionelle Bildgebung unschlüssig ist, zusätzliche Informationen liefern und zur Planung der Therapie beitragen [3, 10].
Zystoskopie und transurethrale Resektion (TUR-B)
Die Zystoskopie mit Biopsie bzw. anschließender TUR-B ist der Goldstandard in der Diagnostik des MIBC [11]. Sie ermöglicht die direkte Inspektion der Blase und die visuelle Identifikation von Tumoren, was besonders wichtig ist, da Blasentumoren eine vielfältige morphologische Präsentation aufweisen können.
Die Weißlicht-Zystoskopie ermöglicht die direkte Visualisierung der Blasenschleimhaut. Sie dient der Identifizierung von oberflächlichen rötlichen Läsionen bis zu größeren Tumormassen. Während der Zystoskopie kann auch eine Biopsie entnommen werden, wobei hier bei größeren Tumoren ein relevantes Blutungsrisiko besteht.
Die Transurethrale Resektion der Blase (TUR-B) ist sowohl ein diagnostisches als auch ein therapeutisches Verfahren. Während der TUR-B wird der Tumor vollständig oder teilweise reseziert, was nicht nur die Symptomatik lindern, sondern auch eine histologische Diagnose ermöglichen kann. Die Resektion erlaubt die Bestimmung des Tumorstadiums, eine tiefe Schicht inkl. Muscularis gibt hier Auskunft über die Infiltrationstiefe. Die histopathologische Untersuchung des entnommenen Gewebes ermöglicht die Bestimmung des Tumorgradings und die Identifizierung von molekularen Markern und ist ein unerlässlicher diagnostischer Schritt [3].
Tumorgrading
Die TUR-B liefert Gewebeproben, die für das Tumorgrading unerlässlich sind. Das Grading gibt Auskunft über die Differenzierung des Tumorgewebes. Gut differenzierte Tumoren (G1) haben eine günstigere Prognose, während schlecht differenzierte Tumoren (G3) aggressiver sind und häufiger zu Metastasen führen [3].
Therapie
Die Instillationstherapie des Harnblasenkarzinoms ist ein wesentlicher Bestandteil der Behandlung von nicht-muskelinvasivem Blasenkarzinom (NMIBC). Zu den am häufigsten verwendeten Substanzen gehören Mitomycin C (MMC) und Bacillus Calmette-Guérin (BCG). Die Wahl der Therapie richtet sich nach dem Risikoprofil des Patienten, das sich aus Tumorgröße, -grad, -stadium sowie dem Vorhandensein von multifokalen Läsionen oder rezidivierenden Tumoren ergibt.
BCG ist der Goldstandard für die Behandlung von Patienten mit hohem Risiko für das Rezidiv und die Progression von nicht-muskelinvasivem Blasenkarzinom. Die immunologische Wirkung von BCG führt zur Aktivierung von Makrophagen, T-Zellen und anderen Immunzellen, die das Tumorwachstum hemmen [12].
Entscheidend ist letztlich die histologische Begutachtung (Ta/T1/T2) sowie der der Ausschluss eines Carcinoma in situ (CIS). Heute werden Tumoren oft statt den Gradings G1-G3 mit „papillary urothelial neoplasia of low malignant potential (PUNLMP)“, low Grade und high Grade bezeichnet. Die Leitlinie gibt vor, dass die Klassifikation von 2016 hier zu verwenden ist [7].
Dieser Artikel fokussiert sich auf die perioperative Therapie des MIBC. Auch wenn insbesondere das BCG refraktäre NMIBC eine Entität ist, bei der die radikale Zystektomie den therapeutischen Goldstandard darstellt soll dieser Artikel das MIBC bzw. die perioperative medikamentöse Therapie differenziert darstellen.
Radikale Zystektomie oder trimodale Therapie?
Die Therapie des MIBC stellt eine komplexe Herausforderung dar, die eine multidisziplinäre Herangehensweise erfordert. Sie umfasst chirurgische, chemotherapeutische, immuntherapeutische und strahlentherapeutische Ansätze. Die Wahl der geeigneten Therapie hängt von verschiedenen Faktoren ab, darunter das Tumorstadium, das Grading, der Allgemeinzustand des Patienten sowie seine Präferenzen. In den letzten Jahren haben sich die Therapieoptionen erweitert, insbesondere durch den Einsatz neuerer Immuntherapien und personalisierter Ansätze.
Die radikale Zystektomie gilt als der Goldstandard in der Behandlung des MIBC. Dieser chirurgische Eingriff beinhaltet die vollständige Entfernung der Harnblase sowie der regionalen Lymphknoten. Bei Männern schließt dies in der Regel die Prostata und die Samenbläschen mit ein, während bei Frauen in der Regel die Gebärmutter, die Eierstöcke und ein Teil der Vaginalwand entfernt werden. Die radikale Zystektomie bietet die besten langfristigen Überlebenschancen, insbesondere bei Patienten im Stadium T2–T4a N0 M0 [3].
Die Evidenz für die Wirksamkeit der radikalen Zystektomie stammt aus mehreren retrospektiven und prospektiven Studien, die eine 5-Jahres-Überlebensrate von etwa 50–60 % bei Patienten mit lokal begrenztem MIBC zeigen. Die radikale Zystektomie ist jedoch mit einer erheblichen Morbidität verbunden, einschließlich postoperativer Komplikationen wie Harnableitungsproblemen, sexueller Dysfunktion und einer potenziellen Beeinträchtigung der Lebensqualität [3, 13, 14].
Die Trimodale Therapie (TMT) stellt eine organerhaltende Alternative zur radikalen Zystektomie dar und besteht aus einer Kombination von transurethraler Resektion des Blasentumors, Strahlentherapie und Chemotherapie. Sie ist besonders geeignet für Patienten, die für eine radikale Zystektomie nicht infrage kommen, entweder aufgrund von Komorbiditäten oder weil sie die Blase erhalten möchten [3].
Die Evidenzlage zur TMT zeigt, dass bei sorgfältig ausgewählten Patienten die onkologischen Ergebnisse zumindest im kurzfristigen Nachbeobachtungszeitraum vergleichbar mit denen der radikalen Zystektomie sein können. Die TMT bietet eine 5-Jahres-Überlebensrate von etwa 50 % bei Patienten mit T2–T4a N0 M0, was der Rate nach radikaler Zystektomie ähnelt [15, 16]. Hier muss allerdings darauf hingewiesen werden, dass eine relativ radikale TUR-B für diese hohen Erfolgsraten zwingend erforderlich erscheint und gewisse Selektionseffekte die Studienpopulationen beeinflusst haben können.
Therapieentscheidung Lokaltherapie
Die Entscheidung zwischen radikaler Zystektomie und TMT sollte individuell und in einem multidisziplinären Tumorboard getroffen werden. Hierbei werden Faktoren wie das Tumorstadium, das Grading, der allgemeine Gesundheitszustand des Patienten, seine Lebensqualität sowie persönliche Präferenzen berücksichtigt [3].
Die radikale Zystektomie ist in der Regel bei Patienten mit einer guten physischen Verfassung und bei solchen indiziert, bei denen eine vollständige Tumorentfernung angestrebt wird. Die TMT wird bei Patienten bevorzugt, die entweder nicht für eine radikale Zystektomie infrage kommen oder die Blase erhalten möchten. Die Indikation für TMT sollte bei lokalisierten Tumoren (T2–T3) ohne Lymphknotenbeteiligung (N0) und ohne Fernmetastasen (M0) geprüft werden. Ein entscheidender Faktor für den Erfolg der TMT ist die Vollständigkeit der TUR-B, da verbleibendes Tumorgewebe das Risiko für ein Rezidiv erhöht.
Während die radikale Zystektomie eine dauerhafte Harnableitung erforderlich macht, die mit einer signifikanten Veränderung der Lebensqualität verbunden sein kann, ermöglicht die TMT in vielen Fällen den Erhalt der Blasenfunktion. Allerdings ist die TMT mit einer intensiveren Nachsorge verbunden, die regelmäßige Zystoskopien und Bildgebungen einschließt, um lokale Rezidive frühzeitig zu erkennen.
Die 5-Jahres-Überlebensraten nach Zystektomie allein liegen nur bei etwa 60 % [17]. Aus diesem Grund sollte geeigneten Patientinnen und Patienten eine perioperative Cisplatin-haltige Chemotherapie angeboten werden. Diese kann sowohl neoadjuvant als auch adjuvant verabreicht werden [3].
Die Radiochemotherapie (RCT) ist der zweite Schritt der trimodalen Therapie und dient der Eradikation von mikroskopischen Tumorresten. Sie wird in der Regel als externe Strahlentherapie mit einer Gesamtdosis von 64–70 Gray durchgeführt. Die Chemotherapie wird simultan zur Strahlentherapie verabreicht und dient der Radiosensibilisierung der Tumorzellen. Die Wahl des Schemas hängt von den individuellen Gegebenheiten des Patienten ab.
Neoadjuvante Therapie
Die Neoadjuvante Chemotherapie (NAC) gilt als Standard in der Behandlung des MIBC, insbesondere bei Patienten im Stadium T2–T4a N0 M0. Sie wird vor der radikalen Zystektomie eingesetzt und zielt darauf ab, den Tumor zu verkleinern (Downstaging), Mikrometastasen zu eliminieren und die Überlebensrate zu verbessern.
Es gibt keine Studien, die eine neoadjuvante und adjuvante Therapie direkt verglichen haben oder gerade vergleichen. Die aktuelle Leitlinie von 2025 [3] gibt dazu folgende Empfehlungen (9.1–9.3, Level EK, starker Konsens):
9.1
Patienten mit muskelinvasivem Harnblasenkarzinom (≥T2) sollen über die Möglichkeiten, Chancen und Risiken einer neoadjuvanten und / oder adjuvanten Systemtherapie unter Berücksichtigung ihrer individuellen Situation aufgeklärt werden.
9.2
Bei Patienten mit muskelinvasivem Harnblasenkarzinom (≥T2) soll das Therapiekonzept multidisziplinär in einer Tumorkonferenz vor Therapiebeginn festgelegt werden.
9.3
Bei folgenden Patienten soll nach radikaler Zystektomie das weitere postoperative Therapiekonzept multidisziplinär in einer Tumorkonferenz festgelegt werden:
- ≥pT3a und/oder pN+ und/oder R1 nach alleiniger radikaler Zystektomie,
- ≥ypT2 und/oder ypN+ und/oder R1 nach radikaler Zystektomie mit vorangegangener Chemotherapie.
Die Entscheidung für eine perioperative Systemtherapie ist wesentlich von individuellen Patientenfaktoren (z. B. Allgemeinzustand, Komorbiditäten, klinischer Verlauf der Tumorerkrankung,
etc.) sowie den Vortherapien abhängig [3, 18, 19].
Der Nutzen einer neoadjuvanten Chemotherapie vor Zystektomie zur Behandlung des muskelinvasiven Blasenkarzinoms ist seit Langem nachgewiesen und für die Patientinnen und Patienten mit einem Überlebensvorteil nach 5 Jahren von bis zu 8 % gegenüber der alleinigen Zystektomie verbunden [18, 19]. Aus diesem Grund empfehlen sowohl die ESMO- als auch die EAU-Leitlinie die neoadjuvante Chemotherapie mit Cisplatin allen dafür infrage kommenden Patientinnen und Patienten anzubieten [20, 21].
Laut Leitlinie [3] soll eine Bestimmung prädiktiver Marker zur Beurteilung der Wirksamkeit einer adjuvanten oder neoadjuvanten Chemotherapie in der klinischen Routine nicht durchgeführt werden.
Hintergrund: Zum aktuellen Zeitpunkt können keine klinischen oder molekularen Marker identifiziert werden, die es im klinischen Alltag zuverlässig ermöglichen, diejenigen Patienten zu ermitteln, die von einer neoadjuvanten oder adjuvanten Chemotherapie profitieren. Ebenso stehen keine entsprechenden Marker zur Verfügung, die ein Versagen einer neoadjuvanten oder adjuvanten Chemotherapie mit ausreichender Sicherheit vorhersagen.
Laut Leitlinie soll Patienten mit einem lokalisierten muskelinvasiven Harnblasenkarzinom (T2–T4a N0 M0), die für eine Cisplatin-basierte Chemotherapie geeignet sind, eine neoadjuvante Cisplatin-basierte Kombinationstherapie angeboten werden und sollen 3–4 Zyklen einer Cisplatin-haltigen Kombinationschemotherapie beinhalten. Bei geeigneten Patienten kann eine Chemotherapie mit sechs Zyklen ddMVAC durchgeführt werden, wobei dies in Deutschland sehr selten durchgeführt wird und die Gemcitabin/Cisplatin Kombinationstherapie den Standard darstellt [3].
Die Wahl des chemotherapeutischen Regimes hängt von verschiedenen Faktoren ab, einschließlich der Nierenfunktion des Patienten, des allgemeinen Gesundheitszustands und der spezifischen Tumoreigenschaften. Die gängigsten Regime sind [3]:
- GC (Gemcitabin, Cisplatin): Das GC-Regime hat in den letzten Jahren an Popularität gewonnen, da es eine ähnliche Wirksamkeit wie MVAC bei besserer Verträglichkeit zeigt. Es wird in einem 4-wöchigen Zyklus verabreicht und ist mit weniger Nebenwirkungen verbunden, insbesondere in Bezug auf Übelkeit, Haarausfall und myelosuppressive Effekte im Vergleich zur MVAC Therapie, welche weltweilt relativ häufig durchgeführt wird.
- MVAC (Methotrexat, Vinblastin, Doxorubicin, Cisplatin): Dieses Regime ist seit langem etabliert und zeigt eine hohe Wirksamkeit, jedoch auch eine hohe Toxizität. Es wird in Dosen verabreicht, die in einem Abstand von 28 Tagen wiederholt werden, und erfordert eine sorgfältige Überwachung der Patienten, insbesondere in Bezug auf die Nierenfunktion und hämatologische Nebenwirkungen.
- dd-MVAC (dose-dense MVAC): Dieses intensivere Regime wird in kürzeren Abständen (alle 2 Wochen) verabreicht und hat in Studien eine Verbesserung des progressionsfreien Überlebens gezeigt, jedoch auf Kosten einer erhöhten Toxizität. Die Dosisanpassung und die präventive Gabe von Wachstumsfaktoren (G-CSF) sind notwendig, um die myelotoxischen Effekte zu kontrollieren.
Der Stellenwert einer neoadjuvanten Immuntherapie (Mono- und Kombinationstherapie) ist beim lokalisierten muskelinvasiven Harnblasenkarzinom aufgrund fehlender Ergebnisse randomisierter Studien unklar. Daten für den Einsatz einer neoadjuvanten Immuntherapie liegen aus mehreren Phase-II-Studien vor [22–28].
Hier wurden, bei jeweils kleiner Fallzahl, pathologische Remissionsdaten beobachtet, die durchaus mit den Ergebnissen einer neoadjuvanten Cisplatin-basierten Chemotherapie vergleichbar sind. Sollten sich diese Daten in weiteren größeren Phase-II- bzw. Phase-III-Studien bestätigen, wäre der Einsatz einer neoadjuvanten Immuntherapie eine Option für Cisplatin-ungeeignete Patienten mit einem muskelinvasiven Harnblasenkarzinom. Da bisher keine Zulassung für eine neoadjuvante Immuntherapie vorliegt, muss eine Kostenübernahme bei den Krankenkassen angefragt werden [3].
Auf dem ESMO-Kongress 2024 wurden die Ergebnisse einer vorab geplanten Zwischenanalyse der Phase-III-Studie NIAGARA vorgestellt. Hier führte die Zugabe von Durvalumab zur neoadjuvanten Chemotherapie vor der radikalen Zystektomie und die Durvalumab-Monotherapie nach der Operation zu signifikanten und klinisch bedeutsamen Verbesserungen des ereignisfreien Überlebens (EFS) und des Gesamtüberlebens (OS) im Vergleich zur alleinigen NAC. Während das Update der EAU-Leitlinie hier bereits eine Empfehlung ausspricht, verweist die deutsche Leitlinie auf weitere Untersuchungen in klinischen Studien. Wichtig ist, dass die Zugabe von neoadjuvantem Durvalumab die Möglichkeit, eine radikale Zystektomie durchzuführen, nicht beeinträchtigte [29].
Mit der Option einer Immuncheckpoint-Inhibitortherapie bzw. der Kombinationstherapie mit einer Polychemotherapie stellt sich aktuell erstmalig die Frage, ob es auch in diesem Kontext der perioperativen Immuntherapie prädiktive Faktoren gibt. Neben der PD-L1-Expression werden viele weitere explorative Marker wie die Tumor-Mutationslast (tumor mutational burden, TMB) sowie die molekularen Subtypen als mögliche prädiktive Faktoren untersucht.
Patienten-Selektion für neoadjuvante Therapie
Die Auswahl der Patienten für die NAC erfordert eine sorgfältige Beurteilung. Nicht alle Patienten sind für eine Cisplatin-basierte Therapie geeignet. Kriterien für die Selektion sind:
- Nierenfunktion: Eine ausreichende Nierenfunktion ist entscheidend, da Cisplatin nephrotoxisch ist. Alternativ können für Patienten mit eingeschränkter Nierenfunktion nicht-Cisplatin-basierte Regime oder Dosisreduktionen in Betracht gezogen werden.
- Komorbiditäten: Patienten mit schweren Begleiterkrankungen, wie z. B. Herzinsuffizienz oder fortgeschrittener COPD, haben ein erhöhtes Risiko für Chemotherapie assoziierte Komplikationen. In solchen Fällen kann der Verzicht auf NAC oder der Einsatz von weniger toxischen Regimen erwogen werden.
- Performance-Status: Der allgemeine Gesundheitszustand des Patienten, gemessen durch den ECOG-Status, ist ein wichtiger Faktor bei der Entscheidung über die Durchführung einer NAC. Patienten mit einem ECOG-Status von 3 oder höher haben oft nicht die körperliche Reserve, um eine aggressive Chemotherapie zu tolerieren.
Für die Eignung der Patienten können wie beim metastasierten Urothelkarzinom die Galsky-Kriterien herangezogen werden [30]:
- Kreatinin-Clearance ≥ 60 ml/min
- ECOG-Performance-Status von 0–1
- keine signifikante Schwerhörigkeit
- keine signifikante periphere Neuropathie (Grad 2 oder höher)
- keine Herzinsuffizienz (NYHA Klasse III–IV)
Adjuvante Therapie
Die adjuvante Chemotherapie wird nach der radikalen Zystektomie bei Patienten angewendet, die ein hohes Risiko für ein Rezidiv haben, insbesondere bei Vorliegen von positiven Lymphknoten (N+), mikroskopisch unvollständiger Resektion (R1/R2) oder aggressiven Tumorcharakteristika (hohes Grading, Lymphgefäßinvasion). Die Evidenz für die adjuvante Chemotherapie ist weniger robust als für die NAC, jedoch zeigen einige Studien, dass sie das rezidivfreie und das Gesamtüberleben bei Hochrisikopatienten verbessern kann und es besteht eine lange Erfahrung, d.h. „real-world evidence“ für dieses Vorgehen. Es wird jedoch mittlerweile allgemein anerkannt, dass die NAC eine bessere Evidenzbasis hat und bevorzugt eingesetzt werden sollte, wenn möglich. Die in der adjuvanten Chemotherapie verwendeten Regime sind denen der neoadjuvanten Therapie sehr ähnlich (MVAC und GC).
Die adjuvante Chemotherapie sollte so bald wie möglich nach der Operation beginnen, typischerweise innerhalb von 6–8 Wochen, sobald der Patient sich ausreichend erholt hat und die Therapiefähigkeit gegeben ist. Eine Verzögerung der Chemotherapie kann das Risiko eines Tumorrezidivs erhöhen und die Wirksamkeit der Therapie somit verringern.
Zur Bedeutung einer adjuvanten Immuntherapie nach radikaler Zystektomie liegen aktuell Daten zweier randomisierter Phase-III-Studien vor [31, 32]. Nivolumab ist die einzige zugelassene Substanz in diesem Setting. Zur adjuvanten Immuntherapie gibt die Leitlinie die Empfehlungen 9.13 (Empfehlungsgrad A, Evidenzlevel 1-) und 9.14 (Level EK, Konsens):
9.13
Patienten mit einem muskelinvasiven Harnblasenkarzinom soll nach radikaler Zystektomie eine adjuvante Therapie mit Nivolumab angeboten werden, wenn die Tumorzellen eine PD-L1 Expression ≥ 1 % (TPS) aufweisen und
- wenn bei Patienten mit neoadjuvanter Cisplatin-basierter Chemotherapie ein residueller Tumor mit dem Tumorstadium ypT2–pT4 und / oder ypN1–3 cM0 vorliegt
- wenn bei Patienten ohne neoadjuvante Chemotherapie ein residueller Tumor mit dem Tumorstadium pT3–pT4 und/oder pN1–3 cM0 vorliegt und diese Patienten nicht für eine Cisplatin-basierte adjuvante Therapie geeignet sind.
9.14
Patienten mit einem muskelinvasiven Harnblasenkarzinom sollte nach radikaler Zystektomie eine adjuvante Therapie mit Nivolumab angeboten werden, wenn die Tumorzellen eine PD-L1 Expression ≥ 1% (TPS) aufweisen, ohne neoadjuvante Chemotherapie ein Blasentumor mit dem Tumorstadium pT3-pT4 und/oder pN1-3 cM0 vorliegt und trotz Eignung eine Cisplatin-basierte adjuvante Therapie abgelehnt wird.
Dabei ist die Bestimmung des PD-L1-Scores ist somit bei der Selektion der Patienten für eine adjuvante Therapie mit Nivolumab obligatorisch. Auch in der Erstlinientherapie des metastasierten Urothelkarzinoms bei nicht-chemofähigen Patientinnen und Patientin ist eine Bestimmung des PD-L1 Status obligatorisch, wobei verschiedene Scores für die verschiedenen Substanzen notwendig sind. Die Vorhersage eines Therapieansprechens bleibt allerdings weiterhin schwierig, zwar korreliert eine PD-L1-Expression mit höheren Ansprechraten, jedoch spricht auch ein großer Teil der Patienten mit einer hohen PD-L1-Expression nicht auf eine Immuntherapie an. Andererseits können Patienten mit einem PD-L1-negativ getesteten Tumor teilweise auch von einer Immuntherapie profitieren [4].
Die Überwachung von Patienten auf zirkulierende Tumor-DNA (ctDNA) ist ein minimalinvasiver Ansatz, der für eine Auswahl von Patienten attraktiv erscheint, die potenziell für eine adjuvante Behandlung mit Checkpoint-Inhibitoren geeignet sind. IMvigor011 (NCT04660344) ist eine globale, doppelblinde, randomisierte Phase-III-Studie zur Bewertung der Wirksamkeit von Atezolizumab (Anti-PD-L1) im Vergleich zu Placebo bei Patienten mit muskelinvasivem Blasenkrebs mit hohem Risiko, die nach einer Zystektomie ctDNA-positiv sind. Der primäre Endpunkt ist das krankheitsfreie Überleben bei Teilnehmern, die innerhalb von 20 Wochen nach der Zystektomie ctDNA-positiv sind [33].
Diskrepanz zwischen Leitlinienempfehlung und klinischer Praxis
Trotz der starken Evidenz für eine neoadjuvante Therapie scheint die Leitlinienempfehlung noch nicht flächendeckend umgesetzt zu werden. Um der Frage nachzugehen, warum die neoadjuvante Therapie beim Harnblasenkarzinom noch nicht flächendeckend durchgeführt wird, wurde 2023 eine Befragung von 336 urologischen Kliniken im DACH-Raum durchgeführt [34].
Mehr als 70 % der Kliniken gaben an, eine neoadjuvante Chemotherapie als Standard-of-Care durchzuführen – trotzdem lag der mittlere Anteil an Patienten, die eine neoadjuvante Therapie erhielten, nur bei knapp 50 % [34]. Ein häufig genannter Grund für den Verzicht auf eine neoadjuvante Therapie war in der Studie des BRIDGE-Konsortiums eine Präferenz für die adjuvante Therapie.
Die Ergebnisse der Checkmate-274-Studie könnten indirekt einen Hinweis darauf geben, wie sich die Therapie in Zukunft verändern wird – hier zeigte sich der DFS-Vorteil der adjuvanten Immuntherapie gegenüber Placebo besonders deutlich bei Patienten, die vor der Zystektomie bereits eine neoadjuvante Therapie mit Cisplatin erhalten hatten [29]. Derzeit laufen mehrere Studien zu diesem Thema, sodass eine Beantwortung dieser Frage möglicherweise in naher Zukunft zu erwarten ist. Dieser Zusammenhang legt aber einen möglichen Synergismus zwischen neoadjuvanter Chemotherapie sowie adjuvanter Immuntherapie nahe. Der aktuelle Stand zur perioperativen Systemtherapie beim muskelinvasiven Harnblasenkarzinom in Abhängigkeit von der Vortherapie, der Cisplatineignung und des PDL1 kann wie folgt zusammengefasst werden (Abb. 3) [35, 36].
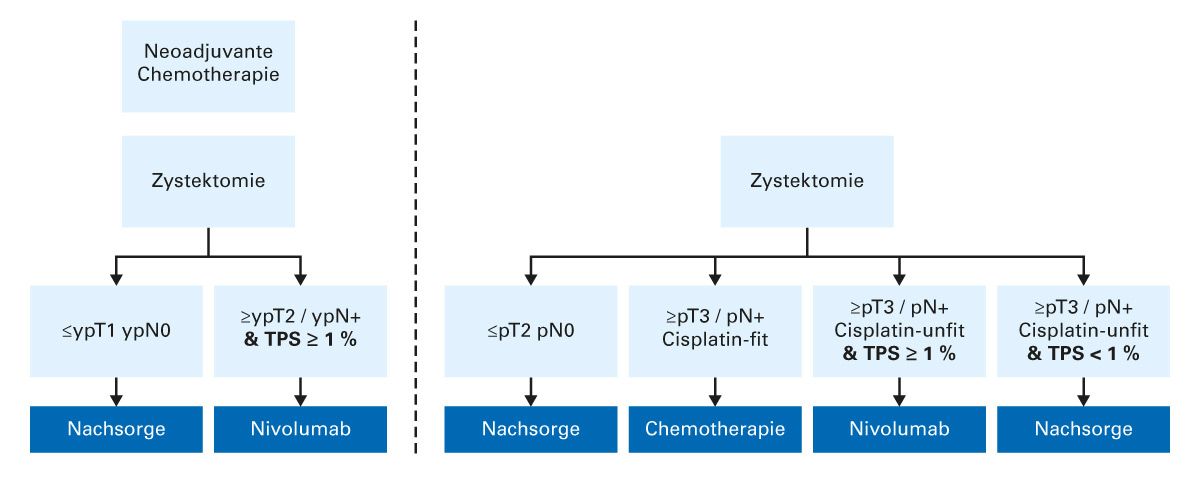
Abb. 3: Schematische Übersicht der aktuellen Empfehlung zur perioperativen Systemtherapie beim muskelinvasiven Harnblasenkarzinom in Abhängigkeit von der Vortherapie, der Cisplatineignung und des PD-L1 [35, 36].
Nachsorge und Monitoring
Nach der primären Therapie von MIBC ist eine sorgfältige und regelmäßige Nachsorge unerlässlich, um Rezidive frühzeitig zu erkennen und zu behandeln sowie mögliche Langzeitkomplikationen zu überwachen. CT- oder MRT-Scans sollten regelmäßig durchgeführt werden, um das Vorhandensein von Rezidiven oder Metastasen zu überwachen. Typischerweise wird in den ersten 2 Jahren nach der Therapie alle 3–6 Monate eine Bildgebung durchgeführt, danach zumindest jährlich. Für Patienten, die eine trimodale Therapie erhalten haben und deren Blase erhalten wurde, ist eine regelmäßige Zystoskopie essenziell. Diese wird alle 3–6 Monate im ersten Jahr und dann jährlich durchgeführt. Während spezifische Tumormarker für MIBC nicht etabliert sind, können allgemeine Marker wie LDH, CEA oder CA 19-9 im Verlauf der Nachsorge überwacht werden, um Anzeichen für eine Tumorprogression zu erkennen. Patienten, die eine radikale Zystektomie mit Harnableitung erhalten haben, benötigen regelmäßige Überwachung und Unterstützung, um mit den Veränderungen in ihrem Leben umzugehen, einschließlich Inkontinenz, sexueller Dysfunktion und psychosozialen Problemen. Die Einbindung von Rehabilitationsdiensten und psychosozialer Betreuung ist entscheidend, um die Lebensqualität der Patienten zu verbessern.
Ausblick
Die Forschung zur Behandlung von MIBC befindet sich in einem dynamischen Wandel. Zahlreiche klinische Studien untersuchen neue Therapieansätze, die das Potenzial haben, die derzeitigen Standardbehandlungen zu revolutionieren. Die Kombination von Chemotherapie mit Immuncheckpoint-Inhibitoren wird in mehreren klinischen Studien untersucht. Diese Kombinationen zielen darauf ab, die Effektivität der Chemotherapie zu verstärken, indem das Immunsystem aktiviert wird, um verbliebene Tumorzellen nach der Chemotherapie zu zerstören. Erste Ergebnisse zeigen vielversprechende Raten für das progressionsfreie Überleben und die Gesamtüberlebensrate.
Antikörper-Wirkstoff-Konjugate (ADC) haben in der Behandlung des fortgeschrittenen oder metastasierten MIBC signifikante Aktivität gezeigt. Diese Therapien kombinieren die Präzision von Antikörpern mit der Zytotoxizität von Chemotherapeutika und haben in Studien eine hohe Ansprechrate gezeigt, selbst bei Patienten, die auf andere Therapien refraktär waren.
Die EV-302 Studie [37] hat die Therapie des metastasierten Blasenkarzinoms revolutioniert und somit die Therapielandschaft komplett neu definiert. In dieser globalen randomisierten Phase-III-Studie erhielten therapienaive Patienten das ADC Enfortumab-Vedotin (EV) + Pembrolizumab (P) oder platin-basierte Chemotherapie. Es zeigt sich ein nahezu verdoppeltes mOS und mPFS vs. SOC. Das Nebenwirkungsprofil wurde als charakterisiert. Das Regime kann bei allen Subgruppen sowie ohne vorherige Biomarkertestung eingesetzt werden.
Die neoadjuvante Immuntherapie zeigt hohe Raten an pathologischen Komplettremissionen, was darauf hindeutet, dass einige Patienten möglicherweise von einer weniger invasiven Therapie profitieren könnten. Einige dieser Studien sind bereits weit fortgeschritten, sodass in den nächsten Jahren hier mit größeren Änderungen zu rechnen ist.
In einer geplanten Zwischenauswertung der NIAGARA-Studie, welche rezent auf dem ESMO Kongress 2024 vorgestellt werden konnte, wurden ca. 1000 Patienten mit lokal begrenztem metastasierendem Blasenkrebs untersucht. Die Patienten wurden für eine neoadjuvante Behandlung mit Durvalumab plus NAC (Cisplatin plus Gemcitabin), gefolgt von einer radikalen Zystektomie und anschließender adjuvanter Durvalumab-Monotherapie randomisiert oder für NAC, gefolgt von einer alleinigen radikalen Zystektomie. Im Vergleich zu NAC plus Operation war das EFS (primärer Endpunkt) im Durvalumab-Arm signifikant länger (Hazard Ratio [HR] 0,68; 95 %-KI] 0,56–0,82; p<0,0001), ebenso wie das OS (HR 0,75; 95 % KI 0,59–0,93; p=0,0106) [29].
Bei intensiver Therapie im perioperativen Setting und frühem Einsatz der ADC bei metastasiertem Urothelkarzinom wird es in Zukunft notwendig sein neue zielgerichtete Therapie zu evaluieren. Hier könnten neben zielgerichteten Therapeutika wie Erdafitinib [38] auch ADCs mit weiteren Targets neben NECTIN-4 eine Rolle spielen [39]. Die adoptive Zelltherapie, welche bei nicht-soliden malignen Erkrankungen immer präsenter wird, liegt dagegen noch in weiterer Ferne. Diese Ansätze, bei denen patientenspezifische T-Zellen modifiziert und vermehrt werden, um gezielt Tumorzellen zu bekämpfen, befinden sich noch in den frühen Phasen der klinischen Erprobung. Ihre Anwendung könnte jedoch insbesondere bei refraktären Tumoren, die nicht auf herkömmliche Therapien ansprechen, bedeutende Fortschritte bringen.
Ist die Zystektomie langfristig verzichtbar?
Eine der größten Herausforderungen und gleichzeitig eine der spannendsten Perspektiven in der Behandlung von MIBC ist die Frage, ob die radikale Zystektomie langfristig durch weniger invasive Ansätze ersetzt werden kann. Mit dem Fortschritt der TMT und der Weiterentwicklung von Immuntherapien und zielgerichteten Therapien wird die Möglichkeit eines organerhaltenden Managements bei MIBC zunehmend realistisch. Allerdings sollte man extreme Therapieintensivierung vor der Zystektomie auch kritisch hinterfragen.
Beim lokalisierten Tumor ist die Zystektomie eine äußerst effektive Therapie – allerdings ist es ein großer Eingriff mit hohen Komplikationsraten und Einschränkungen bei der Lebensqualität wie Inkontinenz oder Impotenz. Auch eine orthotope Neoblase ist kein Wundermittel.
Während die Zystektomie derzeit noch als die sicherste Methode zur vollständigen Entfernung des Tumors gilt, könnten zukünftige Studien zeigen, dass eine Kombination aus TMT und modernen systemischen Therapien (wie Immuntherapien und zielgerichteten Therapien) ähnliche oder sogar bessere langfristige Ergebnisse liefern können, insbesondere in Bezug auf die Lebensqualität.
Es wird jedoch entscheidend bleiben, die richtigen Patienten für diese weniger invasiven Ansätze auszuwählen. Nicht alle Patienten sind Kandidaten für eine organerhaltende Therapie, und die Entscheidung muss auf einer sorgfältigen Abwägung von Tumorbiologie, Patientenpräferenzen und verfügbaren Behandlungsoptionen basieren.
Insgesamt zeigt sich ein Trend, dass verschiedene medikamentöse Therapieoptionen zunächst in der metastasierten Situation untersucht werden bzw. hiernach im perioperativen Setting zum Einsatz kommen könnten bzw. auch beim Hochrisisko NMIBC zu einer Reduktion des Kollektivs führen könnten, das eine Notwendigkeit einer Zystektomie aufweist.
Fazit
Die Behandlung des muskelinvasiven Blasenkarzinoms (MIBC) hat sich durch die Kombination klassischer Chemotherapie und Immuntherapie substanziell weiterentwickelt. Die radikale Zystektomie bleibt weiterhin der Goldstandard mit besten Überlebenschancen für viele Patientengruppen. Für Patienten, die eine weniger invasive Methode bevorzugen oder für die eine Zystektomie nicht infrage kommt, bietet die trimodale Therapie (TMT) eine vergleichbare Überlebensrate unter strenger Patientenselektion und regelmäßiger Nachsorge.
Die Einführung von Immuncheckpoint-Inhibitoren und die mögliche künftige Anwendung von Biomarkern zur patientenindividuellen Therapieanpassung versprechen eine weitere Verbesserung der Therapieergebnisse und könnten langfristig die Notwendigkeit von Zystektomien reduzieren. Kombinationstherapien, welche das Immunsystem gezielt aktivieren, sowie Antikörper-Wirkstoff-Konjugate zeigen bereits in klinischen Studien vielversprechende Resultate und könnten das Spektrum der verfügbaren Therapien erweitern.
Referenzen
- RKI (Hrsg.) Krebs in Deutschland 2019/2020. Im Internet. Kap 3.25 Harnblase. https://www.krebsdaten.de/Krebs/DE/Content/Publikationen/Krebs_in_Deutschland/kid_2023/kid_2023_c67_harnblase.pdf abgerufen am 15.04.2025
- Jansen L, Feller A. Epidemiologie von Harnblasentumoren in Deutschland. Onkologie 2022; 28: 737–741
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. Version 3.0 – März 2025 AWMF-Registernummer: 032-038OL
- Rüschoff JH, Moch H. Molekularpathologische Diagnostik des Harnblasenkarzinoms – prädiktive und prognostische Marker. Onkologie 2022; 28: 742–752
- Knowles MA, Hurst CD. Molecular biology of bladder cancer: new insights into pathogenesis andclinicaldiversity. Nat Rev Cancer 2015; 15: 25–41
- Lopez-Beltran A et al. Molecular pathology of urothelial carcinoma. Hum Pathol 2021;113: 67–83
- Moch HH. WHO Classification of Tumours of the Urinary System and Male Genital Organs. WHO OMS. 2016; 4
- Van Der Molen AJ, Cowan NC, Mueller-Lisse UG, Nolte-Ernsting CC, Takahashi S, Cohan RH, et al. CT urography: definition, indications and techniques A guideline for clinical practice. Eur Radiol 2008; 18: 4-17
- Dighe MK, Bhargava P, Wright J. Urinary bladder masses: techniques, imaging spectrum, and staging. J Comput Assist Tomogr 2011; 35: 411-24
- Lu YY, Chen JH, Liang JA, Wang HY, Lin CC, Lin WY, et al. Clinical value of FDG PET or PET/CT in urinary bladder cancer: a systemic review and meta-analysis. Eur J Radiol 2012; 81: 2411-6
- Jocham D, Stepp H, Waidelich R. Photodynamic diagnosis in urology: state-of-the-art. Eur Urol 2008; 53: 1138-48
- Babjuk M et al. EAU Guidelines on Non-Muscle-invasive Bladder Cancer (TaT1 and CIS) – 2019 Update. Eur Urol 2019; 76: 639-657
- Shariat SF et al. Outcomes of radical cystectomy for transitional cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol 2006; 176: 2414-22
- Hautmann RE, de Petriconi RC, Pfeiffer C, Volkmer BG. Radical cystectomy for urothelial carcinoma of the bladder without neoadjuvant or adjuvant therapy: long-term results in 1100 patients. Eur Urol 2012; 61: 1039-47
- Chen RC et al. Trimodality bladder preservation therapy for muscle-invasive bladder cancer. J Natl Compr Canc Netw 2013; 11: 952-60
- Rodel C, Weiss C, Sauer R. Trimodality treatment and selective organ preservation for bladder cancer. J Clin Oncol 2006; 24: 5536-44
- Advanced Bladder Cancer (ABC) Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: update of a systematic review and meta-analysis of individual patient data advanced bladder cancer (ABC) metaanalysis collaboration. Eur Urol 2005; 48: 202-5
- Advanced Bladder Cancer Meta-analysis Collaboration. Neoadjuvant chemotherapy in invasive bladder cancer: a systematic review and meta-analysis. Lancet 2003; 361:1927-34
- Yin M et al. Neoadjuvant Chemotherapy for Muscle-Invasive Bladder Cancer: A Systematic Review and Two-Step Meta-Analysis. Oncologist 2016; 21: 708-15
- EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2023. ISBN 978-94-92671-19-6.
- Powles T et al. Bladder cancer: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals Oncol 2022; 33: 244-258
- Powles T et al. Clinical efficacy and biomarker analysis of neoadjuvant atezolizumab in operable urothelial carcinoma in the ABACUS trial. Nat Med 2019; 25: 1706-1714
- Szabados B et al. Toxicity and Surgical Complication Rates of Neoadjuvant Atezolizumab in Patients with Muscleinvasive Bladder Cancer Undergoing Radical Cystectomy: Updated Safety Results from the ABACUS Trial. Eur Urol Oncol 2021; 4: 456-463
- Necchi A et al. Pembrolizumab as Neoadjuvant Therapy Before Radical Cystectomy in Patients With Muscle-Invasive Urothelial Bladder Carcinoma (PURE-01): An Open-Label, Single-Arm, Phase II Study. J Clin Oncol 2018; 36: 3353-3360
- Necchi A et al. Updated Results of PURE-01 with Preliminary Activity of Neoadjuvant Pembrolizumab in Patients with Muscle-invasive Bladder Carcinoma with Variant Histologies. Eur Urol 2020; 77: 439-446
- Powles T et al. MPDL3280A (anti-PD-L1) treatment leads to clinical activity in metastatic bladder cancer. Nature 2014; 515: 558-62
- van Dijk N et al. Preoperative ipilimumab plus nivolumab in locoregionally advanced urothelial cancer: the NABUCCO trial. Nat Med 2020; 26: 1839-1844
- van Dorp J et al. High- or low-dose preoperative ipilimumab plus nivolumab in stage III urothelial cancer: the phase 1B NABUCCO trial. Nat Med 2023; 29: 588-592
- Powles T et al. EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC) Ann Oncol 2023; 34 (suppl_2): S1254-S1335. LBA6
- Galsky MD et al. Treatment of patients with metastatic urothelial cancer „unfit“ for Cisplatin-based chemotherapy. J Clin Oncol 2011; 29: 2432-2438
- Bajorin D et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med 2021; 384:2102-2114
- Bellmunt J et al. Adjuvant atezolizumab versus observation in muscle-invasive urothelial carcinoma (IMvigor010): a multicentre, open-label, randomised, phase 3 trial. Lancet Oncol 2021; 22: 525-537
- Jackson-Spence F et al. IMvigor011: a study of adjuvant atezolizumab in patients with high-risk MIBC who are ctDNA+ post-surgery. Future Oncol 2023; 19: 509-515
- Reike, MJ et al. An empirical survey on the adaption of neoadjuvant chemotherapy in bladder cancer. Urol Int 2024 Urol Int 2024; 108: 183-189
- Aydogdu C et al. Neue Systemtherapie beim fortgeschrittenen Harnblasenkarzinom. Urologie 2024; DOI: 10.1007/s00120-024-02413-4
- Lewerich J et al. Value of immunotherapy in the perioperative treatment of localized muscle invasive bladder cancer. Urologie 2023; 62: 279–287
- Powles TB et al. A randomized phase 3 trial of neoadjuvant durvalumab plus chemotherapy followed by radical cystectomy and adjuvant durvalumab in muscle-invasive bladder cancer (NIAGARA). ESMO Congress 2024, LBA5
- Loriot Y et al. Erdafitinib or Chemotherapy in Advanced or Metastatic Urothelial Carcinoma. N Engl J Med 2023; 389:1961-1971
- Lu Z. BL-B01D1, an EGFR x HER3 bispecific antibody-drug conjugate (ADC), in patients with locally advanced or metastatic biliary tract carcinoma (BTC). Ann Oncol 2024 35 (suppl_2): S229-S237
Bildquellen
Titel: © Matthieu – stock.adobe.com

Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.