Neue Option für die medikamentöse Therapie beim muskelinvasiven Blasenkarzinom
Interessengebiete: Allgemeinmedizin und Innere Medizin, Chirurgie, Urologie, Onkologie
Das muskelinvasive Blasenkarzinom (MIBC) stellt aufgrund seiner Aggressivität und der hohen Morbidität und Mortalität eine erhebliche Herausforderung in der Uro-Onkologie dar. Trotz signifikanter Fortschritte in der Diagnostik und Therapie bleibt der Bedarf an neuen, wirksameren Behandlungsstrategien hoch.
Diese CME-Fortbildung beleuchtet die aktuellen Standards der perioperativen medikamentösen Therapie des MIBC und stellt eine neue, vielversprechende Option vor, die das Gesamtüberleben der Patient:innen signifikant verbessern kann. Diese Therapieoption war zum Zeitpunkt der Veröffentlichung der neuen Leitlinie im Frühjahr 2025 in Deutschland noch nicht zugelassen.
Zur Diagnostik und Therapie des MIBC gemäß Leitlinie existiert ein eigenes CME-Modul Perioperative medikamentöse Therapie des muskelinvasiven Blasenkarzinoms.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Das muskelinvasive Blasenkarzinom (MIBC) stellt aufgrund seiner Aggressivität und der hohen Morbidität und Mortalität eine erhebliche Herausforderung in der Uro-Onkologie dar. Trotz signifikanter Fortschritte in der Diagnostik und Therapie bleibt der Bedarf an neuen, wirksameren Behandlungsstrategien hoch.
Diese CME-Fortbildung beleuchtet die aktuellen Standards der perioperativen medikamentösen Therapie des MIBC und stellt eine neue, vielversprechende Option vor, die das Gesamtüberleben der Patient:innen signifikant verbessern kann. Diese Therapieoption war zum Zeitpunkt der Veröffentlichung der neuen Leitlinie [1] im Frühjahr 2025 in Deutschland noch nicht zugelassen. Zur Diagnostik und Therapie des MIBC gemäß Leitlinie existiert ein eigenes CME-Modul [2].
Epidemiologie, Klassifikation und Diagnostik des MIBC
Harnblasenkarzinome gehören zu den häufigsten Krebsarten. Etwa 70–80 % der Blasenkarzinomfälle entfallen auf das nicht-muskelinvasive Blasenkarzinom (NMIBC), während bei etwa einem Viertel der Patient:innen ein MIBC diagnostiziert wird [1]. Nur bei einem geringen Anteil, etwa 5 %, der Patient:innen liegt bei Diagnosestellung bereits eine metastasierte Erkrankung vor. Es ist jedoch zu beachten, dass 10-20 % der NMIBC-Patient:innen im Verlauf eine muskelinvasive Erkrankung entwickeln können [1,3,4].
Die Klassifikation des MIBC erfolgt nach dem TNM-System (Tumor, Node, Metastasis) der Union for International Cancer Control (UICC) [5].
- T-Stadium (Tumor): Das T-Stadium beschreibt die Ausdehnung des Primärtumors. Ein T2-Tumor infiltriert die Muskelschicht der Blasenwand (Muscularis propria), während T3-Tumoren darüber hinaus in das perivesikale Gewebe eindringen. T4-Tumoren befallen angrenzende Organe wie die Prostata, die Gebärmutter oder die Vaginalwand.
- N-Stadium (Node): Das N-Stadium beschreibt den Befall der regionalen Lymphknoten. Ein N1-Tumor zeigt eine Metastase in einem einzelnen regionalen Lymphknoten, während N2 oder N3 mehre Lymphknoten im kleinen Becken bzw. einen höherliegende Lymphknotenbeteiligung kennzeichnen.
- M-Stadium (Metastasis): Das M-Stadium gibt das Vorhandensein von Fernmetastasen an. M1 bedeutet, dass Fernmetastasen in Organen bzw. in nicht-regionären Lymphknoten vorhanden sind, was die Prognose signifikant verschlechtert.
Zusätzlich zur TNM-Klassifikation ist das Tumorgrading ein weiterer wichtiger prognostischer Faktor. Das Grading erfolgt nach den Kriterien der Weltgesundheitsorganisation (WHO) 2022 [6] und unterteilt Urothelkarzinome in zwei Differenzierungsgrade:
- Low-Grade (niedriggradig entdifferenziert): Diese Tumoren zeigen nur geringe zytologische Atypien, wachsen meist langsam und sind mit einem geringeren Risiko für Progression und Metastasierung assoziiert.
- High-Grade (hochgradig entdifferenziert): Diese Tumoren weisen deutliche zelluläre Atypien, eine höhere mitotische Aktivität und ein erhöhtes Risiko für invasives Wachstum und Metastasierung auf. Sie gehen mit einer ungünstigeren Prognose einher.
Bei Tumoren mit gemischter Histologie wird ein Tumor ab einem Anteil von ≥ 5 % hochgradiger Anteile als High-Grade klassifiziert.
Die initiale Diagnostik des Harnblasenkarzinoms erfolgt meistens mittels transurethraler Resektion des Blasentumors (TUR-B) [1,7]. Dieses Verfahren ermöglicht nicht nur die Abtragung sichtbarer Tumoranteile, sondern liefert auch essenzielles Gewebe zur histopathologischen Beurteilung, insbesondere zur Bestimmung des Tumorstadiums (T-Stadium) und des Differenzierungsgrads (Grading).
Vor TUR‑B kann bei klinischen und sonographischen Verdacht auf ein MIBC ein multiparametrisches MRT (mpMRT) des Beckens inklusive MR‑Urographie eingesetzt werden. Dabei kommt die VI‑RADS‑Klassifikation (vesical imaging-reporting and data system) zur Anwendung, die mit hoher Sensitivität und Spezifität MIBC von NMIBC unterscheiden kann: So zeigt eine Meta-Analyse von 22 Studien mit insgesamt >2.500 Patient:innen eine hohe diagnostische Genauigkeit von VI-RADS [8].
Der optimale Cut-off zur Vorhersage eines MIBC liegt bei VI‑RADS ≥ 3, mit einer gepoolten Sensitivität von 89 % (95%-KI: 87–91 %) und Spezifität von 84 % (95%-KI: 80–87 %). Bei einem VI‑RADS‑Score ≥ 3–4 ist die Wahrscheinlichkeit für Muskelinfiltration groß. In solchen Fällen kann eine gezielte Blasenwandbiopsie (inkl. Detrusor) zur Diagnosesicherung erwogen werden – ohne vollständige und ausgedehnte Tumorresektion mittels TUR‑B.
Für die weitere Stadienabklärung und zum Nachweis/ Ausschluss von Fernmetastasen bei muskelinvasivem Harnblasenkarzinom (MIBC) wird eine Computertomographie (CT) mit Kontrastmittel des Abdomens und Beckens – idealerweise als CT-Urographie – sowie des Thorax empfohlen, um Fernmetastasen auszuschließen. Alternativ kann auch ein Magnetresonanztomographie (MRT) mit MR-Urographie durchgeführt werden.
Aktueller Therapiestandard beim MIBC
Die Therapie des MIBC erfordert einen komplexen, multidisziplinären Ansatz, der chirurgische, chemotherapeutische und immuntherapeutische Strategien umfasst. Die Auswahl der Therapie richtet sich nach dem Tumorstadium, dem Grading, dem Allgemeinzustand der Patienten und deren Präferenzen.
Die Neoadjuvante Chemotherapie (NAC) gilt als Standard in der Behandlung des MIBC, insbesondere bei Patienten im Stadium T2–T4a N0 M0. Sie wird vor der radikalen Zystektomie eingesetzt und zielt darauf ab, den Tumor zu verkleinern (Downstaging), Mikrometastasen zu eliminieren und die Überlebensrate zu verbessern.
Eine NAC auf Cisplatin-Basis (z. B. GemCis oder dd-MVAC) verbessert das Gesamtüberleben bei MIBC signifikant. Laut EAU-Leitlinie liegt der absolute Überlebensvorteil bei ca. 6–8 % nach 10 Jahren gegenüber der alleinigen Zystektomie
Es gibt keine Studien, die eine neoadjuvante und adjuvante Therapie direkt verglichen haben oder gerade vergleichen. Die aktuelle Leitlinie von 2025 [3] gibt dazu folgende Empfehlungen (9.1–9.3, Level EK, starker Konsens):
9.1 Patienten mit muskelinvasivem Harnblasenkarzinom (≥T2) sollen über die Möglichkeiten, Chancen und Risiken einer neoadjuvanten und / oder adjuvanten Systemtherapie unter Berücksichtigung ihrer individuellen Situation aufgeklärt werden.
9.2 Bei Patienten mit muskelinvasivem Harnblasenkarzinom (≥T2) soll das Therapie-konzept multidisziplinär in einer Tumorkonferenz vor Therapiebeginn festgelegt werden.
9.3 Bei folgenden Patienten soll nach radikaler Zystektomie das weitere postoperative Therapiekonzept multidisziplinär in einer Tumorkonferenz festgelegt werden:
- ≥pT3a und/oder pN+ und/oder R1 nach alleiniger radikaler Zystektomie,
- ≥ypT2 und/oder ypN+ und/oder R1 nach radikaler Zystektomie mit vo-rangegangener Chemotherapie.
Die Wahl des chemotherapeutischen Regimes bei MIBC richtet sich nach der Nierenfunktion, dem Allgemeinzustand der Patientin oder des Patienten. Ursprünglich galt das MVAC-Regime (Methotrexat, Vinblastin, Doxorubicin, Cisplatin) als Standard, da es eine hohe Wirksamkeit zeigte. Aufgrund seiner erheblichen Toxizität – insbesondere hämatologischer Nebenwirkungen – wurde später das dose-dense MVAC (dd‑MVAC) entwickelt, das in kürzeren Intervallen verabreicht wird und unter G-CSF-Prophylaxe eine verbesserte Wirksamkeit bei allerdings ebenfalls hoher Nebenwirkungsrate bietet. Als gleichwertige, aber besser verträgliche Alternative hat sich in den letzten Jahren das Gemcitabin-Cisplatin-Regime (GC) etabliert. Es weist eine vergleichbare onkologische Effektivität wie MVAC auf, geht jedoch mit einer deutlich geringeren Toxizität einher. In der klinischen Praxis – insbesondere im deutschsprachigen Raum – wird daher GC häufig als bevorzugte Option eingesetzt, insbesondere bei älteren oder vorerkrankten Patient:innen.
Trotz neoadjuvanter platinbasierter Chemotherapie mit radikaler Cystektomie ist das Gesamtüberleben bei dieser Patientengruppe nicht zufriedenstellend. Die Rezidivrate nach 5 Jahren liegt bei 48%, die der verstorbenen Patienten bei 43% [9] (Abb. 1).
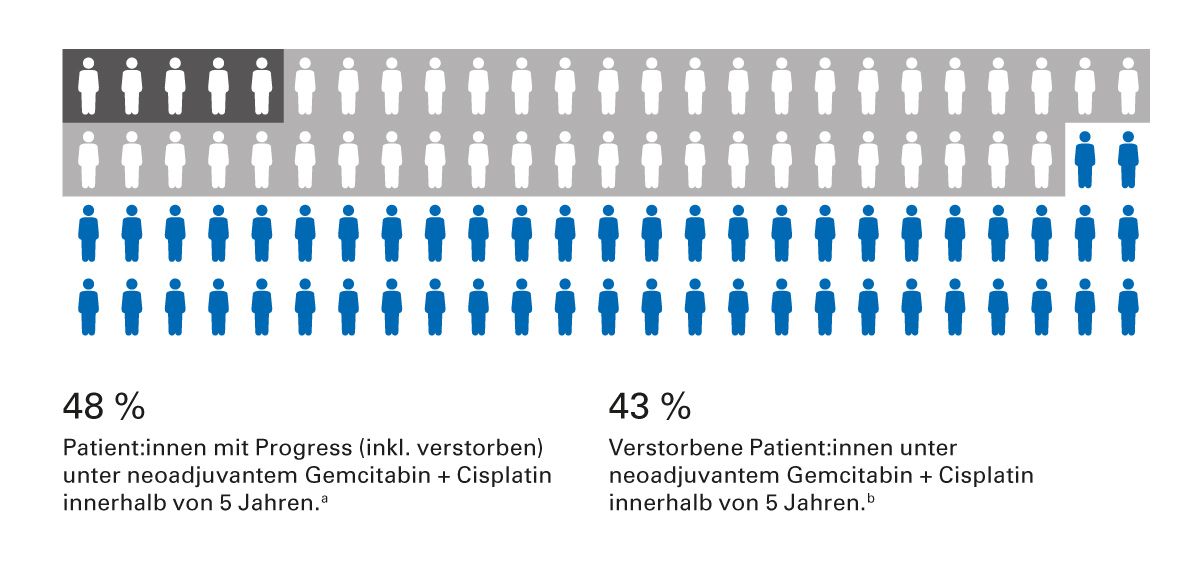
Abb. 1: Rezidivfreies Überleben und Gesamtüberleben bei MIBC-Patienten nach 5 Jahren [9]. a In einer exploratorischen Analyse nach 5 Jahren neoadjuvant ddMVAC oder Gemcitabin und Cisplatin, betrug das 5-Jahres-PFS 52 % im Gemcitabin-Cisplatin-Arm (HR = 0,74; 95 %-KI: 0,55–0,99). b In einer exploratorischen Analyse nach 5 Jahren neoadjuvant ddMVAC oder Gemcitabin und Cisplatin, betrug das 5-Jahres-OS 57 % im Gemcitabin-Cisplatin-Arm (HR = 0,71; 95 %-KI: 0,52–0,97).
Dies unterstreicht den erheblichen ungedeckten Bedarf an neuen, wirksameren perioperativen Therapien zur Verbesserung der Langzeitergebnisse bei MIBC-Patienten. Die adjuvante Immuntherapie entwickelt sich zu einem wichtigen Bestandteil des Therapiestandards (SoC) bei Hochrisiko-Patienten.
Die CheckMate 274-Studie war eine randomisierte, doppelblinde, multizentrische Phase-III-Studie, die adjuvantes Nivolumab im Vergleich zu Placebo bei Patienten mit Hochrisiko-MIBC nach chirurgischer Tumorentfernung untersuchte [10]. Die Ergebnisse zeigten, dass eine Nivolumab-Monotherapie das krankheitsfreie Überleben (DFS) signifikant verlängerte.
Besonders deutlich fiel der Nutzen in der PD-L1-TPS-positiven Subgruppe (≥ 1 %) aus: Hier zeigte sich nicht nur ein signifikanter Vorteil beim DFS, sondern auch ein klarer Overall-Survival-(OS)-Benefit. Drei Jahre nach Therapiebeginn lebten 71,3 % der mit Nivolumab behandelten Patient:innen im Vergleich zu 56,6 % im Placeboarm, was einem absoluten OS-Vorteil von rund 15 % entspricht. Die Hazard Ratio lag bei 0,56, was einer 44 %igen Reduktion des Sterberisikos in dieser Subgruppe entspricht [10].
Diese Ergebnisse unterstreichen die Relevanz der adjuvanten Immuntherapie mit Nivolumab insbesondere für Patient:innen mit PD-L1-positiven Tumoren nach radikaler Zystektomie bei Hochrisiko-MIBC.
Die Leitlinien geben dazu die Empfehlungen 9.13 (Empfehlungsgrad A, Evidenzlevel 1-) und 9.14 (Level EK, Konsens)
9.13
Patienten mit einem muskelinvasiven Harnblasenkarzinom soll nach radikaler Zystektomie eine adjuvante Therapie mit Nivolumab angeboten werden, wenn die Tumorzellen eine PD-L1 Expression ≥ 1 % (TPS) aufweisen und
- wenn bei Patienten mit neoadjuvanter Cisplatin-basierter Chemotherapie ein residueller Tumor mit dem Tumorstadium ypT2–pT4 und / oder ypN1–3 cM0 vorliegt
- wenn bei Patienten ohne neoadjuvante Chemotherapie ein residueller Tumor mit dem Tumorstadium pT3–pT4 und/oder pN1–3 cM0 vorliegt und diese Patienten nicht für eine Cisplatin-basierte adjuvante Therapie geeignet sind.
9.14
Patienten mit einem muskelinvasiven Harnblasenkarzinom sollte nach radikaler Zystektomie eine adjuvante Therapie mit Nivolumab angeboten werden, wenn die Tumorzellen eine PD-L1 Expression ≥ 1% (TPS) aufweisen, ohne neoadjuvante Chemotherapie ein Blasentumor mit dem Tumorstadium pT3-pT4 und/oder pN1-3 cM0 vorliegt und trotz Eignung eine Cisplatin-basierte adjuvante Therapie abgelehnt wird.
Das NIAGARA-Regime: Eine neue perioperative Therapieoption
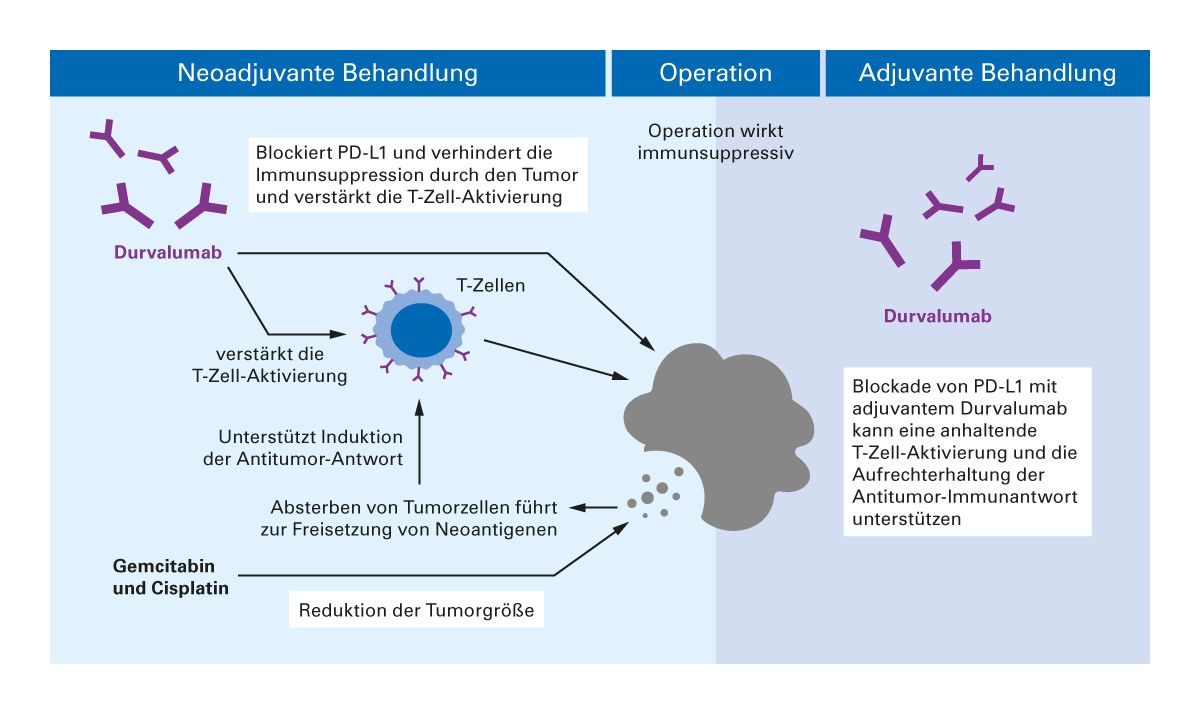
Die NIAGARA-Studie ist die erste globale Phase-III-Studie, die eine perioperative Immuntherapie mit Durvalumab in Kombination mit neoadjuvanter Chemotherapie bei Cisplatin-fähigen Patient:innen mit MIBC untersucht hat. Das Regime ist seit Juli 2025 als erste und einzige perioperative Chemoimmuntherapie für das MIBC zugelassen (Abb. 2).
Die offene, randomisierte Phase-III-Studie NIAGARA untersuchte Patienten, die für eine Cisplatin-basierte Chemotherapie geeignet waren und ein resezierbares MIBC (cT2–T4a N0/N1 M0) aufwiesen. Einschlusskriterien waren unter anderem ein histologisch oder zytologisch dokumentiertes MIBC, eine Kreatinin-Clearance von mindestens 40 ml/min/1,73 m² Körperoberfläche und die medizinische Eignung für eine radikale Zystektomie. Patient:innen mit mäßig eingeschränkter Nierenfunktion (CrCl ≥ 40 ml/min bis < 60 ml/min) erhielten eine Split-Dose-Cisplatin-Gabe. Patienten, die zuvor eine systemische Chemo- oder Immuntherapie für MIBC oder NMIBC erhalten hatten, waren ausgeschlossen [11].
Die Patienten wurden im Verhältnis 1:1 randomisiert. Die Durvalumab-Gruppe erhielt vier Zyklen neoadjuvantes Durvalumab (1500 mg) in Kombination mit Gemcitabin (1000 mg/m²) und Cisplatin (70 mg/m² an Tag 1, und Gemcitabin 1000 mg/m² an Tag 8) alle 3 Wochen intravenös. Dem folgte eine radikale Zystektomie und anschließend bis zu acht Zyklen adjuvantes Durvalumab (1500 mg) alle 4 Wochen intravenös. Die Vergleichsgruppe erhielt das gleiche neoadjuvante Gemcitabin-Cisplatin-Regime, gefolgt von einer radikalen Zystektomie allein, ohne adjuvante Therapie.
Das Studiendesign umfasste Patienten mit unterschiedlichen Histologien (urothelial oder urothelial mit divergenter Differenzierung oder histologischen Subtypen), moderat eingeschränkter Nierenfunktion und variabler PD-L1-Expression. Co-primäre Endpunkte waren ereignisfreies Überleben (EFS) und pathologische Komplettremission (pCR).
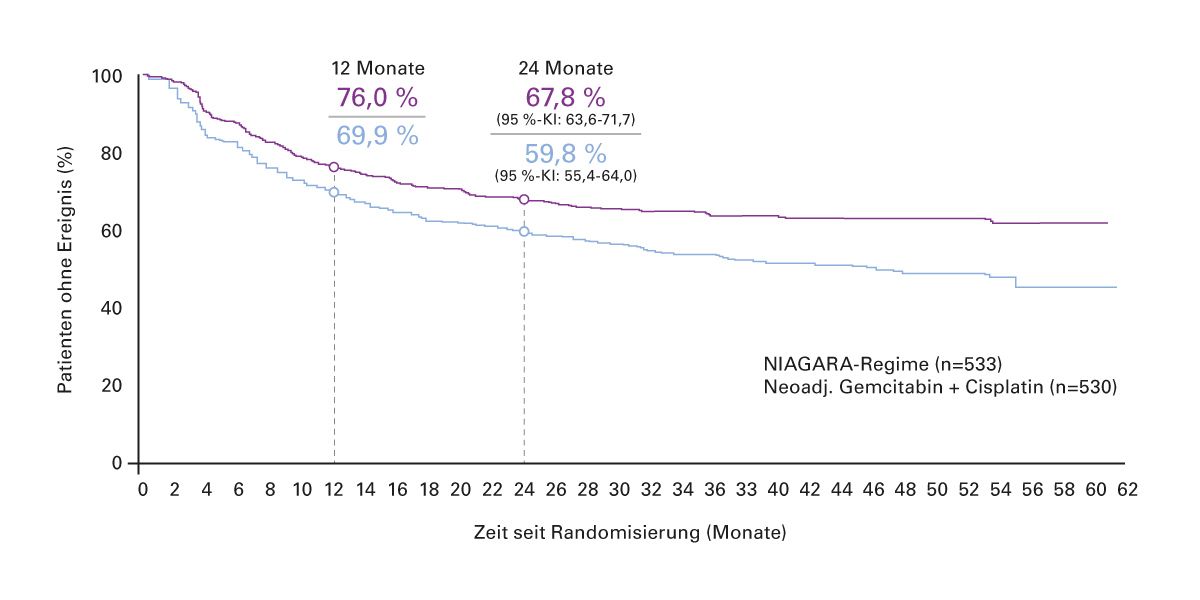
Im Durvalumab-Arm war das EFS signifikant länger als in der Vergleichsgruppe (Hazard Ratio HR 0,68; 95 % KI 0,56–0,82) (Abb. 3). Die Vorteile des EFS waren über alle untersuchten Subgruppen hinweg konsistent [11]. Auch das OS (sekundärer Endpunkt) zeigte eine signifikante und klinisch bedeutsame Verbesserung im Durvalumab-Arm (HR 0,75; 95 % KI 0,59–0,93).
Die pCR-Rate war in der Durvalumab-Gruppe höher (37,3 % vs. 27,5 % in der Vergleichsgruppe; Odds Ratio OR 1,34; 95 % KI 1,34–1,60), was einer Verbesserung der pCR-Rate um 10 % entspricht. Explorative post-hoc-Analysen zeigten, dass die perioperative Behandlung mit Durvalumab das EFS sowohl bei Patienten mit als auch ohne pCR verbesserte [12]. Die Zugabe von neoadjuvantem Durvalumab hatte keine negativen Auswirkungen auf die Möglichkeit, eine radikale Zystektomie durchzuführen oder abzuschließen und führte zu keiner Verzögerung der Operation.
Das perioperative Kombinations-Regime mit Durvalumab zeigte ein bewährtes und handhabbares Verträglichkeitsprofil. Die am häufigsten gemeldeten unerwünschten Ereignisse (UE) umfassten Nausea (54 %), Anämie (39 %), Verstopfung (39 %), Fatique (36 %) und Harnwegsinfekte (17 %). Schwerwiegende (Grad 3/4) AEs waren u. a. Anämie, Harnwegsinfekte und Neutropenie. Sie traten in über 10% der Patient:innen auf und waren in der Durvalumab- und der Kontroll-Gruppe vergleichbar [11].
Immunvermittelte Nebenwirkungen traten bei 21 % in der Durvalumab-Gruppe auf, verglichen mit 3 % in der Kontrollgruppe. Die meisten dieser immunvermittelten unerwünschten Ereignisse im Durvalumab-Arm waren niedriggradig und entsprachen dem bekannten Sicherheitsprofil von Durvalumab. Immunvermittelte Nebenwirkungen des Grades 3 oder 4 wurden bei 3 % der Patient:innen im Durvalumab-Behandlungsarm beobachtet.
Die Integration von Durvalumab in das perioperative Therapieschema der NIAGARA-Studie beeinträchtigte die Durchführung und den Zeitpunkt der Operation nicht nachteilig. Tatsächlich unterzogen sich 88,0 % der Patient:innen in der Durvalumab-Gruppe einer radikalen Zystektomie, verglichen mit 83,2 % in der Kontrollgruppe. Die häufigsten Gründe für das Ausbleiben einer Zystektomie waren stattdessen die Entscheidung der Patient:innen oder das Fortschreiten der Erkrankung, wobei die Zahlen in beiden Studienarmen vergleichbar waren.
Diskrepanz zwischen Leitlinienempfehlung und klinischer Praxis
Trotz der klaren Evidenz für den Nutzen der neoadjuvanten Chemotherapie und der neuen vielversprechenden perioperativen Therapieansätze, wie dem NIAGARA-Regime, zeigt die klinische Praxis noch immer eine Diskrepanz zur Leitlinienempfehlung. Eine Befragung von 336 urologischen Kliniken im DACH-Raum aus dem Jahr 2023 ergab, dass über 70 % der Kliniken die neoadjuvante Chemotherapie als Standardbehandlung ansehen. Dennoch erhielten im Durchschnitt nur knapp 50 % der Patient:innen tatsächlich eine neoadjuvante Therapie. Ein häufig genannter Grund für diesen Verzicht war die Präferenz für eine adjuvante Therapie [13].
Auf der anderen Seite zeigten Auswertungen der Checkmate-274-Studie einen EFS-Vorteil der adjuvanten Immuntherapie gegenüber Placebo besonders deutlich bei Patienten, die vor der Zystektomie bereits eine neoadjuvante Therapie mit Cisplatin erhalten hatten [14]. Diese Diskrepanz unterstreicht die Notwendigkeit einer verstärkten Aufklärung und Implementierung der evidenzbasierten Leitlinien in den klinischen Alltag. Die Einführung neuer, wirksamerer und gut verträglicher perioperativer Therapieoptionen wie dem NIAGARA-Regime könnte dazu beitragen, die Akzeptanz und Anwendung dieser Behandlungsstrategien zu erhöhen und somit die Ergebnisse für Patienten mit MIBC nachhaltig zu verbessern.
Ausblick
Die Landschaft perioperativer Studien für das muskelinvasive Harnblasenkarzinom (MIBC) entwickelt sich derzeit rasant weiter. Nach der Zulassung des NIAGARA-Protokolls und der Etablierung der Kombination aus neoadjuvantem Durvalumab und Chemotherapie als neuen Standard of Care (SOC) rücken nun innovative perioperative Kombinationstherapien in den Fokus, insbesondere solche mit Antikörper-Wirkstoff-Konjugaten wie Enfortumab Vedotin (EV) in Kombination mit Immuncheckpoint-Inhibitoren.
Die VOLGA-Studie (NCT04960709) testet bei cisplatin-unfitten MIBC-Patienten oder bei Patienten, die eine Chemotherapie ablehnen, neoadjuvantes Durvalumab + EV ± Tremelimumab gegenüber der alleinigen Durvalumab-Monotherapie- Die Phase-3-Studie KEYNOTE-905/EV-303 (NCT03924895) evaluiert die perioperative Gabe von Pembrolizumab alleine oder in Kombination mit EV gegenüber der alleinigen Überwachung bei cisplatin-unfitten MIBC-Patienten. Parallel dazu untersucht KEYNOTE-B15/EV-304 (NCT04700124) bei cisplatin-fitten Patienten die perioperative Kombination aus EV und Pembrolizumab im Vergleich zur Standard-Chemotherapie.
Die ersten Ergebnisse dieser Studien werden zeitnah erwartet und könnten die aktuelle Therapiepraxis erneut grundlegend verändern.
Fazit
Die Behandlung des MIBC hat durch die Integration der Immuntherapie eine substanzielle Weiterentwicklung erfahren. Während die radikale Zystektomie weiterhin den Goldstandard mit den besten Überlebenschancen für viele Patientengruppen darstellt, erweitert das perioperative NIAGARA-Regime mit Durvalumab in Kombination mit neoadjuvanter Chemotherapie und anschließender adjuvanter Monotherapie die Behandlungsoptionen.
Die Studienergebnisse zeigen klare Vorteile hinsichtlich des ereignisfreien Überlebens und des Gesamtüberlebens bei einem handhabbaren Sicherheitsprofil, ohne die Operabilität zu beeinträchtigen. Zukünftige Forschungen, insbesondere zur Rolle von Biomarkern wie ctDNA, könnten die Patientenselektion weiter verfeinern und personalisierte Therapieansätze ermöglichen.
Die Ergebnisse der NIAGARA-Studie sind von großer klinischer Bedeutung, da sie eine neue, wirksame Behandlungsoption für Cisplatin-geeignete Patienten mit MIBC etablieren. Das perioperative Durvalumab-Regime ist als erstes und einziges perioperatives Immuntherapie-Regime beim muskelinvasiven Blasenkarzinom neu zugelassen. Während das Update der EAU-Leitlinie [15] hier bereits eine Empfehlung ausspricht, verweist die deutsche Leitlinie auf weitere Untersuchungen in klinischen Studien.
Literatur
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. Version 3.0 – März 2025 AWMF-Registernummer: 032-038OL
- Grabbert M. Perioperative medikamentöse Therapie des muskelinvasiven Blasenkarzinoms. CME-Kurs. Im Internet:
- RKI (Hrsg.) Krebs in Deutschland 2019/2020. Im Internet. Kap 3.25 Harnblase.
- Jansen L, Feller A. Epidemiologie von Harnblasentumoren in Deutschland. Onkologie 2022; 28: 737–741
- Moch HH. WHO Classification of Tumours of the Urinary System and Male Genital Organs. WHO OMS. 2016; 4
- Raspollini MR et al. News in the classification of WHO 2022 bladder tumors. Pathologica 2023; 115: 32–40
- Jocham D, Stepp H, Waidelich R. Photodynamic diagnosis in urology: state-of-the-art. Eur Urol 2008; 53: 1138-48
- Jazayeri SB et al. Diagnostic accuracy of vesical imaging-reporting and data system (VI-RADS) in suspected muscle invasive bladder cancer: A systematic review and diagnostic meta-analysis. Urol Oncol 2022; 40: 45-55
- Pfister C et al. Perioperative dose-dense methotrexate, vinblastine, doxorubicin, and cisplatin in muscle-invasive bladder cancer (VESPER): survival endpoints at 5 years in an open-label, randomised, phase 3 study. Lancet Oncol 2024; 25: 255–264
- Bajorin D et al. Adjuvant Nivolumab versus Placebo in Muscle-Invasive Urothelial Carcinoma. N Engl J Med 2021; 384: 2102-2114
- Powles T et al. Perioperative Durvalumab with Neoadjuvant Chemotherapy in Operable Bladder Cancer. N Engl J Med 2024; 391: 1773–1786
- Galsky MD et al. Additional efficacy and safety outcomes and an exploratory analysis of the impact of pathological complete response (pCR) on long-term outcomes from NIAGARA. Abstract 659; ASCO GU 2025.
- Reike MJ et al. An empirical survey on the adaption of neoadjuvant chemotherapy in bladder cancer. Urol Int 2024; 108: 183-189
- Powles T et al. EV-302/KEYNOTE-A39: Open-label, randomized phase III study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (Chemo) in previously untreated locally advanced metastatic urothelial carcinoma (la/mUC) Ann Oncol 2023; 34 (suppl_2): S1254-S1335. LBA6
- EAU Guidelines. Edn. presented at the EAU Annual Congress Milan 2025. ISBN 978-94-92671-29-5. https://uroweb.org/guidelines/muscle-invasive-and-metastatic-bladder-cancer, Abruf: 16.06.2025
Bildquellen
Titel: © Matthieu – stock.adobe.com


Nette Arbeit, aber es muss heissen low grade = niedriggradig entdifferenziert und high grade = hochgradig entdifferenziert sonst ist das diametral falsch
Besten Dank für Ihren wertvollen Hinweis. Der Beitrag wurde von der Redaktion entsprechend aktualisiert.