Multiple Sklerose und Familienplanung: Gynäkologie und Neurologie im Dialog – Update 2025
Interessengebiete: Allgemeinmedizin und Innere Medizin, Frauenheilkunde und Geburtshilfe, Neurologie
Die chronische Autoimmunerkrankung MS betrifft überwiegend Frauen und die Diagnose wird häufig in einem Alter gestellt, wo die Familienplanung oftmals noch nicht abgeschlossen ist. Das Thema Familienplanung bei MS ist mit zahlreichen Fragen verbunden, die viele Lebensbereiche betreffen. Daher sollte bei der Diagnose der MS bei Frauen im gebärfähigen Alter die Familienplanung im Aufklärungsgespräch erörtert und bei der Wahl einer MS-Therapie berücksichtigt werden. Für einige MS-Therapeutika werden zuverlässige Kontrazeptiva empfohlen oder sind obligat. Dennoch kann eine unbeabsichtigte Schwangerschaft eintreten. „Schwangerschafts-kompatible“ Arzneimittel sind daher bei Frauen im gebärfähigen Alter mit chronischen Krankheiten wie MS generell von Vorteil. Hormone und Immunsystem stehen in einem komplexen Wechselspiel und beeinflussen die MS-Krankheitsaktivität. Die MS-Krankheitsaktivität nimmt in der Regel während der Schwangerschaft ab und nach der Geburt wieder zu. Frauen mit hoher Krankheitsaktivität zeigen nicht unbedingt einen Rückgang der Schubrate während der Schwangerschaft. Daher sollte bei Frauen mit aktiver MS eine Schwangerschaft und auch der Zeitraum nach der Geburt sorgfältig geplant werden.
In dieser Fortbildung erhalten Sie ein umfassendes Update rund um das Thema Familienplanung und MS, einschließlich der Themenbereiche Kontrazeption, Fertilität, Vererbung, Einfluss von Hormonen und Reproduktionsmedizin auf die MS-Krankheitsaktivität sowie Nutzen, Risiken und Zulassungsstatus von MS-Therapeutika in der Schwangerschaft und Stillzeit.
Kursinhalt
Inhaltsverzeichnis
Kursbeschreibung
Die chronische Autoimmunerkrankung Multiple Sklerose (MS) betrifft überwiegend Frauen. Dabei erfolgt die Diagnose häufig im Alter zwischen 20 und 40 Jahren, wenn die Familienplanung oftmals noch nicht abgeschlossen ist. Zwar ist die MS kein Grund mehr, eine Schwangerschaft nicht in Betracht zu ziehen, dennoch gibt es einiges zu beachten. Daher ist eine umfassende Beratung der Patientinnen mit MS wichtig. Hormone und Immunsystem stehen in einem komplexen Wechselspiel und beeinflussen die Krankheitsaktivität bei Frauen mit MS. Klinische Studien der letzten Jahre zeigten, dass das Schubrisiko in der Schwangerschaft bei unbehandelten Frauen mit MS abnimmt und nach der Geburt wieder ansteigt. Daher sollte bei der Diagnose von Frauen im gebärfähigen Alter die Familienplanung im Aufklärungsgespräch erörtert und bei der Wahl einer MS-Therapie berücksichtigt werden. Zudem sollten die Therapiemöglichkeiten während und nach einer Schwangerschaft thematisiert werden.
In dieser Fortbildung erhalten Sie ein umfassendes Update rund um das Thema Familienplanung und MS, einschließlich der Themenbereiche Kontrazeption, Fertilität, Vererbung, Einfluss von Hormonen und Reproduktionstechniken auf die MS-Krankheitsaktivität sowie Nutzen, Risiken und Zulassungsstatus von MS-Therapeutika in der Schwangerschaft und Stillzeit.
Einfluss der Hormone auf das Immunsystem
Hormone beeinflussen das Immunsystem auf komplexe, vielfältige Weise und haben Effekte auf immunologische Mechanismen, die an der Regulation des MS-Krankheitsverlaufs beteiligt sind [1-4]. Sexualhormone wie Östrogene, Progesteron, Prolaktin und Androgene spielen hierbei eine bedeutende Rolle [1-4]. Einen Überblick gibt Tabelle 1.
Es wird vermutet, dass Androgene eine regulatorische Rolle bei der Entwicklung und Funktion der angeborenen Immunantwort spielen [1, 2], indem sie das adaptive Immunsystem hemmen und bis zu einem gewissen Ausmaß vor Autoimmunität schützen [1]. Infolgedessen sind Androgene vermutlich für die geringere Prävalenz von MS bei Männern im Vergleich zu Frauen verantwortlich [2].
Progesteron wird, als wichtigster Vertreter der Gestagene, während der zweiten Zyklushälfte gebildet und wirkt auch schwangerschaftserhaltend. Immunologisch weist Progesteron antiinflammatorische, remyelinisierende und neuroprotektive Effekte auf [1, 4, 5].
Das humane Choriongonadotropin (hCG) wird während der Schwangerschaft in der Plazenta gebildet und sorgt für den Erhalt der Schwangerschaft. HCG kontrolliert vermutlich durch die Expansion von IL-10-produzierenden regulatorischen B-Zellen eine unerwünschte Immunaktivierung, die andernfalls den Fötus gefährden würde. HCG hemmt zudem die Zytokin-Produktion, reduziert die T-Zell-Aktivierung und aktiviert regulatorische T-Zellen [1].
Prolaktin wird hauptsächlich zur Initiierung und Aufrechterhaltung der Laktation gebildet. Prolaktin übt duale und gegensätzliche Effekte bei MS aus, was im Zusammenhang mit einem empfindlichen Gleichgewicht zwischen Schutz des ZNS-Gewebes und einer Stimulation des Immunsystems steht [1, 3, 6].
Östrogene haben unterschiedliche immunmodulatorische Effekte bei MS, abhängig von ihrer Konzentration. In hoher Konzentration – also während der Schwangerschaft – wirken Östrogene immunsupprimierend und antiinflammatorisch. Die Expression der proinflammatorischen Zytokine, TNF-α, IL-1 und IL-6, wird inhibiert und die der antiinflammatorischen Zytokine, IL-4 und IL-10, stimuliert. Weiterhin werden regulatorische T-Zellen aktiviert [1]. In niedriger Konzentration dagegen, wie in der präovulativen Phase während des weiblichen Zyklus, zeigen Östrogene immunstimulierende und proinflammatorische Einflüsse. Die Expression von TNF-α, IFN-γ und IL-1 wird stimuliert und natürliche Killerzellen werden aktiviert [1-3, 7].
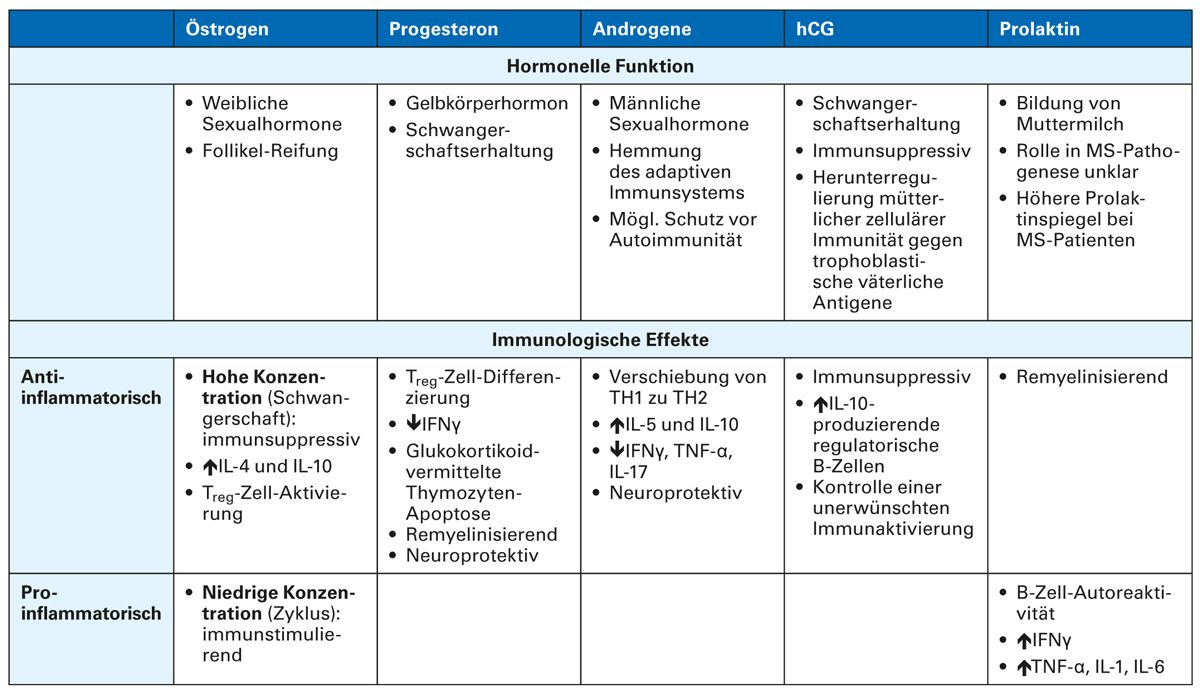
Tab. 1: Übersicht von hormonellen Effekten auf das Immunsystem bei MS [1]
(NK: natürliche Killerzellen, IFN: Interferone, IL: Interleukine, TNF: Tumornekrosefaktor; TH: T-Helferzellen)
Hormonelle Effekte in der Schwangerschaft
Die MS ist eine multifaktorielle Erkrankung. Ähnlich wie bei anderen entzündlichen Erkrankungen ist die genaue Ursache der MS unklar. Epidemiologische Studien weisen jedoch darauf hin, dass ein Zusammenspiel von genetischen, Umwelt- und Lebensstilfaktoren (z. B. Rauchen, Körpermasse, Ernährung, Sonnenlicht und Vitamin D) patho- logische Prozesse beeinflusst, die durch Virusinfektionen wie das Epstein-Barr-Virus ausgelöst werden könnten [8]. Bei der MS kommt es zu einer pathologischen Aktivierung autoreaktiver Lymphozyten, die sich gegen endogene ZNS-Komponenten richten. Aktivierte Immunzellen können die Blut-Hirn-Schranke des ZNS überwinden und in das Parenchym wandern. T-Lymphozyten spielen eine zentrale Rolle in der Pathologie, wo- bei die T-Zell-Pathologie am besten als Verschiebung des Immunnetzwerks in Richtung eines autoimmunen Zustands mit peripherem Ungleichgewicht von proinflammatorischen Th1- und Th17-Zellen und funktionell beeinträchtigten regulatorischen T-Zellen und CD8+-T-Zell-Reaktionen beschrieben werden kann. Lokal im ZNS werden T-Zellen reaktiviert und können entweder eine Entzündungskaskade einleiten, bei der weitere Immunzellen rekrutiert werden, oder direkt mit ansässigen Zellen interagieren, was zu einer direkten T-Zell-vermittelten Schädigung von Oligodendrozyten und Neuronen führt. B-Zellen spielen ebenfalls in der Pathologie der MS eine wesentliche Rolle, was sich u.a. an der charakteristischen intrathekalen IgG-Synthese (nachweisbar durch oligoklonale Banden im Liquor) und am Therapieansprechen auf B-Zell-gerichtete Therapien zeigt [8, 9].
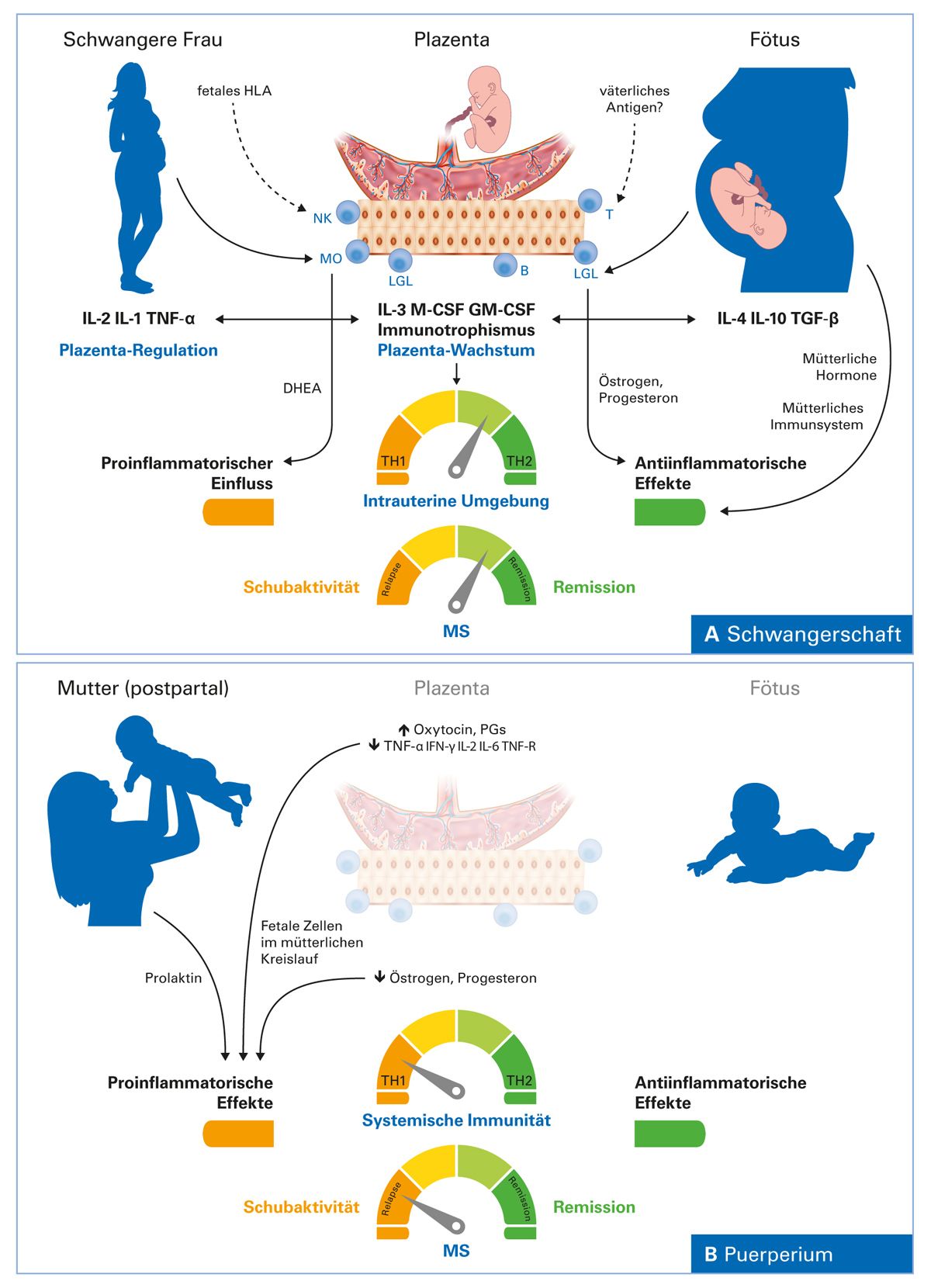
Abb. 1: Hormonelle Effekte auf das Immunsystem und die MS-Krankheitsaktivität während der
Schwangerschaft und nach der Geburt (modifiziert nach [1])
Abbildung 1A zeigt, wie Hormone – ausgehend von Mutter und Fötus – das Plazentawachstum regulieren und eine TH2-antiinflammatorische Immunantwort prädisponieren. Im Verlauf der Schwangerschaft kommt es zu einer beachtlichen Zunahme der Hormonspiegel der Östrogene, Progesteron, Glukokortikoide und von aktivem Vitamin D. Der Immunstatus verschiebt sich zum TH2-Typ hin. TH2-Zellen sezernieren antiinflammatorische Zytokine (IL-4 und IL-10), die die Schwangerschaft schützen. Zusammengenommen wird dadurch die mütterliche zelluläre Immunität verringert, was mit einer Abnahme der MS-Schübe während der Schwangerschaft in Verbindung steht, insbesondere im dritten Trimenon [1].
Abbildung 1B zeigt die Veränderungen nach der Geburt. Postpartal kommt es zur Abnahme der Hormonspiegel von Östrogen, Progesteron, Glukokortikoiden und aktiviertem Vitamin D. Der protektive Einfluss von Plazenta und Fötus geht nach der Geburt verloren und das immunologische Gleichgewicht verschiebt sich auf die proinflammatorische Seite zum TH1-Status hin. Zusammen können diese Faktoren einen Anstieg der Schübe bedingen, die während der Postpartalperiode vermehrt auftreten können [1].
Vererbung
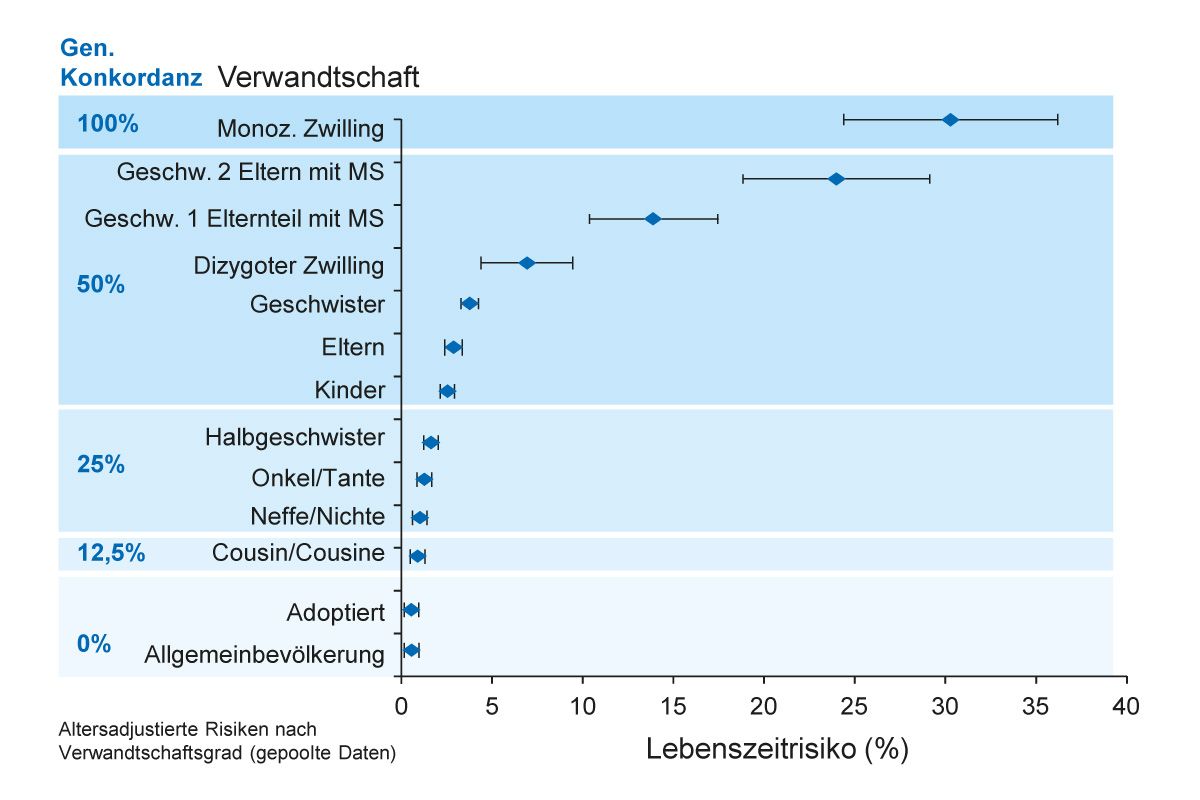
Die MS ist keine klassische Erbkrankheit. Genetische Faktoren spielen eine untergeordnete Rolle in der Krankheitsentstehung, aber Verwandte von MS-Patientinnen und Patienten haben ein höheres MS-Lebenszeitrisiko im Vergleich zur Allgemeinbevölkerung (Abb. 2). Die genetische Prädisposition für MS liegt bei ca. 25% basierend auf monozygoten Zwillingsstudien [10, 11].
Frauen zeigten in den letzten Jahrzehnten ein zunehmend höheres MS-Risiko im Vergleich zu Männern, wahrscheinlich aufgrund von veränderten geschlechtsspezifischen Faktoren und Umweltfaktoren [12], wie u.a. weniger Geburten [13, 14], höheres Alter der Mütter [15, 16] und Zunahme von Übergewicht [15] und Rauchen [15, 16]. Als geschlechtsspezifische Faktoren wurden das frühere Einsetzen der Pubertät und Menarche bei Mädchen diskutiert [1, 3, 17]. Eine Metaanalyse kam zu dem Ergebnis, dass das MS-Risiko mit einer später einsetzenden Menarche mit jedem Jahr um 12% abnimmt [17].
Familienplanung
Die Diagnose der MS fällt häufig in einen Lebensabschnitt, in dem Familienplanung und Kinderwunsch für die Betroffenen eine wichtige Rolle spielen. Von Kontrazeption und Kinderwunsch über Schwangerschaft, Geburt bis hin zur Phase nach der Geburt besteht ein hoher Informationsbedarf. Daher ist nach der Diagnosestellung und in regelmäßigen Abständen eine umfassende Beratung, idealerweise durch den betreuenden Neurologen und Gynäkologen von Bedeutung, um die Fragen entsprechend zu adressieren. Die Familienplanung sollte bereits bei der Wahl einer Immuntherapie bei MS-Patienten berücksichtigt werden. Die Leitlinie der Deutschen Gesellschaft für Neurologie (DGN) empfiehlt, eine Schwangerschaft möglichst in einer stabilen Phase der MS-Erkrankung zu planen. Aufgrund des erhöhten Risikos für Krankheitsaktivität bei Beendigung von Natalizumab und S1P-Modulatoren in Vorbereitung auf eine Schwangerschaft sollen diese Therapieszenarien detailliert mit der Betroffenen diskutiert werden [18]. Die proaktive Planung zur Reduzierung des Risikos für Krankheitsaktivität nach der Geburt sollte idealerweise vor der Schwangerschaft beginnen, insbesondere bei Frauen mit aktiver MS [19]. Bei diesen Frauen ist der bevorzugte Ansatz zur Reduzierung des Schubrisikos sowohl während der Schwangerschaft als auch nach der Geburt entweder eine depletierende Therapie wie monoklonale Antikörper gegen CD20 vor der Konzeption [19] oder die Fortsetzung der Natalizumab-Behandlung in der Schwangerschaft bis zum dritten Trimenon d. h. maximal bis zur 34. Schwangerschaftswoche [19, 20] sowie die frühe Wiederaufnahme der Therapie nach der Geburt, d.h. innerhalb von 4 Wochen nach der Geburt [20].
Ungeplante Schwangerschaften und Kontrazeption
Ungeplante Schwangerschaften sind im Allgemeinen und auch bei Frauen mit MS nicht selten. Eine standardisierte Umfrage aus dem Jahr 2015 ergab, dass jede dritte Schwangerschaft in Deutschland unbeabsichtigt ist [21]. Auch bei Frauen mit MS kommen ungeplante Schwangerschaften häufig vor, wie drei retrospektive Studien aus Deutschland [22], Dänemark [23] und den USA [24] zeigten. Demnach hatten zwischen 10-30% der Frauen mit MS eine ungeplante Schwangerschaft während der MS-Therapie [22, 23, 25]. Schwangerschafts-kompatible Arzneimittel sind daher bei Frauen im gebärfähigen Alter mit chronischen Krankheiten wie MS generell von Vorteil, selbst wenn keine Schwangerschaft geplant ist [26].
Die kontrazeptive Sicherheit von Verhütungsmethoden wird mit dem Pearl-Index angegeben (Abb. 3). Dabei gilt: Je kleiner der Pearl-Index, desto sicherer ist die Methode der Empfängnisverhütung [27]. Für viele MS-Therapeutika wird laut Fachinformation eine zuverlässige Kontrazeption empfohlen oder ist für Wirkstoffe mit teratogenem Potenzial obligat [28]. Zu den letzteren zählen Teriflunomid, die S1P-Modulatoren, Fingolimod, Siponimod, Ozanimod und Ponesimod. Bei Teriflunomid müssen Mädchen und/oder Eltern/Betreuungspersonen über die Notwendigkeit informiert werden, den behandelnden Arzt zu benachrichtigen, sobald die Menstruation einsetzt. Neu diagnostizierte Patientinnen im gebärfähigen Alter sollten über Verhütungsmethoden und das potenzielle Risiko für den Fötus aufgeklärt werden. Eine Überweisung des Neurologen an einen Gynäkologen sollte erwogen werden. Auch bei den anti-CD20-Therapien Ocrelizumab, Ofatumumab und Ublituximab müssen Frauen im gebärfähigen Alter während der Behandlung und für eine bestimmte Dauer nach der letzten Infusion eine zuverlässige Verhütungsmethode anwenden. Die jeweilige Dauer ist der aktuellen Fachinformation zu entnehmen [28]. Da Cladribin in die DNA-Synthese eingreift, sind unerwünschte Wirkungen auf die Gametogenese beim Menschen zu erwarten. Aufgrund von Erfahrungen mit anderen die DNA-Synthese hemmenden Substanzen kann Cladribin angeborene Fehlbildungen verursachen, wenn es während der Schwangerschaft angewendet wird. Daher muss während der Behandlung und mindestens 6 Monate nach der letzten Dosis eine zuverlässige Verhütungsmethode angewendet werden. Männliche Patienten müssen während der Behandlung sowie für mindestens 6 Monate nach der letzten Dosis Vorkehrungen treffen, damit bei ihrer Partnerin keine Schwangerschaft eintritt [28].
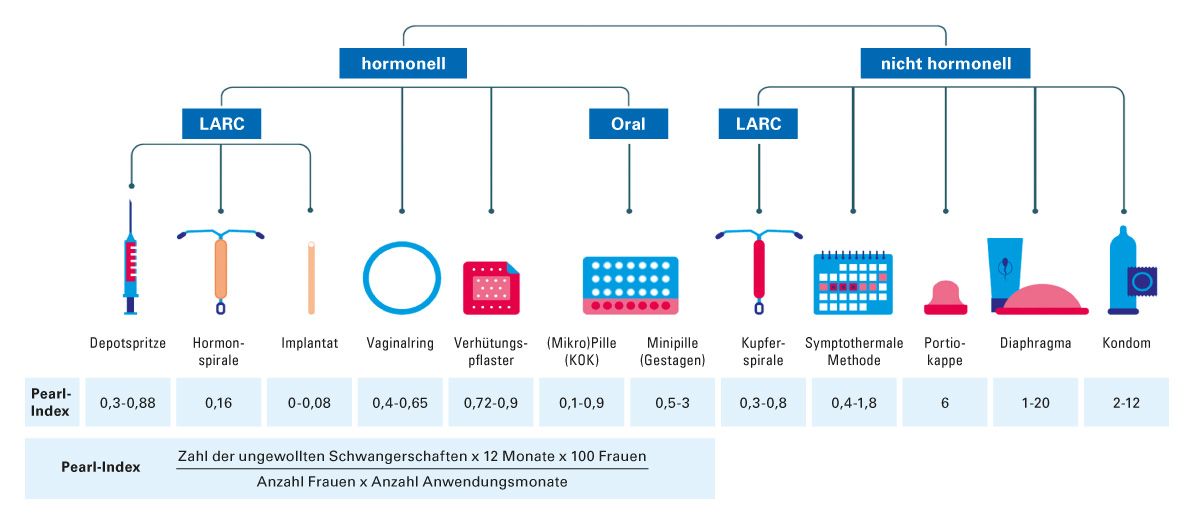
Abb. 3: Übersicht zur kontrazeptiven Sicherheit von Verhütungsmitteln (Angaben zum Pearl-Index
nach [27])
*LARC: Reversible Langzeitkontrazeptiva (long-active reversible contraceptives)
Kinderwunsch und Fertilität
Noch bis Ende des 20. Jahrhunderts wurde Frauen mit MS davon abgeraten, schwanger zu werden, weil eine Verstärkung der Krankheitsaktivität befürchtet wurde. Das hat sich entscheidend geändert: Heute ist die Multiple Sklerose kein Grund mehr, eine Schwangerschaft nicht in Betracht zu ziehen.
Die Fertilität wird nicht durch MS eingeschränkt, aber dennoch bleiben mehr Frauen mit MS kinderlos und unterziehen sich häufiger reproduktionsmedizinischen Behandlungen gegenüber der Allgemeinbevölkerung [15, 16].
Reproduktionsmedizin
Das Alter der Frau ist einer der wichtigsten Faktoren für die Fertilität. Es ist allgemein bekannt, dass die Fertilität mit dem Alter abnimmt und dass Mütter immer älter werden. So sind Mütter heute bei der Geburt des ersten Kindes rund 30 Jahre alt und damit 5 Jahre älter als 1980 [29]. Auch die Anzahl an Geburten bei Frauen über 40 hat sich seit 1990 fast vervierfacht [30]. Frauen mit MS sind häufig älter als Frauen in der Allgemeinbevölkerung, wenn sie bereit sind, Mutter zu werden: Ein Grund dafür könnte sein, dass sie auf einen Zeitraum mit geringer klinischer und radiologischer Aktivität warten und somit den Wunsch nach Mutterschaft hinauszögern [15]. Daher steigt die Wahrscheinlichkeit für eine ART-Behandlung (künstliche Befruchtung, Assisted Reproductive Technology) mit zunehmendem Alter [15, 16]. Konsistente Studienergebnisse bei Frauen mit MS und Schwangerschaftswunsch haben gezeigt, dass zu den präkonzeptionellen Krankheitsmerkmalen, die mit einer höheren Wahrscheinlichkeit für eine postpartale Krankheitsaktivität assoziiert sind, eine unkontrollierte Erkrankung im Jahr vor der Empfängnis, eine immunmodulatorische Therapie vor der Empfängnis und ein höherer EDSS zum Zeitpunkt der Empfängnis gehören [16, 31].
Bei Frauen mit MS unter ART kann daher davon ausgegangen werden, dass das postpartale Schubrisiko durch die gleichen Risikofaktoren steigt, wie bei natürlichen Schwangerschaften von Patientinnen mit MS. Daher wird empfohlen eine ART idealerweise bei stabiler MS-Erkrankung zu planen bzw. durchzuführen [15, 16].
Angesichts des erhöhten Schubrisikos durch das Absetzen der MS-Therapie und eines möglichen Misserfolgs der ART ist es nicht ratsam, die Therapie vor der ART zu unterbrechen [16]. Die MS-Behandlung sollte mit einer schwangerschaftskompatiblen DMT durchgeführt werden [15]. Die Therapie mit Glatirameracetat oder Interferonen während einer ART-Schwangerschaft kann, wenn klinisch erforderlich, fortgeführt werden. Die neuesten Daten zu Dimethylfumarat unterstützen eine sichere Anwendung bis zur Empfängnis. Natalizumab kann, nach individueller Risiko-Nutzen-Abwägung, fortgeführt werden. Die verfügbaren Daten im Fall von Anti-CD20-Therapien mit Verabreichung kurz vor der Schwangerschaft sind limitiert [16], aber es scheint, dass die Exposition gegenüber Ocrelizumab (max. 1. Trimenon) das Risiko für unerwünschte Schwangerschaftsausgänge und unerwünschte Ereignisse beim Kind nicht erhöht [32]. Studienergebnisse weisen darauf hin, dass ein Anstieg der Schubrate mit dem Versagen der ART zusammenhängen könnte. Es ist denkbar, dass die Zunahme der MS- Aktivität nach ART durch den plötzlichen Abfall des Östrogenspiegels ausgelöst wird, der nach dem Versagen der ART auftritt, wie es nach einem Abbruch oder einer Entbindung bei Frauen mit physiologischer Schwangerschaft der Fall ist [16].
Die meisten ovariellen Stimulationen bei In-vitro-Fertilisation (IVF) werden derzeit mit Gonadotropin-Releasing-Hormon (GnRH)-Antagonisten durchgeführt, die als sicherer als GnRH-Agonisten gelten, um einen unkontrollierten Anstieg des Luteinisierenden Hormons und Eisprung zu verhindern. Daher sollten bevorzugt GnRH-Antagonisten zur ovariellen Stimulation eingesetzt werden [15, 16].
Schwangerschaft
Die Schwangerschaft übt einen protektiven Einfluss auf die MS aus [1, 33, 34]. Eine Übersicht von Risikofaktoren und protektiven Faktoren zeigt Tabelle 2.

Tab. 2: Prädiktive Faktoren für das postpartale Schubrisiko
DMT: Krankheitsmodifizierende Therapeutika (Disease-Modifying Therapies); EDSS: Expanded Disability Status Scale; MRT: Magnetresonanztomographie; SWS: Schwangerschaft
DMT während der Schwangerschaft
Die Therapielandschaft der MS hat sich seit der Zulassung der ersten immunmodulatorischen Therapie im Jahr 1995 in den letzten Jahren kontinuierlich erweitert [18, 28]. Mittlerweile steht eine Vielzahl an Behandlungsmöglichkeiten zur Verfügung. Tabelle 3 gibt einen Überblick über den Zulassungsstatus der einzelnen Therapien während der Schwangerschaft.
Einfluss der MS-Therapie vor und während der Schwangerschaft
Um das Risikos für Krankheitsaktivität nach der Geburt zu reduzieren, sollte die proaktive Planung der geeigneten MS-Therapie und des Managements idealerweise bereits vor der Schwangerschaft starten [19]. Die meisten immunmodulatorischen MS-Therapien, bis auf die Interferone und Glatirameracetat, sind in der Schwangerschaft eingeschränkt, d.h. unter Nutzen-Risiko-Abwägung, zugelassen oder kontraindiziert. Ergebnisse aus dem Dimethylfumarat-Schwangerschaftsregister zeigten, dass die DMF-Exposition im ersten Trimenon keine negativen Auswirkungen auf den Schwangerschaftsverlauf hatte: Geburtsfehler, Frühgeburten und spontane Fehlgeburten waren mit den Raten in der Gesamtbevölkerung vergleichbar [40]. Die mediane Dauer der Exposition gegenüber Dimethylfumarat betrug 4,6 Schwangerschaftswochen, wobei die Exposition nach der sechsten Schwangerschaftswoche begrenzt war (44 Schwangerschaftsausgänge). Das Risiko einer längeren Exposition gegenüber Dimethylfumarat oder einer Exposition in einem späteren Stadium der Schwangerschaft ist nicht bekannt [28]. Da Dimethylfumarat eine kurze Halbwertzeit hat, kann es bis zum Bekanntwerden der Schwangerschaft angewendet werden [36, 41]. Während der Schwangerschaft sollte Dimethylfumarat nur bei eindeutigem Bedarf angewendet werden, wenn der mögliche Nutzen das potentielle Risiko für den Fötus rechtfertigt [28].
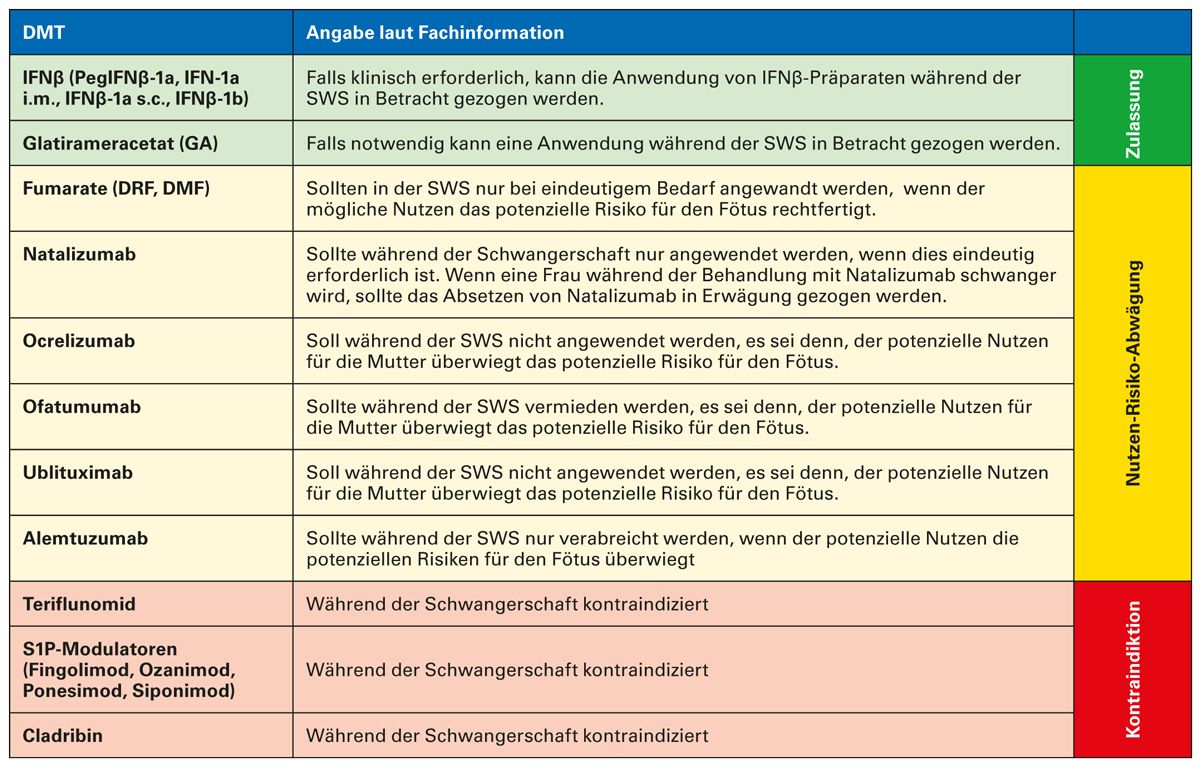
Tab. 3: Anwendung von DMT während der Schwangerschaft laut Zulassung [28]
DMF: Dimethylfumarat; DMT: Krankheitsmodifizierende Therapeutika (Disease Modifying Therapies); DRF: Diroximelfumarat; IFN: Interferon; S1P: Sphingosin-1-phosphat; SWS: Schwangerschaft
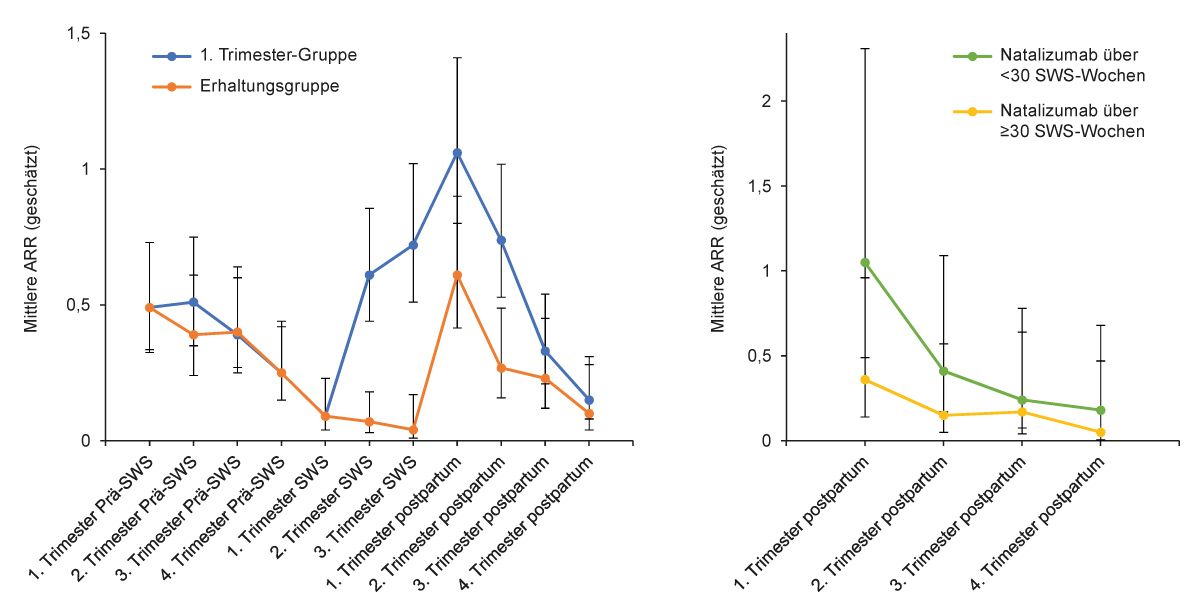
Abb. 4: Verlauf der jährlichen Schubrate während der Schwangerschaft und nach der Geburt, geschätzt durch Poisson-Regression, stratifiziert nach dem Zeitpunkt des Absetzens von Natalizumab links während (1. Trimester-Gruppe) oder nach (Erhaltungsgruppe) dem ersten Trimester (a) sowie vor (<30-Subgruppe) oder nach (≥30-Subgruppe) der 30. Schwangerschaftswoche (b) (modifiziert nach [20])
Bei Fortführung der Natalizumab-Therapie über das 1. Trimenon hinaus versus Absetzen während des ersten Trimenons wurden signifikant weniger Schübe während der Schwangerschaft und im postpartalen Jahr dokumentiert (Abb. 4a). Eine Therapiefortführung über ≥ 30 Schwangerschaftswochen, insbesondere zusammen mit früher Wiederaufnahme der Therapie (28 Tage nach der Geburt) führte zu signifikant weniger Schüben in den ersten 6 Monaten postpartal (Abb. 4b) [20].
Dementsprechende Empfehlungen gibt die DGN zur Verringerung des Risikos einer Verschlechterung der Krankheitsaktivität und der Behinderung während und nach der Schwangerschaft: Für geplante oder ungeplante Schwangerschaften bei hoher Krankheitsaktivität kann Natalizumab bis maximal zur 34. Woche gegeben werden, unter klarer Besprechung der Nutzen-Risiko-Abwägungen (Abb. 5) [18].
Eine Alternative können die Anti-CD20-Antikörper Ocrelizumab, Ofatumumab und Ublituximab darstellen, da monoklonale Antikörper erst ab der 13. Schwangerschaftswoche die Plazentaschranke vermehrt passieren können [42]. Basierend auf Daten aus der firmeneigenen weltweiten Sicherheitsdatenbank ist die Anwendung von Ocrelizumab im ersten Trimenon vermutlich sicher [43]. Eine verringerte B-Zell-Zahl und ein erhöhtes Frühgeburtenrisiko kann nicht ausgeschlossen werden, jedoch weisen die ersten Daten nicht auf eine verringerte B-Zell-Zahl beim Neugeborenen nach Ocrelizumab-Exposition (max. 1. Trimenon) hin [32, 43]. Die In-Utero-Exposition gegenüber Ocrelizumab erhöhte das Risiko von Schwangerschaftskomplikationen oder Fehlbildungen beim Säugling im Vergleich zur Allgemeinbevölkerung nicht [32, 43].
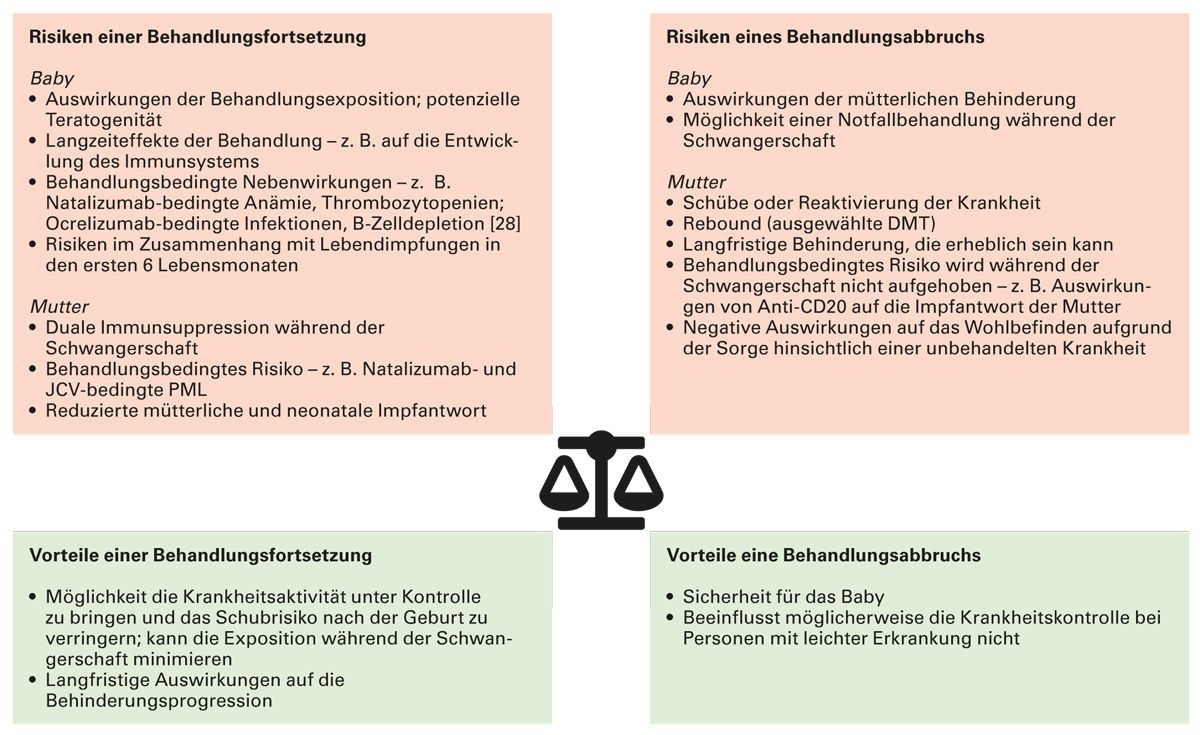
Abb. 5: Risiken und Nutzen von DMTs bei Multipler Sklerose rund um die Schwangerschaft bei Mutter und Kind (modifiziert nach Krysko et al. 2023 [19])
DMT: Krankheitsmodifizierende Therapeutika (Disease-Modifying Therapies); JCV: John-Cunningham-Virus; PML: progressive multifokale Leukenzephalopathie
Generelle Empfehlungen für das Management von schwangeren Frauen mit MS
Folgende allgemeine Empfehlungen gelten für die ärztliche Betreuung von Frauen mit Kinderwunsch und schwangeren Frauen mit MS [3, 18, 19, 38]:
- Frauen mit MS sollten eine Schwangerschaft erst dann planen, wenn die Krankheit
gut durch eine krankheitsmodifizierende Therapie kontrolliert bzw. stabilisiert ist. - Frauen im gebärfähigen Alter mit MS sollten eine schwangerschaftskompatible
MS-Therapie erhalten. - Frauen mit MS sollten während der Schwangerschaft Vitamin D und Folsäure
einnehmen. - Die Kontrolle des Vitamin-D-Spiegels während der Schwangerschaft wird
empfohlen. - Zu jeder Mutterschaftsvorsorgeuntersuchung gehört zwingend eine Urinuntersuchung. Harnwegsinfektionen treten im Allgemeinen gehäuft während der Schwangerschaft auf. Blasenfunktionsstörungen sind zudem häufig auftretende Symptome der MS. Daher könnten Frauen mit MS eine besondere Anfälligkeit hierfür aufweisen.
- Bei Auftreten eines schweren Schubs mit Funktionseinschränkung kann nach dem ersten Trimenon eine Therapie mit Glukokortikosteroiden erfolgen [3, 36, 38]. Im ersten Trimenon ist die 8.–11. Schwangerschaftswoche ein besonders anfälliger Zeitraum für die Entwicklung einer Lippen-Kiefer-Gaumenspalte [3, 36]. Bevorzugt sollte in der Schwangerschaft mit nichtfluorierten Glukokortikosteroiden mit kurzer Halbwertzeit und geringem Placentatransfer therapiert werden, wie z. B. Methylprednisolon, Prednisolon [3, 36, 38, 41].
Geburt
Bei Frauen mit MS gelten die gleichen Empfehlungen für die Entbindung und Anästhesie wie bei Frauen ohne MS [19]. Epiduralanästhesie oder Entbindungsart sind nicht mit einer erhöhten Schubrate in der postpartalen Phase assoziiert [19].
Stillen
Muttermilch ist zweifellos die beste Ernährung für das Kind in den ersten Monaten nach der Geburt. Die WHO und die deutsche Stillkommission empfehlen, Babys mindestens 6 Monate lang ausschließlich zu stillen bevor sukzessive zugefüttert wird [44, 45]. Ausschließliches Stillen, ohne Zufütterung, scheint sich vor allem bei mild-moderaten Krankheitsverläufen positiv auf das postpartale Schubrisiko auszuwirken, wie eine Metaanalyse aus dem Jahr 2023 zeigte [39] (Abb. 6). Laut KKNMS sollten alle Frauen mit MS, die stillen wollen, in ihrem Stillwunsch unterstützt werden. Wenn eine Therapie aufgrund der MS-Aktivität notwendig ist, sollte das Stillen in Kombination mit einer
„stillkompatiblen“ MS-Therapie erfolgen [41].
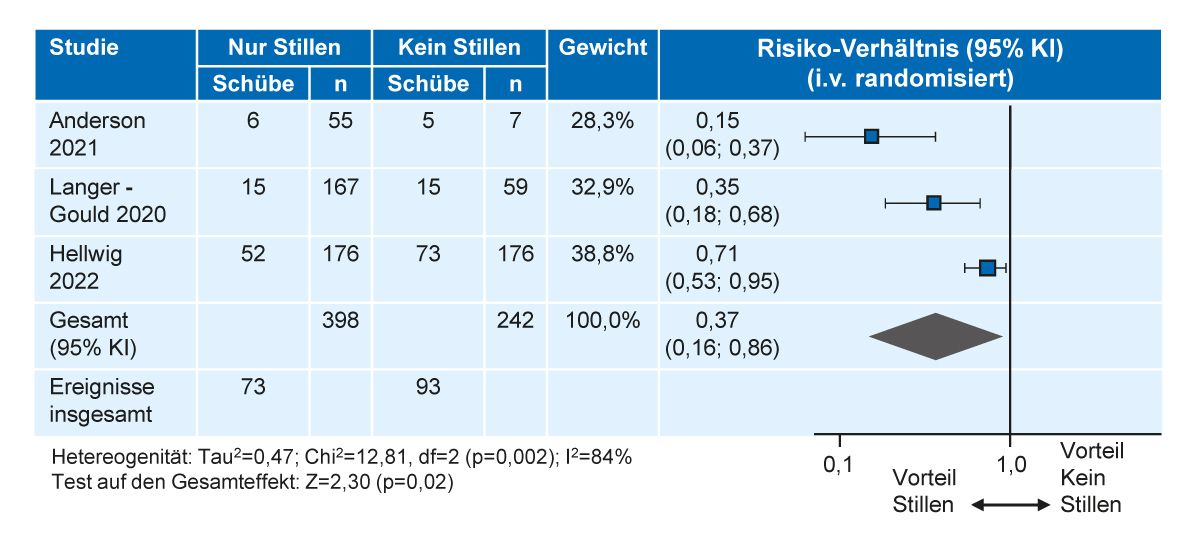
Abb. 6: Metaanalyse zum postpartalen Schubrisiko von ausschließlich stillenden Frauen mit MS (modifiziert nach [39])
Übertritt von Arzneimitteln in die Muttermilch
Bei stillenden Müttern mit einer Pharmakotherapie wird die relative kindliche Dosis (RID, relative infant dose) berechnet, um das Risiko für das Kind abzuschätzen. Die Menge an Muttermilch, die ein Säugling aufnimmt, variiert. Die geschätzte Aufnahme eines ausschließlich gestillten Säuglings beträgt täglich 150 ml Muttermilch pro kg Körpergewicht. Die relative kindliche Dosis (RID) ist die über die Muttermilch aufgenommene Dosis (mg/kg/Tag), relativ zur Dosis der Mutter (mg/kg/Tag) in Prozent.

Laut WHO wird die Sicherheit der Medikamente in der Stillphase grob anhand der RID eingeteilt, wobei Medikamente mit einer RID <10% der mütterlichen Dosis von der WHO als theoretisch akzeptabel eingestuft wurden [46, 47].
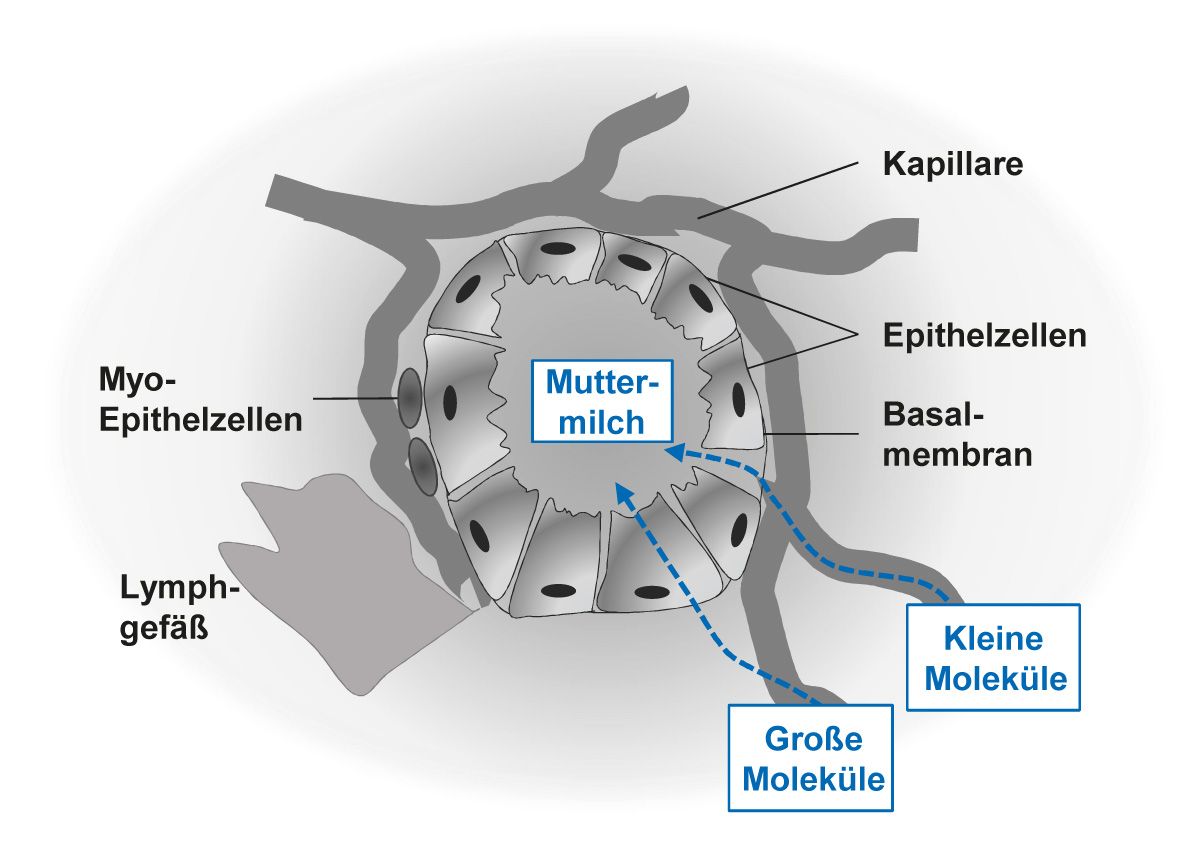
Ein Substanzübertritt in die Muttermilch ist abhängig von Lipophilie, Molekülgröße und gewicht des Medikamentes [47]. Muttermilch wird in den Alveolen der Milchdrüsen produziert. Die Epithelzellen der Alveole bilden eine Basalmembran, die das Blutplasma von der Muttermilch trennt (Abb. 7). In der Kolostralphase (ca. 3–4 Tage postpartum) sind die Räume zwischen den Epithelzellen relativ weit geöffnet, so dass große Moleküle, wie z. B. die mütterlichen Immunglobuline oder monoklonale Antikörper, leicht aus dem mütterlichen Kreislauf in die Muttermilch gelangen können. Nach der Kolostralphase (ca. 1 Woche postpartum) schließen sich allmählich die intrazellulären Räume im Verlauf von 1–2 Wochen nach der Geburt, so dass nur noch kleine Moleküle (<200 Da) in die Muttermilch gelangen können [47]. Große Moleküle (>1 kDa), wie z. B. Glatiramerace- tat (5-9 kDa) [48], IFNβ/ PegIFNβ (18-44 kDa) [49, 50] oder auch monoklonale Antikörper [51, 52] gelangen nicht mehr über die Barriere der Basalmembran.
Daten von zwei stillenden Frauen zum kleinen Molekül Dimethylfumarat (Molekulargewicht 144 Dalton) bzw. dem wirksamen Metaboliten Monomethylfumarat (Molekulargewicht 129 Dalton) zeigten eine RID von 0,007% bzw. 0,019% und somit deutlich unterhalb der WHO-Sicherheitsgrenze von 10%. Aufgrund der kurzen terminalen Halbwertszeit von nur 1 Stunde akkumuliert Monomethylfumarat offenbar nicht [53].
Bisherige Daten zu den monoklonalen Antikörpern Natalizumab (149 kDa) und Ocrelizumab (145 kDa) weisen auf einen geringen Übergang in die Muttermilch hin [51,54-57]. Erste Ocrelizumab-Daten von 13 stillenden Frauen (mittlerer Therapiestart 2 Mo- nate (0,5–5,0) nach der Geburt) zeigten nicht-nachweisbare Ocrelizumab-Serumspiegel in den gestillten Säuglingen 30 Tage nach der mütterlichen Infusion (< Bestimmungs- grenze=156 ng/ml). Die durchschnittliche RID lag bei 0,3%. Bei allen Säuglingen lagen die B-Zellwerte im altersspezifischen Normalbereich. Insgesamt traten bei 76,9% der gestillten Säuglinge Infektionen auf [57].Die mittlere durchschnittliche Natalizumab-Konzentration in der Muttermilch betrug bei einer Untersuchung von acht Patientinnen, die seriell Muttermilchproben abgaben 0,06 µg/ml (SD 0,05). Die mediane Natalizumab-Serumkonzentration lag bei 15,5 µg/ml (Spanne 3,6-55,9). Die RID lag mit einem Mittelwert von 0,04 % (SD = 0,03) weit unter dem von der WHO als unbedenklich deklarierten Wert von < 10%. Es wurden keine Nebenwirkungen bei den Säuglingen beobachtet [56].
Die injizierbaren Therapien, wie IFNβ/PegIFNβ, Glatirameracetat und die monoklonalen Antikörper Natalizumab oder Ocrelizumab verlieren bei oraler Gabe ihre Wirksamkeit, wegen der im Magen-Darm-Trakt stattfindenden Metabolisierungsprozesse [56, 58, 59]. Daher sind unerwünschte Wirkungen beim Kind nicht zu erwarten. Eine Aufnahme über den neonatalen Fc-Rezeptor ist unwahrscheinlich [59-61].
Stillen während der Therapie mit DMT
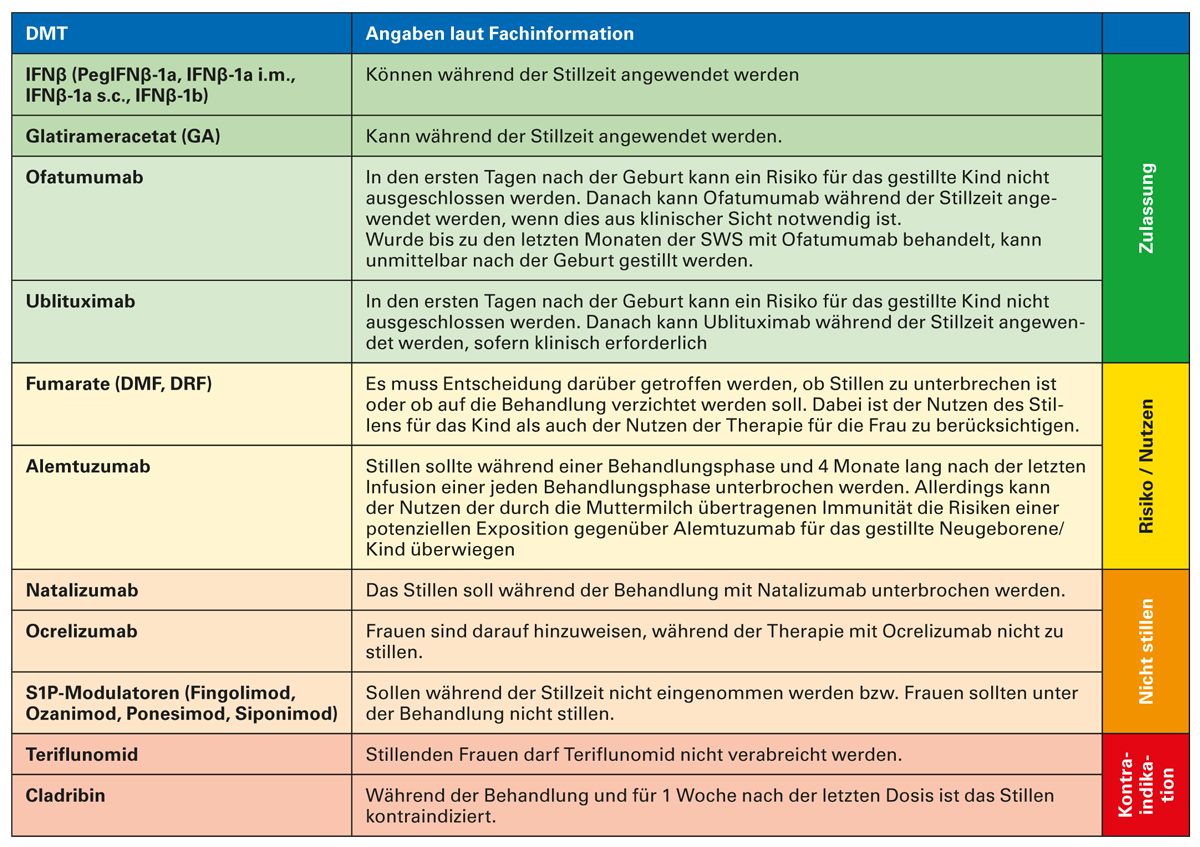
Tabelle 4 gibt einen Überblick über den Zulassungsstatus der einzelnen Therapien während der Stillzeit.
Durch einen frühzeitigen Therapiestart nach der Geburt mit einer hochwirksamen krankheitsmodifizierenden Therapie kann das postpartale Schubrisiko gesenkt werden. Stillen scheint ebenfalls einen positiven Effekt auf das Schubrisiko auszuüben, der allerdings bei aktiver MS weniger ausgeprägt ist. Die Rückkehr der Krankheitsaktivität kann durch die frühzeitige Wiederaufnahme der Behandlung mit Natalizumab innerhalb von 28 Tagen verringert werden [20, 41].
Fazit
Frauen sind häufiger von MS betroffen als Männer. Die Mehrheit der Frauen mit MS ist bei der Diagnosestellung im gebärfähigen Alter, und die Familienplanung ist häufig nicht abgeschlossen. Fragen zur Familienplanung können daher einen zentralen Stellen- wert einnehmen. Die Diagnose MS ist kein Grund, Frauen von einer Schwangerschaft abzuraten. Die MS ist keine Erbkrankheit, d.h. genetische Faktoren spielen eine untergeordnete Rolle in der Krankheitsentstehung.
Hormone und Immunsystem unterliegen komplexen dynamischen Interaktionen. Während der Schwangerschaft wirken die hormonellen Veränderungen antiinflammatorisch und senken das Schubrisiko. Die MS-Krankheitsaktivität nimmt in der Regel während der Schwangerschaft ab und nach der Geburt wieder zu, wobei in modernen Kohorten schwangerer Frauen eine geringere Krankheitsaktivität beobachtet wurde. Frauen mit hoher Krankheitsaktivität zeigen nicht unbedingt einen Rückgang der Schubrate während der Schwangerschaft und Studien beobachteten ein erhöhtes Schub- und Behinderungsrisiko nach dem Absetzen von z. B. Natalizumab. Daher sollte eine Schwangerschaft und auch der Zeitraum nach der Geburt bei Frauen mit aktiver MS sorgfältig geplant werden.
Bei der Nutzen-Risiko-Abwägung sollten die potenziellen Risiken für den Fötus oder das Neugeborene durch eine Arzneimittelexposition während der Schwangerschaft und Stillzeit auf der einen Seite sowie der Nutzen der Therapie für die Mutter als auch die mütterlichen Risiken eines Behandlungsabbruchs auf der anderen Seite abgewogen werden.
Die Familienplanung sollte bei der Wahl der MS-Therapie berücksichtigt werden und schwangerschaftskompatiblen MS-Therapien den Vorzug gegeben werden. Eine Schwangerschaft sollte, sofern planbar, möglichst in einer stabilen Phase der MS geplant und umgesetzt werden.
Ausschließliches Stillen kann sich positiv auf das postpartale Schubrisiko auswirken. Wenn eine Therapie postpartum auf Grund der MS-Aktivität notwendig ist, sollte das Stillen in Kombination mit einer stillkompatiblen MS-Therapie erfolgen. Eine inter- disziplinäre Beratung bei Frauen mit MS durch den behandelnden Neurologen und Gynäkologen kann umfassend alle Fragen zur Familienplanung einschließlich Kontrazeption, Fertilität, Kinderwunsch, ART, Schwangerschaft, Geburt, Stillen, postpartale Phase und darüber hinaus adressieren.
Quellen
1. Ysrraelit, M.C. and J. Correale, Impact of sex hormones on immune function and multiple sclerosis development. Immunology, 2019. 156(1): p. 9-22.
2. Collongues, N., et al., Testosterone and estrogen in multiple sclerosis: from pathophysiology to therapeutics. Expert Rev Neurother, 2018. 18(6): p. 515-522.
3. Krysko, K.M., et al., Sex effects across the lifespan in women with multiple sclerosis. Ther Adv Neurol Disord, 2020. 13: p. 1756286420936166.
4. Ramien, C., et al., Sex effects on inflammatory and neurodegenerative processes in multiple sclerosis. Neurosci Biobehav Rev, 2016. 67: p. 137-46.
5. Vukusic, S., et al., The Prevention of Post-Partum Relapses with Progestin and Estradiol in Multiple Sclerosis (POPART‘MUS) trial: rationale, objectives and state of advancement. J Neurol Sci, 2009. 286(1-2): p. 114-8.
6. Costanza, M. and R. Pedotti, Prolactin: Friend or Foe in Central Nervous System Autoimmune Inflammation? Int J Mol Sci, 2016. 17(12).
7. Soldan, S.S., et al., Immune modulation in multiple sclerosis patients treated with the pregnancy hormone estriol. J Immunol, 2003. 171(11): p. 6267-74.
8. Jakimovski, D., et al., Greater humoral EBV response may be associated with choroid plexus inflammation in progres- sive MS. J Neurovirol, 2024.
9. Qiu, K., et al., Pregnancy-Related Immune Changes and Demyelinating Diseases of the Central Nervous System. Front Neurol, 2019. 10: p. 1070.
10. Compston, A. and A. Coles, Multiple sclerosis. Lancet, 2008. 372(9648): p. 1502-17.
11. Hawkes, C.H. and A.J. Macgregor, Twin studies and the heritability of MS: a conclusion. Mult Scler, 2009. 15(6): p. 661-7.
12. Goodin, D.S., The epidemiology of multiple sclerosis: insights to a causal cascade. Handb Clin Neurol, 2016. 138: p. 173-206.
13. Moccia, M., et al., Fertility, pregnancy and childbirth in women with multiple sclerosis: a population-based study from 2018 to 2020. J Neurol Neurosurg Psychiatry, 2023. 94(9): p. 689-697.
14. Witt, L., S. Thiel, and K. Hellwig, [Pregnancy and breastfeeding in women with multiple sclerosis]. Nervenarzt, 2024. 95(4): p. 329-334.
15. Oreja-Guevara, C., et al., Assisted Reproductive Techniques in Multiple Sclerosis: Recommendations from an Expert Panel. Neurol Ther, 2023. 12(2): p. 427-439.
16. Sparaco, M., et al., Assisted Reproductive Technology and Disease Management in Infertile Women with Multiple Sclerosis. CNS Drugs, 2023. 37(10): p. 849-866.
17. Azimi, A., et al., Age at menarche and risk of multiple sclerosis (MS): a systematic review and meta-analysis. BMC Neurol, 2019. 19(1): p. 286.
18. Hemmer B. et al. Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen, S2k-Leitlinie, 2023, in: Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. Abrufbar unter: www.dgn.org/leitlinien, (Zugriff: 23.10.2024)
19. Krysko, K.M., et al., Family planning considerations in people with multiple sclerosis. Lancet Neurol, 2023. 22(4): p. 350-366.
20. Thiel, S., et al., Disease activity and neonatal outcomes after exposure to natalizumab throughout pregnancy. J Neurol Neurosurg Psychiatry, 2024. 95(6): p. 561-570.
21. frauen leben 3. Familienplanung im Lebenslauf von Frauen. Eine Studie im Auftrag der BZgA 2016. Abrufbar unter: https://shop.bzga.de/pdf/13300038.pdf, (Zugriff: 24.10.2024)
22. Hellwig, K., et al., Reproductive counselling, treatment and course of pregnancy in 73 German MS patients. Acta Neurol Scand, 2008. 118(1): p. 24-8.
23. Rasmussen, P.V., et al., Patient awareness about family planning represents a major knowledge gap in multiple sclerosis. Mult Scler Relat Disord, 2018. 24: p. 129-134.
24. Smith, A.L., et al., Pregnancy and multiple sclerosis: Risk of unplanned pregnancy and drug exposure in utero. Mult Scler J Exp Transl Clin, 2019. 5(4): p. 2055217319891744.
25. Smith, A.L., et al., Pregnancy and multiple sclerosis: Risk of unplanned pregnancy and drug exposure in utero. Multiple Sclerosis Journal – Experimental, Translational and Clinical, 2019. 5(4): p. 2055217319891744.
26. Dathe, K. and C. Schaefer, The Use of Medication in Pregnancy. Dtsch Arztebl Int, 2019. 116(46): p. 783-790.
27. Profamilia. Pearl-Index. Abrufbar unter: https://www.profamilia.de/themen/verhuetung/pearl-index (Zugriff: 21.11.2024)
28. www.fachinfo.de (Zugriff: 21.11.2024)
29. Bundeszentrale für politische Bildung (BPB); Abrufbar unter: https://www.bpb.de/nachschlagen/zahlen-und-fakten/ soziale-situation-in-deutschland/61556/alter-der-muetter (Zugriff: 21.11.2024)
30. https://www.destatis.de/DE/Presse/Pressemitteilungen/2019/09/PD19_332_122.html. (Zugriff: 21.11.2024)
31. Oreja-Guevara C et al. Reducing Postpartum Relapses: A Proactive Approach. ECTRIMS 2024; P862.
32. Hellwig K et al. B-Cell Levels and Placental Transfer in Infants Potentially Exposed to Ocrelizumab During Pregnancy: Primary Analysis of the Prospective Multicentre, Open-Label Phase IV MINORE Study. ECTRIMS 2024; P087.
33. Confavreux, C., et al., Rate of pregnancy-related relapse in multiple sclerosis. Pregnancy in Multiple Sclerosis Group. N Engl J Med, 1998. 339(5): p. 285-91.
34. Vukusic, S., et al., Pregnancy and multiple sclerosis (the PRIMS study): clinical predictors of post-partum relapse. Brain, 2004. 127(Pt 6): p. 1353-60.
35. Hughes, S.E., et al., Predictors and dynamics of postpartum relapses in women with multiple sclerosis. Mult Scler, 2014. 20(6): p. 739-46.
36. Friedmann, N., S. Thiel, and K. Hellwig, Multiple Sklerose: Therapie bei Kinderwunsch und in der Schwangerschaft. Dtsch Arztebl, 2024. 121(16): p. [13].
37. Hellwig, K., et al., Multiple Sclerosis Disease Activity and Disability Following Discontinuation of Natalizumab for Pregnancy. JAMA Netw Open, 2022. 5(1): p. e2144750.
38. Coyle, P.K., et al., Management strategies for female patients of reproductive potential with multiple sclerosis: An evidence-based review. Mult Scler Relat Disord, 2019. 32: p. 54-63.
39. Schubert, C., et al., Postpartum relapse risk in multiple sclerosis: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry, 2023. 94(9): p. 718-725.
40. Hellwig, K., et al., Final analysis of 379 pregnancy outcomes after exposure to dimethyl fumarate in a prospective international registry. Mult Scler, 2024. 30(2): p. 209-215.
41. Krankheitsbezogenes Kompetenznetz Multiple Sklerose: Qualitätshandbuch MS / NMOSD / MOGAD. 2024; Abrufbar unter: https://ms-qualitaetshandbuch.de/, (Zugriff: cited 25 June 2024
42. Palmeira, P., et al., IgG placental transfer in healthy and pathological pregnancies. Clin Dev Immunol, 2012. 2012: p. 985646.
43. Dobson R et al. Pregnancy and Infant Outcomes in Women with Multiple Sclerosis Receiving Ocrelizumab: Analysis of Approximately 4.000 Pregnancies to Date. ECTRIMS 2024, P085.
44. Bundesministerium für Ernährung und Landwirtschaft. Stillen – Die beste Ernährung in den ersten Lebensmonaten Abrufbar unter: https://www.bmel.de/DE/themen/ernaehrung/gesunde-ernaehrung/schwangerschaft-und-baby/ stillen.html, (Zugriff: 21.11.2024)
45. World Health Organisation (WHO): Infant and young child feeding 2020; Abrufbar unter: https://www.who.int/news- room/fact-sheets/detail/infant-and-young-child-feeding, (Zugriff: 21.11.2024)
46. Anderson, P.O. and J.B. Sauberan, Modeling drug passage into human milk. Clin Pharmacol Ther, 2016. 100(1): p. 42-52.
47. Anderson, P.O., Drugs in Lactation. Pharm Res, 2018. 35(3): p. 45.
48. Alhakamy, N.A. and C.J. Berkland, Glatiramer Acetate (Copaxone) is a Promising Gene Delivery Vector. Mol Pharm, 2019. 16(4): p. 1596-1605.
49. Houtchens, M., et al., Peginterferon beta-1a concentrations in breast milk of lactating multiple sclerosis patients. Mult Scler Relat Disord, 2022. 60: p. 103700.
50. Hegen, H., M. Auer, and F. Deisenhammer, Pharmacokinetic considerations in the treatment of multiple sclerosis with interferon-β. Expert Opin Drug Metab Toxicol, 2015. 11(12): p. 1803-19.
51. Baker, T.E., et al., Transfer of natalizumab into breast milk in a mother with multiple sclerosis. J Hum Lact, 2015. 31(2):
p. 233-6.
52. Bar-Or, A., et al., Clinical Perspectives on the Molecular and Pharmacological Attributes of Anti-CD20 Therapies for Multiple Sclerosis. CNS Drugs, 2021. 35(9): p. 985-997.
53. Ciplea, A.I., et al., Dimethyl fumarate transfer into human milk. Ther Adv Neurol Disord, 2020. 13: p. 1756286420968414.
54. Ciplea, A.I., et al., Monoclonal antibody treatment during pregnancy and/or lactation in women with MS or neuromye- litis optica spectrum disorder. Neurol Neuroimmunol Neuroinflamm, 2020. 7(4).
55. Proschmann, U., et al., Natalizumab during pregnancy and lactation. Mult Scler, 2018. 24(12): p. 1627-1634.
56. Proschmann, U., et al., Drug and Neurofilament Levels in Serum and Breastmilk of Women With Multiple Sclerosis Exposed to Natalizumab During Pregnancy and Lactation. Front Immunol, 2021. 12: p. 715195.
57. Bove R et al. B-Cell Levels and Breastmilk Transfer in Infants of Lactating Women with Multiple Sclerosis Treated with Ocrelizumab: Primary Results of the Prospective, Multicentre, Open-Label, Phase IV Study SOPRANINO. ECTRIMS 2024; P085.
58. Ciplea, A.I., et al., Safety of potential breast milk exposure to IFN-β or glatiramer acetate: One-year infant outcomes.
Neurol Neuroimmunol Neuroinflamm, 2020. 7(4).
59. Giragossian, C., et al., Neonatal Fc receptor and its role in the absorption, distribution, metabolism and excretion of immunoglobulin G-based biotherapeutics. Curr Drug Metab, 2013. 14(7): p. 764-90.
60. Ciplea, A.I. and K. Hellwig, Exposure to natalizumab during pregnancy and lactation is safe – Commentary. Mult Scler, 2020. 26(8): p. 892-893.
61. LaHue, S.C., et al., Transfer of monoclonal antibodies into breastmilk in neurologic and non-neurologic diseases. Neurol Neuroimmunol Neuroinflamm, 2020. 7(4).
Bildquellen
Titel: © sdecoret – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der arztCME-Online-Akademie erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.