Lungenkarzinom: Herausforderungen und Langzeitüberleben beim ES-SCLC
Interessengebiete: Allgemeinmedizin und Innere Medizin, Onkologie, Pneumologie
Das kleinzellige Lungenkarzinom im fortgeschrittenen Stadium (extensive stage Small Cell Lung Cancer, ES-SCLC) ist eine aggressive Form des Lungenkrebses, bei der etwa 60–70 % der Patienten bereits bei Erstdiagnose Metastasen aufweisen. Die systemische Metastasierung, insbesondere im zentralen Nervensystem (ZNS), stellt eine komplexe Herausforderung in der Behandlung dar. Diese Fortbildung beleuchtet das ES-SCLC, die Standard-Erstlinientherapie mit Chemo-Immuntherapie und PD-L1-Inhibitoren sowie deren Wirksamkeit und Sicherheitsprofile. Ein besonderer Fokus liegt auf dem therapeutischen Umgang mit Hirnmetastasen und dem Erreichen von Langzeitüberleben durch individuelles Management von Therapie, Nebenwirkungen und Krankheitsprogress. Zudem werden Kasuistiken und Real-World-Daten diskutiert.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Etwa 60-70 % der Patienten mit kleinzelligem Lungenkarzinom sind bei der Erstdiagnose bereits im fortgeschrittenen Stadium („extensive stage“, ES-SCLC) [1, 2]. Die Erstlinienbehandlung des ES-SCLC erfolgt standardmäßig mit einer Chemo-Immuntherapie und ist dabei insbesondere durch die systemische Metastasierung z. B. im zentralen Nervensystem komplex [1, 2]. Diese CME-Fortbildung stellt die Erkrankung ES-SCLC sowie die Standard-Erstlinientherapieoptionen zur Chemo-Immuntherapie vor und bespricht vertiefend Kasuistiken bzgl. des Diagnoseprozesses und der Therapieumsetzung. Darauf basierend wird im zugehörigen Video im Detail der therapeutische Umgang mit Hirnmetastasen und der zusätzliche Einsatz von Strahlentherapie beim ES-SCLC diskutiert. Ein weiteres Kernthema ist das Erreichen von Langzeitüberleben unter Chemo-Immuntherapie durch individuelles Therapiemanagement, Nebenwirkungsmanagement und den Umgang mit Krankheitsprogress. Zusätzlich beleuchtet der Expertenaustausch die Lebensqualität von Patienten unter Chemo-Immuntherapie.
Epidemiologie des ES-SCLC
Das ES-SCLC beschreibt die aggressive Form des kleinzelligen Lungenkarzinoms („extensive stage“, ES-SCLC), gekennzeichnet durch schnelles, aggressives Tumorwachstum und eine hohe Metastasierungsrate, welche vorwiegend das zentrale Nervensystem, das lymphatische System, Knochen, Leber und Nebennieren betrifft [3]. Bei der Erstdiagnose befinden sich bereits etwa 60-70 % der Patienten im fortgeschrittenen Stadium des kleinzelligen Lungenkarzinoms [1, 2, 3]. Pro Jahr werden weltweit 10-20 Fälle pro 100.000 Menschen verzeichnet, 95 % davon sind mit Tabakkonsum assoziiert und betreffen besonders häufig Patienten zwischen 65-70 Jahren [1]. Die Inzidenz ist zwar bisweilen bei Männern erhöht, die Fallzahlen gleichen sich jedoch innerhalb der letzten Jahre zwischen Frauen und Männern stetig an [1, 4].
Tumorbiologie des ES-SCLC
Das kleinzellige Lungenkarzinom entwickelt sich aus den endokrinen Zellen des Lungenepithels, den APUD-Zellen (Amine Precursor Uptake and Decarboxylation-Zellen), welche sich histologisch vor allem durch einen hyperchromatischen Zellkern und wenig Zytoplasma auszeichnen [3]. Die Tumorgenese ist maßgeblich durch genetische Aberrationen in Onkogenen bzw. Tumorsuppressorgenen wie beispielsweise TP53, RB1 oder MYC getrieben, wobei dadurch vorwiegend Kontrollmechanismen zur Zelldifferenzierung und -proliferation verändert sind [3]. Das resultierende unkontrollierte Wachstum der endokrinen Zellen verursacht nicht nur Raumforderung in der Lunge, sondern auch metabolische Veränderungen durch die dysregulierte Produktion von Hormonen oder hormonähnlichen Biomolekülen [1, 2, 3].
Diese Besonderheit des SCLC kann die Diagnose verkomplizieren, denn Patienten präsentieren häufig paraneoplastische Syndrome [1, 2, 3]. Überwiegend zeigen sich dabei das SIADH (Syndrome of Inappropriate Antidiuretic Hormone Secretion), welches durch inadäquate Sekretion des Antidiuretischen Hormons (ADH) zu Hyponatriämie und Wasserzurückhaltung in den Nieren führen kann, das Cushing-Syndrom, welches durch eine erhöhte Sekretion des Adrenocorticotropen Hormon (ACTH) gesteigerte Kortisolbildung verursacht und das Lambert-Eaton-Syndrom welches sich klinisch durch Muskelschwäche zeigt, verursacht durch eine gestörte Impulsübertragung des peripheren Nervensystems [1, 2].
Diagnostische Maßnahmen beim ES-SCLC
Bei der Diagnose weisen ES-SCLC-Patienten oft tumor-unspezifische Symptomatiken auf, etwa Husten und Dyspnoe sowie weitere unspezifische Symptome z. B. ausgelöst durch die bereits angesprochenen paraneoplastischen Syndrome [1, 2, 3].
Zur Abklärung eignen sich Röntgen- oder CT/PET-CT-Aufnahmen des Thorax und Abdomen (mit Kontrastmittel) sowie Bronchoskopien für den histologischen Befund. Da das SCLC im fortgeschrittenen Stadium komplexe, systemische Metastasierungen verursacht empfehlen sich außerdem Schädel-MRT, zur Abklärung von Hirnmetastasen, und eine Knochenszintigraphie, zur Abklärung von Knochenmetastasen [1, 2]. Zu Beginn der Therapie wird außerdem auf Basis des ECOG PS (Eastern Cooperative Oncology Group Performance Status) der Allgemeinzustand der Patienten bestimmt.
Die Therapie beim ES-SCLC
Die derzeitige Behandlung des ES-SCLC ist, bedingt durch den weiten Krankheitsfortschritt, vorwiegend palliativ und bestenfalls nach Evaluation des Patienten durch ein Tumorboard [1, 2, 3]. Bis 2019 wurden Patienten in der Erstlinie ungezielt mit der Kombination aus Carboplatin und Etoposid behandelt. Die hohe Proliferationsrate des ES-SCLC ging mit einem guten initialen Ansprechen der Patienten einher, jedoch nur kurzzeitig und mit hohem Risiko auf ein Rezidiv [5]. Das 5-Jahresüberleben unter alleiniger Chemotherapie betrug 1,6 % [5].
Die Zulassung des PD-L1-Inhibitors Atezolizumab mit Carboplatin/Etoposid 2019 markierte einen langerwarteten positiven Wendepunkt in der ES-SCLC Therapie. Seit dem sieht die Leitlinie beim ES-SCLC Chemo-Immuntherapie mit PD-L1-Inhibitoren (Checkpoint-Inhibitoren) Atezolizumab oder Durvalumab, zugelassen seit 2020, als Standard in der Erstlinie vor [1, 2]. Die Kombination mit Serplulimab oder Tislelizumab, beides PD-1-Inhibitoren, ist bisher in den Leitlinien nicht empfohlen, beide erhielten aber 2025 die Zulassung der Europäischen Arzneimittel Zulassungsbehörde (EMA) [6, 7]. Die jeweiligen Zulassungsstudien IMpower133 (Atezolizumab), CASPIAN (Durvalumab), ASTRUM-005 (Serplulimab) und RATIONALE-312 (Tislelizumab) zeigen eine Verlängerung des Gesamtüberlebens und des progressionsfreien Überlebens [8, 9, 10, 11].
Die Leitlinien sehen die Chemo-Immuntherapie in der therapeutischen Induktionsphase vor, die Erhaltungstherapie erfolgt auf Basis der alleinigen Immuntherapie [1, 2].
IMpower133 – Phase-III-Zulassungsstudie zu Atezolizumab
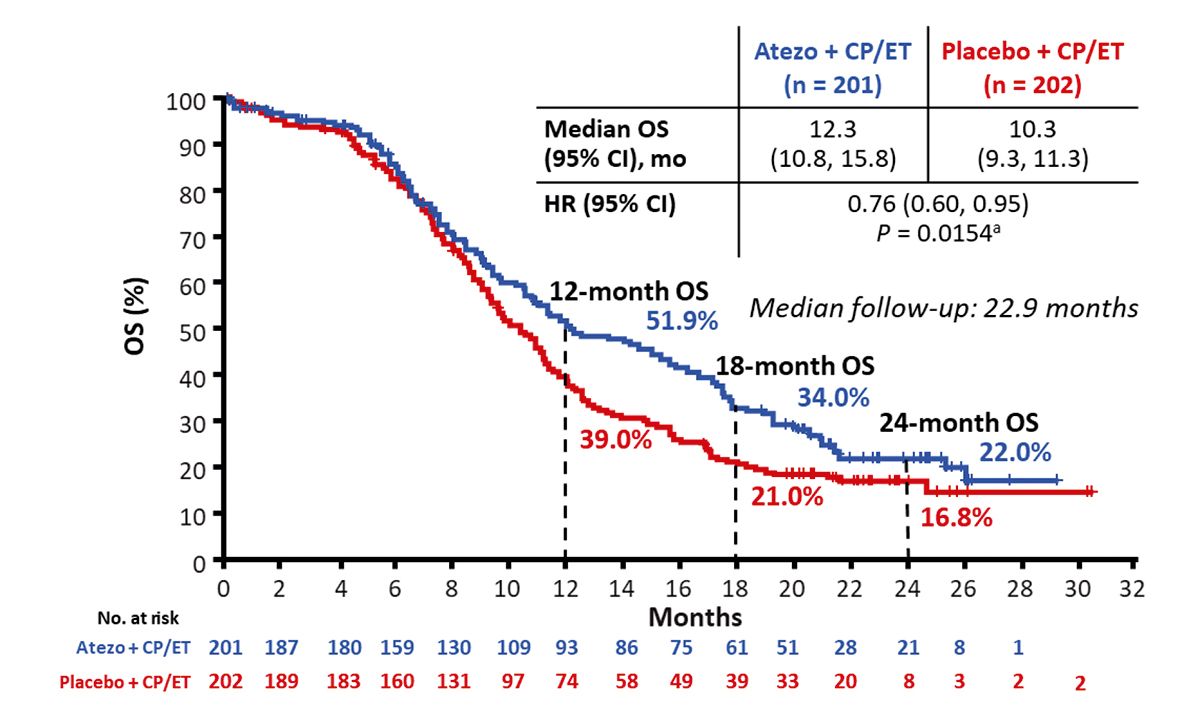
Die doppelblinde, Placebo-kontrollierte IMpower133-Studie [8] betrachtete das progressionsfreie Überleben (PFS) sowie das Gesamtüberleben (OS) von 403 Patienten mit ES-SCLC (ECOG PS 0-1, therapienaives ES-SCLC) unter Chemotherapie mit Carboplatin/Etoposid zuzüglich Atezolizumab oder Placebo in der Induktionsphase für vier 21-Tage Zyklen und einer Erhaltungsphase mit nur Atezolizumab bzw. Placebo. Die Studie zeigte eine signifikante Verringerung des Sterberisikos durch Atezolizumab (HR: 0,76) bei einer Verlängerung des medianen OS (mOS) auf 12,3 Monate verglichen mit 10,3 Monaten in der Placebo-Gruppe [8, 12]. Mit Atezolizumab lag das 1-Jahresüberleben bei 52 % und das 2-Jahresüberleben bei 22 % im Vergleich zu 39 % bzw. 16 % mit Placebo [13]. Das mediane PFS (mPFS) der Atezolizumab-Gruppe lag bei 5,2 Monaten wobei 12,6 % der Patienten 12 Monate progressionsfrei blieben und bei 4,3 Monaten und einer 12-monatigen PFS-Rate von 5,4 % in der Placebo-Gruppe [8].
Auf einen Blick: Als erste Chemo-Immuntherapie verringerte Atezolizumab das Sterberisiko beim ES-SCLC und zeigte gleichzeitig einen PFS-Vorteil [8, 12].
CASPIAN – Phase-III-Zulassungsstudie zu Durvalumab
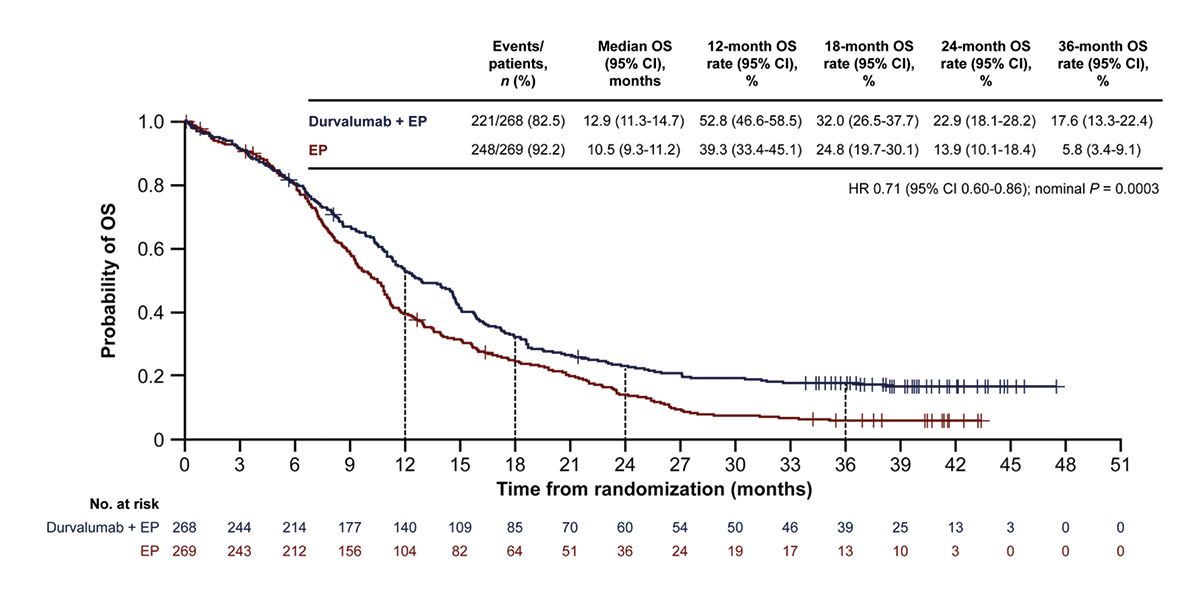
Die CASPIAN-Studie [9] betrachtete das OS für ES-SCLC Patienten (ECOG PS 0-1, keine ES-SCLC-Vortherapien) unter alleiniger Chemotherapie (n = 269, Platinderivat plus Etoposid) oder mit dem Zusatz von Durvalumab (n = 268). Die Induktionstherapie umfasste einen Zeitraum von bis zu 4 Zyklen und kombinierte die Verabreichung von Chemo- und Immuntherapie, die Erhaltungsphase basierte auf reiner Immuntherapie [9]. Nach einem median Follow-up von 39,4 Monaten lag das mOS der Patienten mit Durvalumab bei 12,9 Monaten gegenüber 10,5 Monaten unter alleiniger Chemotherapie. Nach 24 und 36 Monaten waren aus der Durvalumab-Gruppe noch 22,9 % und 17,6 % am Leben vs. 13,9 % und 5,8 % der Patienten ohne Durvalumab (gesamte HR: 0,71). Das mPFS hingegen war von der Zunahme von Durvalumab nicht positiv beeinflusst mit 5,1 Monaten gegenüber 5,4 Monaten [14].
Auf einen Blick: Die Chemo-Immuntherapie mit Durvalumab verringerte das Sterberisiko beim ES-SCLC, zeigte aber keine Verbesserung des PFS gegenüber alleiniger Chemotherapie [9].
ASTRUM-005 – Phase-III-Zulassungsstudie zu Serplulimab
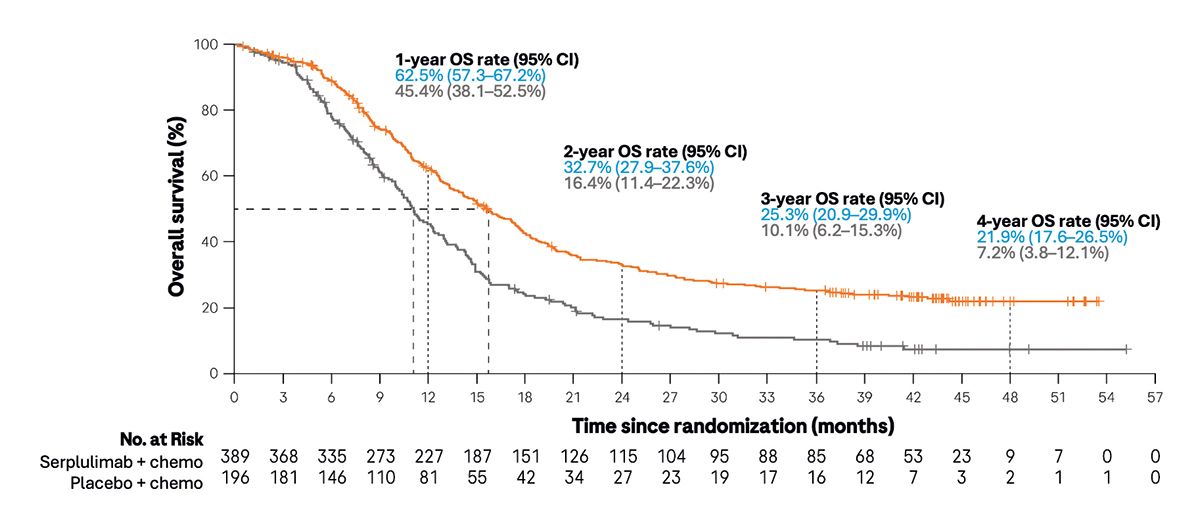
In der ASTRUM-005-Studie [10] wurde die Therapieeffizienz bei ES-SCLC Patienten (ohne vorherige systemische Therapie) von alleiniger Chemotherapie (Carboplatin + Etoposid, Placebo-Gruppe, n = 196) zu Chemotherapie plus Serplulimab (n = 389) bzgl. des Gesamtüberlebens sowie u. a. des progressionsfreien Überlebens und Sicherheit verglichen [10]. Von den Studienteilnehmern waren 127 im Verum-Arm und 57 im Placebo-Arm nicht-asiatischer Herkunft [10]. Die Hinzunahme von Serplulimab verringerte das Sterberisiko der Patienten (HR: 0,60) bei einem mOS von 15,8 Monaten verglichen mit 11,1 Monaten unter alleiniger Chemotherapie. Das mPFS erhöhte sich durch Serplulimab auf 5,8 Monate vs. 4,3 Monate bei alleiniger Chemotherapie (HR: 0,47) [15].
Auf einen Blick: Die Chemo-Immuntherapie mit Serplulimab verringerte das Sterberisiko beim ES-SCLC in einer vorwiegend asiatischen Population gegenüber der alleinigen Chemotherapie [10].
RATIONALE-312 – Phase-III-Zulassungsstudie zu Tislelizumab
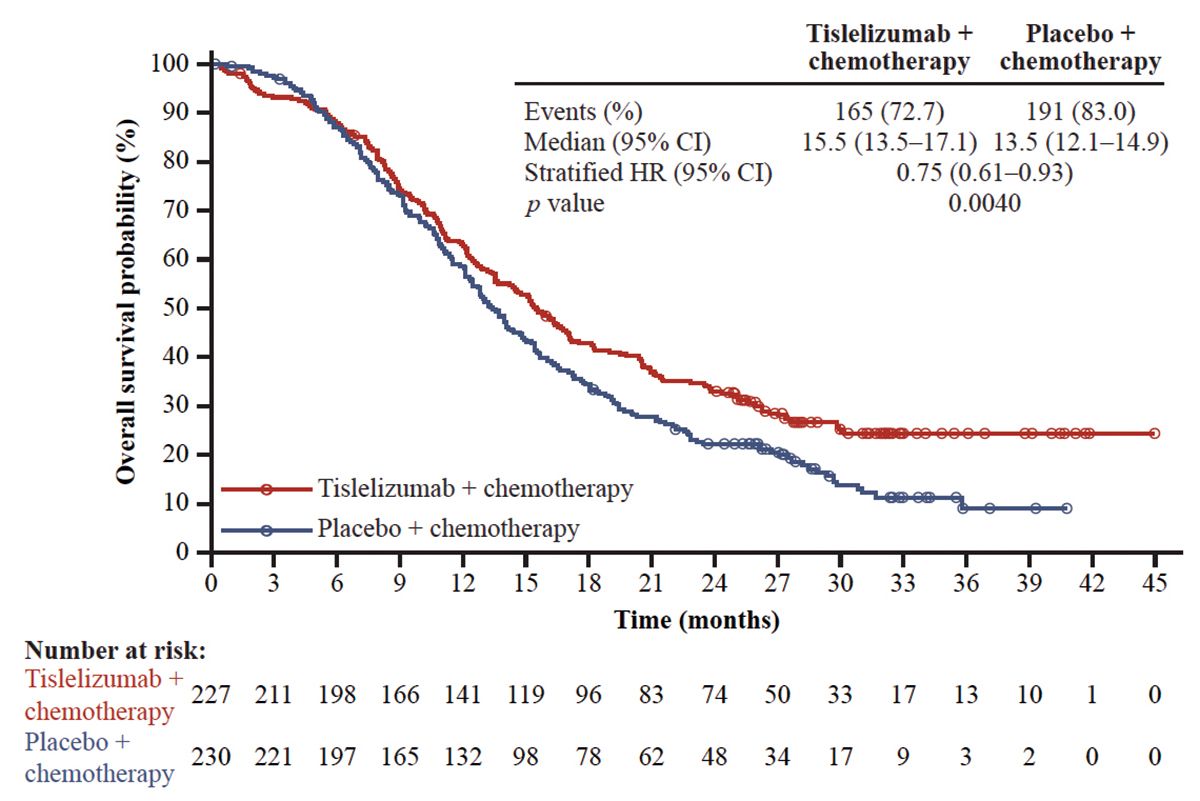
Die chinesische RATIONALE-312-Studie [11] (doppelt-verblindet, randomisiert) evaluierte den Vorteil einer Chemo-Immuntherapie basierend auf Platinderivat plus Etoposid mit Tislelizumab und ausschließlich Tislelizumab in der Erhaltungsphase (n = 227), gegenüber der alleinigen Chemotherapie und Placebo (n = 230). Die Chemo-Immuntherapie erbrachte einen signifikanten Überlebensvorteil gegenüber der alleinigen Chemotherapie (HR = 0,75). Das mOS mit Tislelizumab lag bei 15,5 Monaten gegenüber 13,5 Monaten bei alleiniger Chemotherapie. Das mPFS verlängerte sich unter Chemo-Immuntherapie auf 4,7 Monate im Vergleich zu 4,3 Monaten ohne Tislelizumab (HR: 0,64) [11].
Auf einen Blick: Bei einer vorwiegend asiatischen Population verringerte die Chemo-Immuntherapie mit Tislelizumab das Sterberisiko beim ES-SCLC ohne bedeutenden PFS-Vorteil [11].
Besonderer Fokus bei ES-SCLC auf Hirnmetastasen
Zum Zeitpunkt der Diagnose und damit vor Therapiebeginn, zeigen schon 10 % der ES-SCLC-Patienten Metastasen im zentralen Nervensystem und bis zu 50 % entwickeln im weiteren Krankheitsverlauf Hirnmetastasen, auch unter Therapie und nur bei 15 % der Patienten bleiben die ZNS-Metastasen asymptomatisch [3]. Die Leitlinien empfehlen aus diesem Grund engmaschige Kontrollen des Gehirns mittels MRT (alle 3 Monate im ersten Jahr und alle 6 Monate in nachfolgenden Jahren), sowie zusätzliche Strahlentherapie, um gezielt einem Progress der Hirnmetastasierung entgegenzuwirken [1, 2]. Dargestellt werden dazu unterschiedliche Ansätze: Eine beschriebene Option ist die prophylaktische Schädelbestrahlung (PCI), welche bei Patienten die auf die Erstlinientherapie ansprechen, eingesetzt werden kann [2]. Da die Ganzhirnbestrahlung jedoch auch ein erhöhtes Risiko für neurokognitive Einschränkungen birgt, wird, insofern möglich, für die Behandlung von existierenden Hirnmetastasen die stereotaktische Bestrahlung empfohlen [1].
In die IMpower133-Studie konnten Patienten mit ZNS-Metastasen eingeschlossen werden, sofern diese asymptomatisch und vorbehandelt (durch Bestrahlung und/oder Resektion) waren. Durch die Vorbehandlung der ZNS-Metastasen hat sich der Einschluss dieser Patienten in die Studie verzögert (i.d.R. bis zu 4 Wochen). In dieser Zeit erhielten die Patienten bis zum Studieneinschluss keinerlei systemische Therapie gegen das ES-SCLC [8]. Die IMpower133-Daten zeigten eine Verzögerung der intrakraniellen Progression durch die Verdopplung des PFS sowie eine Risikoreduktion für Hirnmetastasen um 34 % (HR: 0,66) unter Atezolizumab-Therapie in Verbindung mit PCI. Wurden die Patienten nicht prophylaktisch bestrahlt lag die Risikoreduktion bei 28 % [13]. Diese Daten weisen auf eine potenzielle Wirksamkeit von Atezolizumab im ZNS beim ES-SCLC hin.
In der Durvalumab-Zulassungsstudie CASPIAN waren Patienten mit unbehandelten, asymptomatischen sowie Patienten mit stabilen, bereits behandelten ZNS-Mestastasen eingeschlossen Dabei waren 90 % der Patienten mit ZNS-Metastasen in CASPIAN unbehandelt. Eine PCI war im Durvalumab-Arm nicht zugelassen, im Chemotherapie-Arm hingegen erlaubt [9].
Die Subgruppenanalyse zeigte keinen Unterschied bzgl. des OS und des PFS in Abhängigkeit von Hirnmetastasen. Der Anteil an Patienten, der während der Therapie neue Hirnmetastasen entwickelte, war in beiden Studienarmen gleich (Durvalumab: 8,8 %, Platin-Etoposid: 9,5 %). Ebenso der Anteil an Patienten die nachfolgend bestrahlt wurden (Durvalumab: 20,5 %, Platin-Etoposid: 21,2 %), wobei die Bestrahlung häufiger bei Patienten eingesetzt werden musste, die schon zum Studienbeginn Hirnmetastasen aufwiesen [16].
Bei der Nachbehandlung von resezierten ZNS-Metastasen mit Steroiden sind die Wechselwirkungen mit bzw. die suppressiven Effekte auf die Immuntherapie zu beachten.
Studien beim NSCLC zeigen, dass eine Steroidexposition zu Beginn der Chemo-Immuntherapie das Ansprechen, das progressionsfreie Überleben und das Gesamtüberleben deutlich verringern kann [17].
Auf einen Blick: Die Chemo-Immuntherapie, insbesondere mit Atezolizumab, zeigt auch Vorteile bei ZNS-Metastasen, die häufig bei ES-SCLC-Patienten auftreten [13].
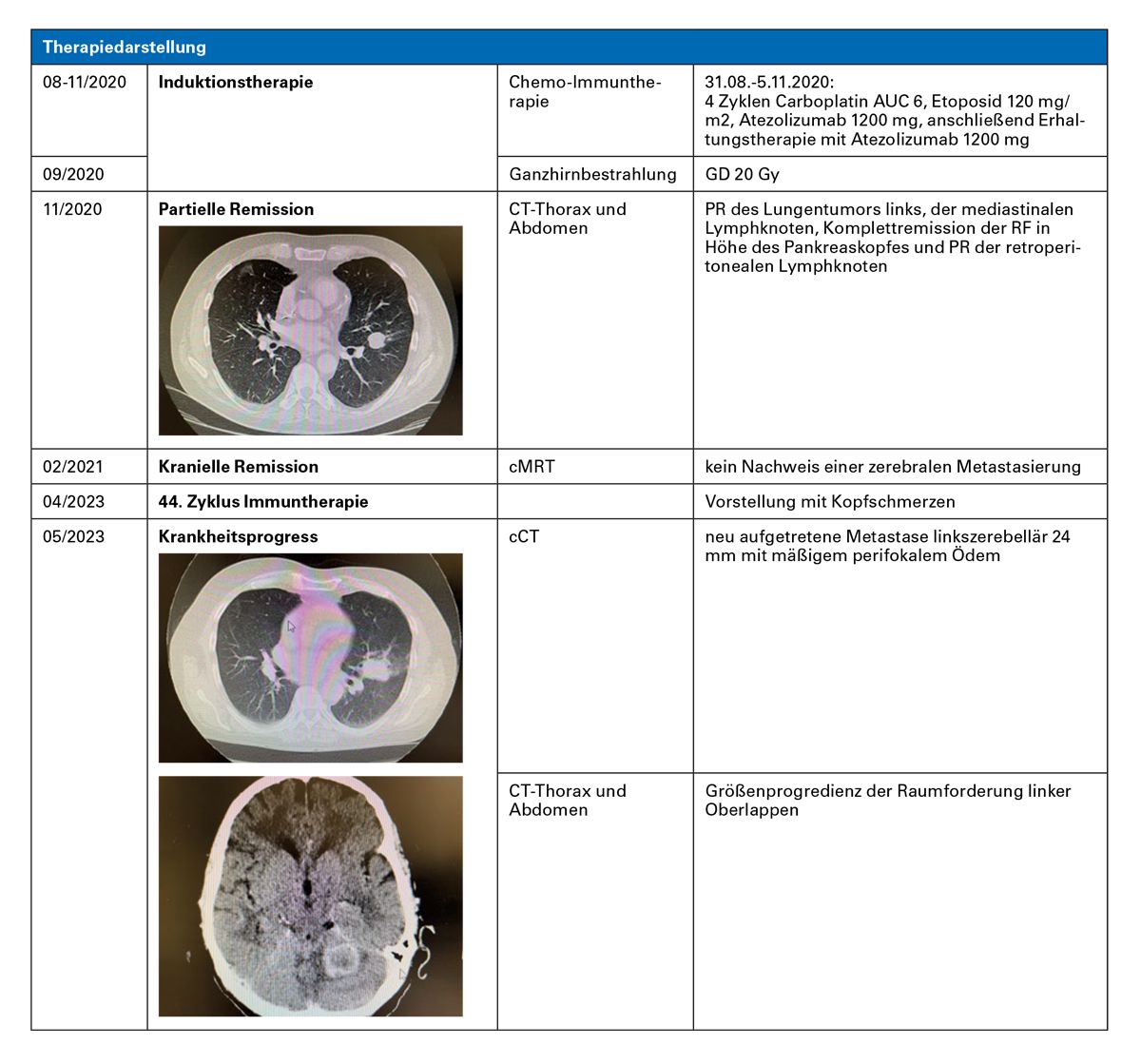
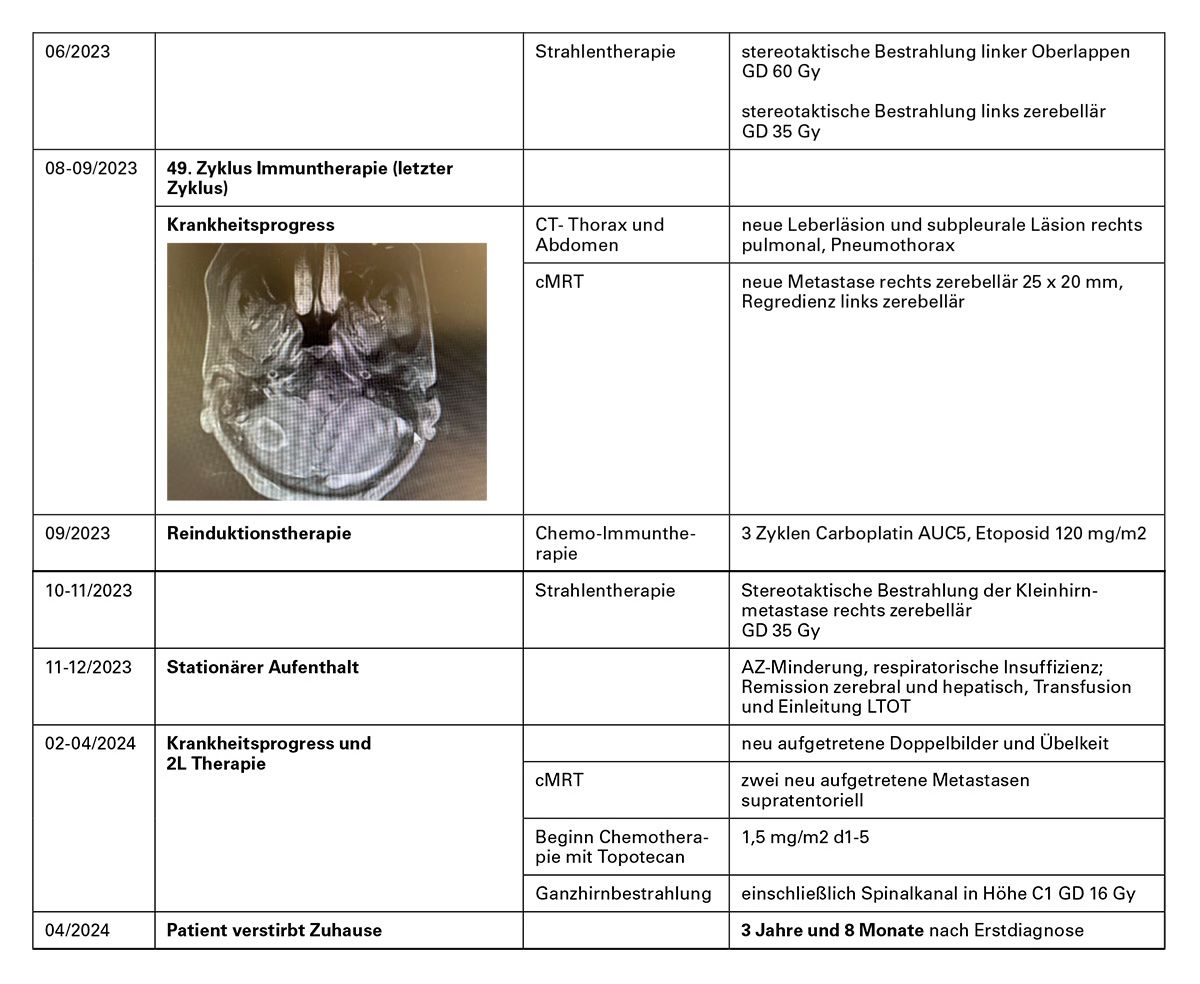
Kasuistik 1 – Kontrolle von Hirnmetastasen beim ES-SCLC mit Chemo-Immuntherapie (Atezolizumab) & Bestrahlung
Dr. Patricia Hortig
Über den Patienten
- Männlich, 65 Jahre
- ECOG 0, BMI 26
- Raucherstatus: Nikotinabusus bis 2016 (20 PY)
- Routinecheck beim Hausarzt Lymphknotenschwellung links supraclavikulär, Appetitlosigkeit seit 2 Monaten, dabei Gewichtsverlust 2kg
- Vorerkrankung: Pleuraempyem 2016, Lungenemphysem, Arterielle Hypertonie, Hypothyreose mit Substitutionstherapie
Diagnoseweg (08/2020)
- CT:RF links hilär 6,5 x 4 x 6cm, Lymphadenopathie links hilär, mediastinal, Oberbauch und links supraclavikulär
- Bronchoskopie: erweiterte Oberlappenkarina links
- CT-Abdomen: Lymphknoten (3,4 cm) auf Höhe des Pankreaskopfes sowie kleinere retroperitoneale Lymphknoten, keine Organmetastasen
- cCT: bds. im Großhirn einschmelzende Herde (bis zu 1 cm), geringes perifokales Ödem einer Metastase links frontoparietal
- cMRT: mehrere supratentorielle Metastasen bis 1 cm Größe
- Labor: LDH 5,6 (NB < 4,2), NSE 40 (NB < 18)
Erstdiagnose (08/2020)
• partiell nekrotischer Tumor, kleinzellig neuroendokrin, Ki 67: 70%, CD 56+, CKMNF+
• cT3 cN3 cM1c, UICC IVB
Therapieentscheidung:
Chemo-Immuntherapie mit Atezolizumab plus CE, Ganzhirnbestrahlung
Fazit: Die Chemo-Immuntherapie (C/E + Atezolizumab) hat bei diesem Patienten innerhalb von etwa 2 Monaten zur Krankheitsremission geführt und diese für knapp 3 Jahre stabilisiert.
Langzeitüberleben unter Immuntherapie
Chemo-Immuntherapien haben ES-SCLC-Patienten einen signifikanten therapeutischen Vorteil verschafft und haben den Anteil an Patienten, die länger mit ES-SCLC leben deutlich erhöht [8, 9, 10, 12, 14, 15]. Inwiefern diese Therapien ein Langzeitüberleben ermöglichen können, wurde für die einzelnen Immuntherapien für einen Zeitraum von bis zu 6 Jahren betrachtet.
Die längste Betrachtung liefert die IMbrella A-Studiea, welche 18 Patienten aus der IMpower133-Studie zu Atezolizumab überführt und nachbeobachtet hat [8, 18]. Eingeschlossen wurden Patienten unter Erhaltungstherapie mit Atezolizumab oder Patienten nach abgeschlossener Erhaltungstherapie unter klinischer Beobachtung. Nach einem Zeitraum von insgesamt 6 Jahren nach Einschluss in die IMpower133 waren noch 10 Patienten am Leben [18].
Der Studienzeitraum der ASTRUM-005-Studie zu Serplulimab war auf 4 Jahre ausgelegt [10, 15]. Bei einem medianen Follow-up von 42,4 Monaten lag die Überlebensrate nach 4 Jahren unter Serplulimab-Therapie bei 21,9 % und im Kontrollarm bei 7,2 % [15]. Die CASPIAN-Studie zu Durvalumab umfasste einen Studienzeitraum von 3 Jahren und zeigte eine Überlebensrate von Patienten in der Durvalumab-Gruppe von 17,6 % am Leben vs. 5,8 % der Patienten ohne Durvalumab [9, 14]. Über den gesamten Studienzeitraum ergab sich ein Überlebensvorteil für Patienten unter Chemo-Immuntherapie und Immunerhaltungstherapie mit Durvalumab von 29 % (gesamte HR: 0,71) [14].
Auf einen Blick: Die Chemo-Immuntherapie erbrachte unvorhergesehen Fortschritte für ES-SCLC-Patienten. Für einige Patienten ist ein Langzeitüberleben möglich [8, 9, 10,18].
Kasuistik 2 – Stabiles Langzeitüberleben durch Immuntherapie (Atezolizumab)
Mohammadali Feizi
Über den Patienten
- Männlich, 65 Jahre
- Raucherstatus: Nikotinabusus beendet vor 20 Jahren (5-7 PY)
- Vorstellung beim Hausarzt: Seit 4 Wochen Erkältung, Gewichtsabnahme von 5 kg, Hämoptyse beim Husten, AZ-Reduktion, Leistungsknick; Röntgen-Thorax VD auf pulmonale RF
- Vorerkrankung: Arterielle Hypertonie, linksventrikuläre Hypertrophie, chronische Myokardinsuffizinz (HFpEF, EF 55%), diastolische Dysfunktion Grad 1, Unterschenkelvarikosis bds.
Diagnoseweg (10/2020)
- Röntgen-Thorax: RF links zentral
- CT-Thorax: Pneumonie OL links und RF links zentral
- PET-CT: Ossäre Metastasierungen (BWK5/12, LWK1, in Höhe des Pfannendaches des rechten Hüftgelenkes)
- MRT-Schädel: Keine Metastasierung
- Bronchoskopie und Histologie: SCLC
- Labor: NSE 61 μg/l (NB <19,5), CEA 23,6 ug/l (NB <5,0), CYFRA 21-1, 34,8 ng/ml (NB <3,0)
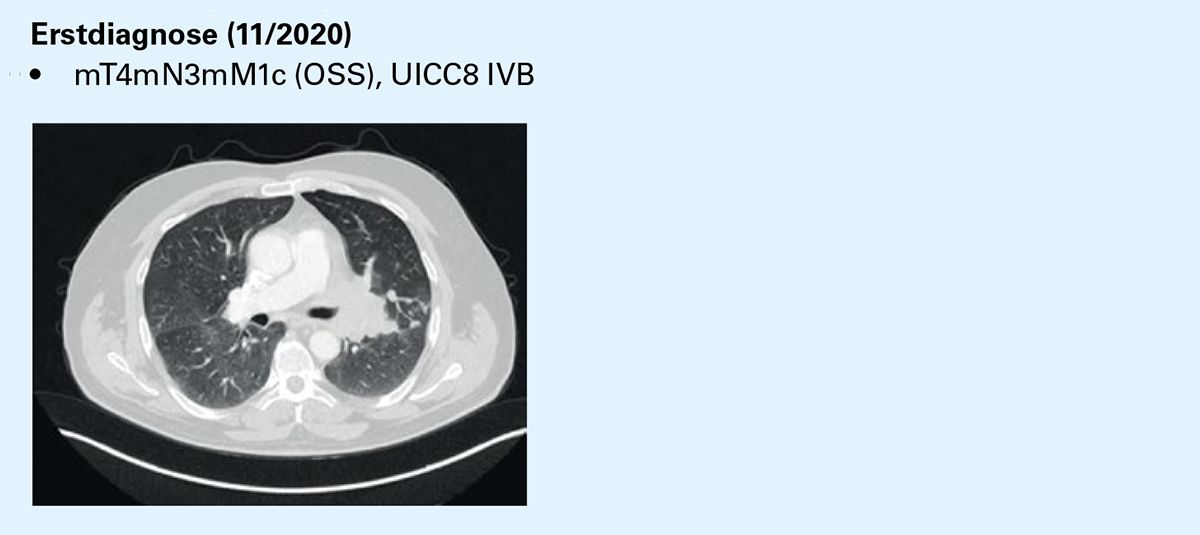
Erstdiagnose (11/2020)
• mT4mN3mM1c (OSS), UICC8 IVB
Therapieentscheidung:
Chemo-Immuntherapie mit Atezolizumab plus Carboplatin-Etoposid, Antiresorptive Therapie mit Denosumab, Antibiotikum-Therapie bei Pneumonie
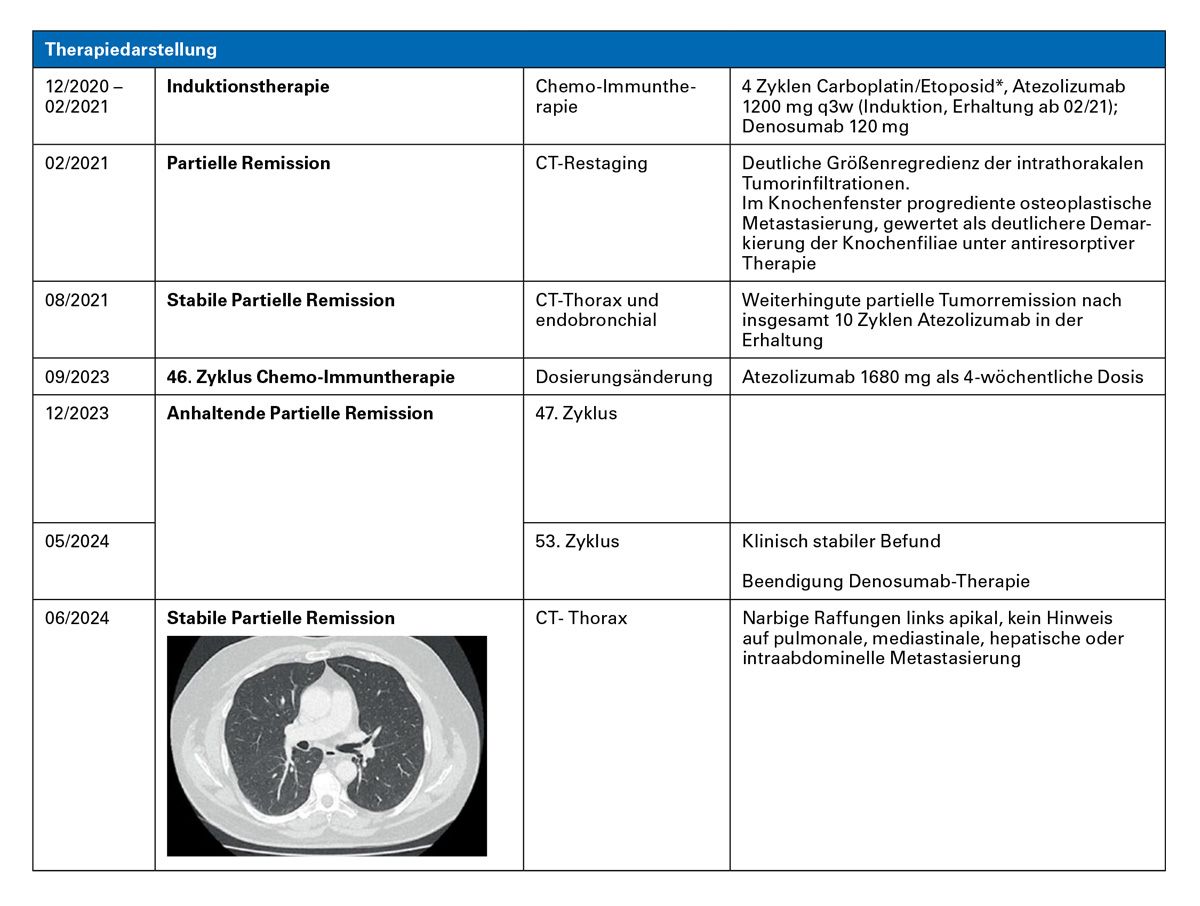
Fazit: Der Patient hat unter Chemo-Immuntherapie mit Carboplatin/Etoposid und Atezolizumab innerhalb von etwa 4 Monaten eine Krankheitsremission erreicht und ist unter Erhaltungstherapie mit Atezolizumab bis heute stabil. Immunsystem-assoziierte Nebenwirkungen traten nach etwa 18 Monaten auf, ließen sich aber zügig kontrollieren.
Real-World-Daten zur Chemo-Immuntherapie
Real-World-Daten (RWD) geben einen bedeutenden Einblick in den Praxisalltag für Therapieregime und betrachten meist eine heterogenere Gruppe an Patienten als die entsprechenden Zulassungsstudien
Das CRISP-Register (Clinical Research platform Into molecular testing, treatment and outcome of [non-]Small cell lung carcinoma Patients) erfasst Daten aus dem nationalen onkologischen Versorgungsalltag beim Lungenkarzinom (kleinzellig und nicht-kleinzellig, Stadien I-IV) und bereitet diese auf. Das Register umfasst Patienten-Charakteristika inklusive der Ergebnisse molekularer Testungen und Outcome-Parameter zur Krankheits- und Therapieevaluation.
Auf Basis der gesammelten Daten können deskriptive Analysen zu Therapieregimen durchgeführt werden, wie z. B. die Real-World-Analyse zum 3-Jahresüberleben unter Atezolizumab mit dem Ziel den Bestand der Studiendaten aus der IMpower133 in der Behandlungsrealität zu bewerten [8, 19]. Betrachtet wurden dafür Patienten mit einem ECOG PS 0-1, zwischen September 2019 – Februar 2023 entweder unter Chemo-Immuntherapie (n = 282) oder unter alleiniger Chemotherapie (n = 52). Initial fällt auf, dass die Kohorte mit alleiniger Chemotherapie vorwiegend ältere Patienten mit einem ECOG PS von 1 umfasste [19]. Unter Real-World Bedingungen wird ein mOS von 11,5 Monaten und ein mPFS von 6,4 Monaten für die Atezolizumab-Gruppe beobachtet, wobei 47,8 % der Patienten nach einem Jahr noch am Leben waren. In der Chemotherapie-Gruppe lag das mOS bei 9,3 Monaten sowie das mPFS bei 5,7 Monaten, mit einer 12-Monats-Überlebensrate von 36,0 % [19]. Die Überlebensrate nach 2 bzw. 3 Jahren lag bei 23,5 % und 15,3 % bei Chemo-Immuntherapie mit Atezolizumab und bei jeweils 3,3 % unter alleiniger Chemotherapie [19].
Auch für Durvalumab liegen RWD vor. Die LUMINANCE-Studie betrachtete 152 Patienten, die in der Erstlinie eine Chemo-Immuntherapie mit Durvalumab erhielten [20]. Die Studie lief ohne Vergleichsarm und der primäre Studienendpunkt war die Tumorprogression. Das mPFS lag in dieser Studie bei 6,2 Monaten, das mOS bei 13,1 Monaten. Die Daten zum Sicherheitsprofil der Therapie aus der CASPIAN Studie wurden in den RWD bestätigt [20].
Auf einen Blick: Für die Chemo-Immuntherapie mit Atezolizumab und Durvalumab liegen RWD vor, die auf eine ähnliche Effektivität bezüglich des OS und PFS hinweisen. Dies gilt auch für die Sicherheitsprofile. Die Real-World-Ergebnisse unterstreichen somit die Bedeutung der Chemo-Immuntherapie für ES-SCLC-Pateinten [19, 20].
Sicherheitsprofile und Lebensqualität unter Chemo-Immuntherapie
In der Regel treten Nebenwirkungen der Chemo-Immuntherapie innerhalb der ersten 2 Wochen bis hin zu 4 Monaten auf, abhängig von den betroffenen Organsystemen. Dabei zeigte eine Meta-Analyse, dass vor allem schwere Nebenwirkungen (Grad ≥ 3) verzögert auftreten können, bei Checkpoint-Inhibitoren nach bis zu 7 Monaten [21]. Die Zulassungsstudien der Immuntherapien Atezolizumab, Durvalumab, Serplulimab und Tislelizumab berichteten keine signifikanten Veränderungen der Sicherheitsprofile im Vergleich zur alleinigen Chemotherapie [8, 9, 10, 11]: Der Zusatz von Atezolizumab erzeugte keine höhere Rate an unerwünschten Ereignissen (UE) ≥ Grad 3. 39,9 % der Patienten zeigten immunvermittelte Nebenwirkungen mit Atezolizumab, 24,5 % ohne [8]. Es wurde zwischen Induktionsphase und Erhaltungsphase eine ähnliche Rate UEs beobachtet [22]. Als häufige Nebenwirkungen unter Hinzunahme von Atezolizumab wurden Hautausschlag und Hypothyreoidismus verzeichnet [8]. Das Sicherheitsprofil unter Atezolizumab blieb auch bei Langzeitgabe stabil [18]. Durvalumab zeigte ebenfalls kein signifikant verändertes Sicherheitsprofil für die Chemo-Immuntherapie: die alleinige Chemotherapie als auch die Chemo-Immuntherapie verursachten bei 65 % der Patienten Nebenwirkungen ≥ Grad 3, wobei Neutropenie und Anämie einen Hauptanteil ausmachten. In 20 % der Patienten unter Durvalumab-Therapie traten immunvermittelte Nebenwirkungen auf, wohingegen 7 % in der Placebo-Gruppe verzeichnet wurden [23]. In der 3-Jahresanalyse bestätigte sich das bekannte Sicherheitsprofil für Durvalumab für die Langzeitadministration [9]. Für die Chemo-Immuntherapie mit Serplulimab wurden auch nach 4 Jahren keine neuen Sicherheitssignale identifiziert. Die Therapie verursachte bei 35 % der Patienten Nebenwirkungen ≥ Grad 3 im Vergleich zu 29,1 % ohne zusätzliche Immuntherapie [9].
Die Leitlinien empfehlen die Behandlung mit Chemo-Immuntherapie bei Patienten mit zusätzlichen chronisch-entzündlichen Erkrankungen oder Autoimmunerkrankungen, je nach Krankheitsschwere abzuwägen [1, 2]. Während sich das Therapieansprechen dieser Patienten nicht bedeutend unterscheidet, wurde in bis zu 50 % der Patienten ein Entzündungsschub der Autoimmunerkrankung ausgelöst [24]. Die Lebensqualität (quality of life, QoL) der Patienten wurde durch die Chemo-Immuntherapie aber deutlich verbessert. Für die Patientenkohorte der doppelt-verblindeten IMpower133-Studie liegt eine umfassende QoL-Analyse auf Basis der beobachteten Nebenwirkungen und Patientenfragebögen vor [22]. Die Daten unterstrichen dass die Hinzunahme von Atezolizumab das Sicherheitsprofil der Therapie im Vergleich zu alleiniger Chemotherapie (Carboplatin/Etoposid), sowie die QoL der Patienten nicht negativ beeinflusst [22]. Im Gegenteil zeigt die Auswertung eine Verbesserung der gesundheitsbezogenen Lebensqualität mit Atezolizumab – die Studie liefert als einzige doppelt verblindete QoL-Daten zur Chemo-Immuntherapie [22]. Die Auswertung von Patientenberichten zu Durvalumab zeigen, dass die QoL der Patienten unter der Chemo-Immuntherapie erhalten wurde und darüber hinaus Verschlechterung von Symptomen und resultierenden Einschränkungen maßgeblich reduziert werden konnten [25]. Damit verbindet die Chemo-Immuntherapie als Standard-Erstlinientherapie beim ES-SCLC Wirksamkeit mit Sicherheit und Lebensqualität für die Patienten [8, 9, 22, 25].
Auf einen Blick: Gegenüber der alleinigen Chemotherapie zeigten die Chemo-Immuntherapien keine signifikanten Veränderungen, erhöhen jedoch den Anteil an immunvermittelten Nebenwirkungen.
Therapie nach Progress
Die Zulassungsstudien zu den Chemo-Immuntherapien verdeutlichen, dass auch unter Therapie ein Großteil der Patienten innerhalb des ersten Therapiejahres einen Progress erfährt: Atezolizumab nach median 5,2 Monaten, Durvalumab nach median 5,1 Monaten, Serplulimab nach median 5,8 Monaten [8, 10, 14].
Unter diesen Umständen kann eine hohe Flexibilität bei der Therapiegestaltung für die Patientencompliance vorteilhaft sein. Die Chemo-Immuntherapie mit Atezolizumab kann als einzige Immuntherapie laut Fachinformation nach Ermessen des behandelnden Arztes bei Progress weiterverabreicht werden und bietet verschiedene Dosierungsoptionen (q2w, q3w, q4w) als auch die Möglichkeit auf eine subkutane Administration umzusteigen, wodurch dieses Therapieregime flexibel an die Bedürfnisse des jeweiligen Patienten angepasst werden kann, vor allem in der Erhaltungsphase [26]. Die Therapieflexibilität bei Durvalumab und Tislelizumab ergibt sich aus der Auswahl des eingesetzten Platinderivats (Cisplatin oder Carboplatin) in der Induktionsphase [27].
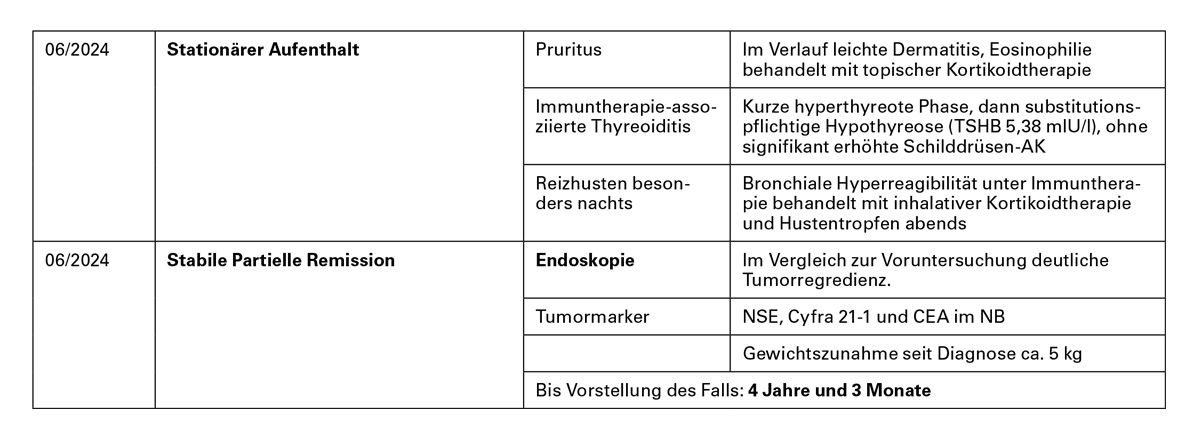
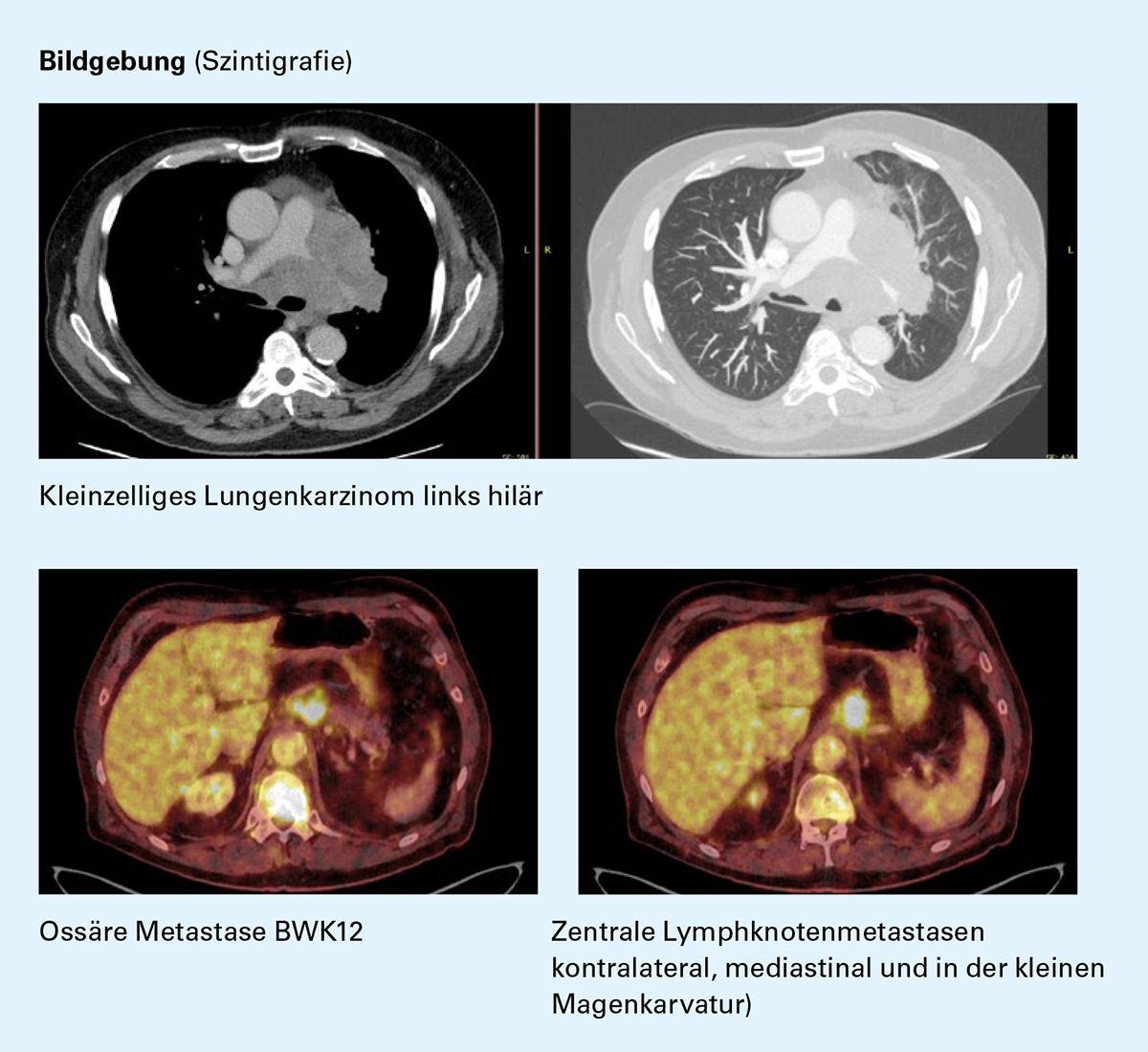
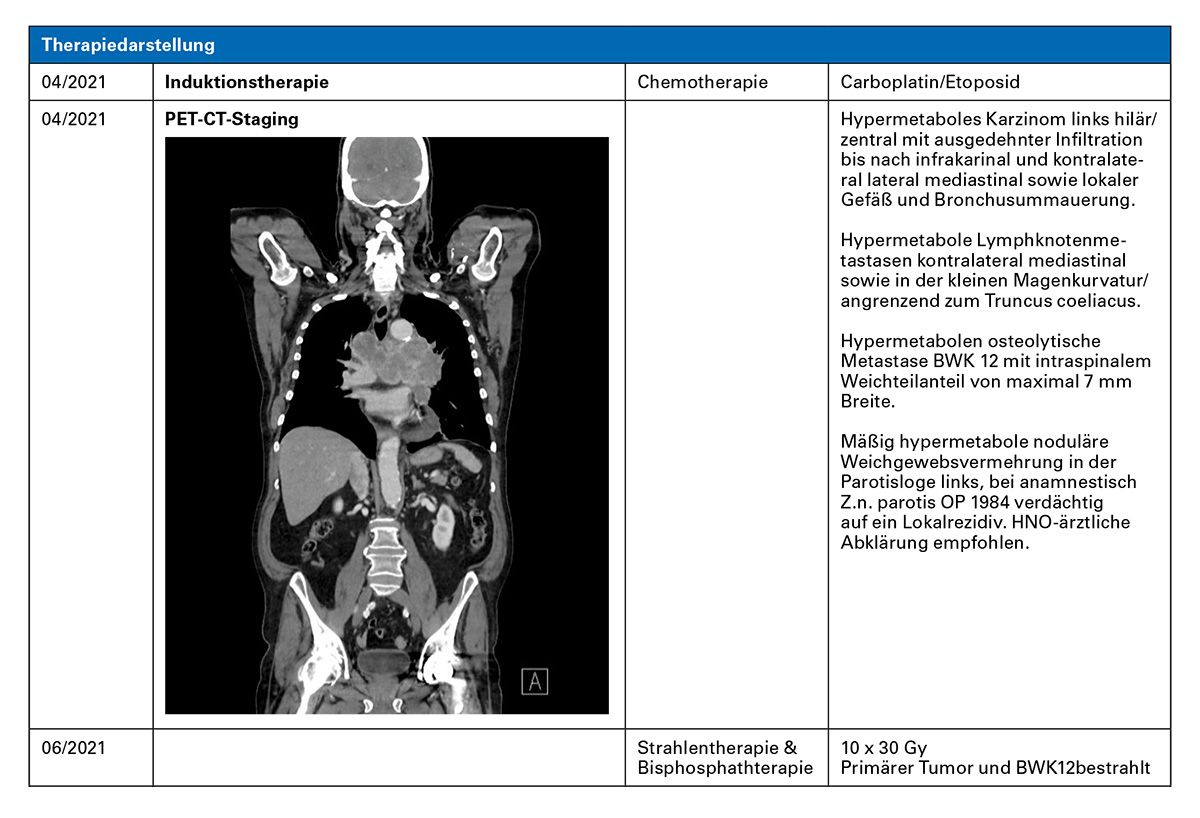
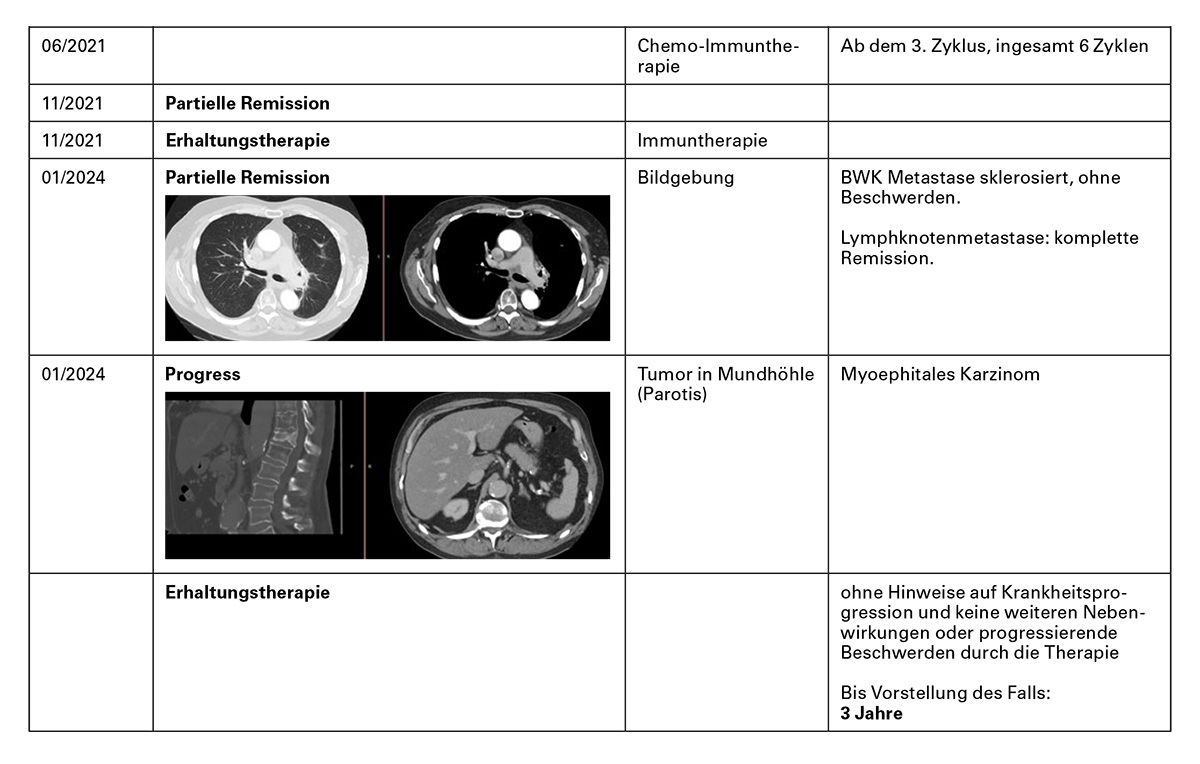
Kasuistik 3: Gut verträgliche Erhaltungstherapie mit Atezolizumab
Dr. med. Jens Kern
Über den Patienten
- Männlich, 72 Jahre
- Raucherstatus: Raucherhistorie (30 PY)
- Vorstellung beim Hausarzt mit Hyponatriämie bis min. 130 mmol/l (SIADH vermutet) – weitere Diagnostik beauftragt
- Vorerkrankung: Belastungsdyspnoe, progredient seit Januar 2021, Arterielle Hypertonie, Ohrspeicheldrüsen-OP, Augen-OP bei Netzhautablösung 2014
Diagnoseweg (03/2021)
cMRT: unauffällig
Erstdiagnose (03/2021)
• Kleinzelliges Lungenkarzinom, Stadium: IVb
Therapieentscheidung:
Induktion: Alleinige Chemotherapie/Chemo-Immuntherapie und Erhaltungstherapie
Fazit: Der Patient hat auch trotz verzögertem Beginn der Immuntherapie langfristig von der Chemo-Immuntherapie und der Erhaltungstherapie profitiert. Zusätzliche Bestrahlung der Knochenmetastase im BWK 12 erreicht eine beschwerdefreie Remission. Nach Entfernung eines myoephitalen Karzinoms befand sich der Patient in stabiler Remission ohne zusätzliche Nebenwirkungen.
Fazit und Ausblick
Die Betrachtung von Real-World-Daten zu den zugelassenen Therapieregimen, die den tatsächlichen Praxisalltag abbilden können, kann wertvolle Informationen zum Einsatz der Chemo-Immuntherapie bei ES-SCLC liefern. Dabei bleibt abzuwarten ob molekulare Daten über den Tumor und das Therapieansprechen, Therapieentscheidungen und -anpassungen erleichtern können. Der Ansatz verschiedene Immun-Checkpoint-Inhibitoren zu kombinieren, blieb bisher ohne Erfolge. Die CASPIAN Studie betrachtete zusätzlich die Kombination von Durvalumab und Tremelimumab (anti-CTLA-4 Antikörper), zeigte für den ES-SCLC bezüglich OS und PFS keinen Vorteil [9, 28]. Auch die Kombination von Atezolizumab und Tiragolumab (anti-TIGIT) zeigte in der SKYSCRAPER-02 keinen relevanten, klinischen Vorteil [29]. Großes Potential für die Erhaltungstherapie in der Erstlinie beim ES-SCLC zeigt hingegen die Addition von Lurbinectedin zu Atezolizumab [30]. Aktuell laufende klinische Studien evaluieren Therapieansätze, die die Immun-Checkpoint-Inhibition mit weiteren Targets wie Fucosyl-GM1, TIGIT oder bi-spezifischer T-Zell-Engager kombinieren, und weitere Kombinationsansätze wie Lurbinectedin mit oder ohne Irinotecan und anti-Trop-2 plus Irininotecan [31, 32, 33, 34, 35, 36]. In den USA ist der bi-spezifische T-Zell-Engager Tarlatamab derzeit in der Zweitlinie nach Platin-basierter Chemotherapie zugelassen und bringt einen signifikanten Vorteil für das Gesamtüberleben gegenüber der weitergeführten Chemotherapie [37]. Zusätzlich wird aktuell auch die Kombination von Durvalumab und Tarlatamab als Option für die Erhaltungsphase der Chemo-Immuntherapie evaluiert [38]. Mit der Einführung des Lungenkrebsscreenings als eine Vorsorgeuntersuchungsmaßnahme in Deutschland, geplant für April 2026, steigt das Potential SCLC frühzeitig zu erkennen und zu behandeln, womit mehr Patienten Langzeitüberleben ermöglicht werden könnte [39].
a Zu den Limitationen dieser Analyse gehören die geringe Anzahl an Patienten, die in die Untersuchung aufgenommen wurden (n = 18), mögliche Verzerrungen von Studienergebnissen und die fehlende Erhebung von Daten zur Tumorbeurteilung in IMbrella A. Im IMpower133-Vergleichsarm fehlen Langzeit-Nachbeobachtungsdaten, da eine Aufnahme in die Untersuchung nicht erlaubt war. Darüber hinaus haben acht Patienten (30,8 %) die Analyse nicht fortgesetzt und wurden zum letzten bekannten Überlebensdatum zensiert. Es wurde davon ausgegangen, dass die Entscheidung für die Teilnahme an IMbrella A unabhängig vom späteren Sterberisiko der Patienten war. Da in der Verlängerungsstudie kein formeller Hypothesentest durchgeführt wurde, ist es außerdem schwierig, klare Schlussfolgerungen zu ziehen.
Referenzen
1. Onkopedia Lungenkarzinom, kleinzellig (Bleckmann et al., Stand 2025); https://www.onkopedia.com/de/onkopedia/guidelines/lungenkarzinom-kleinzellig-sclc/@@guideline/html/index.html (zuletzt aufgerufen am 14.10.2025).
2. S3-Leitlinie Prävention, Diagnostik, Therapie und Nachsorge des Lungenkarzinoms, März 2025; https://hub.leitlinienprogramm-onkologie.de/leitlinie/praevention-diagnostik-therapie-und-nachsorge-des-lungenkarzinoms (zuletzt aufgerufen 12.08.2025).
3. Rudin CM et al., Nature Reviews, Disease Primers, 2021;7:3.
4. Zentrum für Krebsdaten, https://www.krebsdaten.de/Krebs/DE/Content/Krebsarten/Lungenkrebs/lungenkrebs_node.html (zuletzt aufgerufen 12.08.2025).
5. Arriola E et al., JTO Clin Res Rep. 2021;3(1):100266.
6. European Medicines Agency, https://www.ema.europa.eu/en/medicines/human/EPAR/hetronifly (zuletzt aufgerufen 12.08.2025).
7. European Medicines Agency, https://www.ema.europa.eu/en/medicines/human/EPAR/tevimbra (zuletzt aufgerufen 03.09.2025).
8. Horn L et al., N Engl J Med 2018;379:2220-2229.
9. Paz-Ares L et al., The Lancet, Volume 394, Issue 10212, 1929 – 1939.
10. Cheng Y et al., JAMA. 2022 Sep 27;328(12):1223-1232.
11. Cheng Y et al., Journal of Thoracic Oncology 2024, Volume 19, Issue 7, 1073 – 1085.
12. Reck et al., ESMO 2019, Oral Presentation.
13. Higgins K et al. IMpower133 Progression Patterns. ASTRO 2020.
14. Paz-Ares L et al., ESMO Open 2022;7(2):100408.
15. Cheng et al., ASCO 2025, Abstract 8093.
16. Chen Y et al. JTO Clin Res Rep. 2022;3(6):100330.
17. Polyakov L et al., Cancer Res Commun 2025;5(7):1082-1094.
18. Kao S et al., ESMO Asia 2024, Poster-Nr. 1057
19. Waller CF et al. Annual Meeting DGHO 2024, Basel, Poster-Nr. 164
20. Reinmuth N et al., Immuno-Oncology and Technology, Volume 20, 100692.
21. Tang S-Q et al., Cancer Res Treat. 2020;53(2):339–354.
22. Mansfield AS et al., Ann Oncol. 2020;31(2):310-317.
23. Paz-Ares et al., ASCO Annual Meeting 2020. Oral Presentation.
24. Lopez-Olivio MA et al., Cancers (Basel). 2023;15(15):4004.
25. Goldmann JW et al., Lung Cancer. 2020;149:46-52.
26. Fachinformation Atezolizumab [Verfügbar unter: https://www.fachinfo.de/fi/detail/021700, Stand Juni 2025]. Letzter Zugriff 09.09.2025.
27. Al-Salama ZT, Target Oncol. 2021;16(6):857–864.
28. Killock et al., Nat Rev Clin Oncol 18, 64.
29. Rudin et al., J Clin Oncol. 2024;42(3):324-335.
30. Paz-Ares L et al., The Lancet, Volume 405, Issue 10495, 2129 – 2143.
31. Studien-ID: 2024-515047-31-00, HLX10-020-SCLC302, https://euclinicaltrials.eu/ctis-public/view/2024-515047-31-00?lang=en zuletzt aufgerufen 13.08.2025)
32. Studien-ID: 2024-515740-23-00, CA245-001, https://euclinicaltrials.eu/ctis-public/view/2024-515740-23-00?lang=en(zuletzt aufgerufen 13.08.2025)
33. Studien-ID: 2024-515884-69-00, GS-US-600-6165, https://euclinicaltrials.eu/ctis-public/view/2024-515884-69-00?lang=en (zuletzt aufgerufen 13.08.2025)
34. Studien-ID: 2023-503517-30-00, MK-7684A-008, https://euclinicaltrials.eu/ctis-public/view/2023-503517-30-00?lang=en (zuletzt aufgerufen 13.08.2025)
35. Studien-ID: 2024-513559-34-00, PM1183-C-008-21, https://euclinicaltrials.eu/ctis-public/view/2024-513559-34-00?lang=en (zuletzt aufgerufen 13.08.2025)
36. Studien-ID: NCT06211036, https://clinicaltrials.gov/study/NCT06211036 (zuletzt aufgerufen 13.08.2025)
37. Mountzios G et al., N Engl J Med 2025;393:349-36.
38. Studien-ID: NCT06211036, https://clinicaltrials.gov/study/NCT06211036 (zuletzt aufgerufen 14.10.2025)
39. Pressemitteilung Gemeinsamer Bundesausschuss, https://www.g-ba.de/presse/pressemitteilungen-meldungen/1263/ (zuletzt aufgerufen 13.08.2025)
Bildquellen
Titelbild © Kate – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.