Leben mit MS und Überlegungen zur Therapieplanung
Interessengebiete: Allgemeinmedizin und Innere Medizin, Neurologie
Die Multiple Sklerose (MS) wird meistens im Alter zwischen 25 und 34 Jahren diagnostiziert, einem Zeitpunkt mitten im Berufsleben, an dem auch die Familienplanung oftmals noch nicht abgeschlossen ist. In den letzten Jahren hat sich die Therapielandschaft der MS durch die zunehmende Verfügbarkeit krankheitsmodifizierender Therapien, mit denen eine gute Kontrolle der Krankheitsaktivität erreicht werden kann, deutlich erweitert. Eine zentrale Herausforderung besteht daher heute nicht mehr in der Auswahl irgendeiner Therapie, sondern in der strategischen, personalisierten Auswahl der richtigen Therapie zum richtigen Zeitpunkt.
Ziel dieser CME ist es, einen umfassenden und praxisnahen Überblick über die aktuellen Therapieoptionen, wesentliche Entscheidungsfaktoren sowie Sicherheitsaspekte im klinischen Alltag zu geben.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Als chronisch-entzündliche Autoimmunerkrankung des zentralen Nervensystems begleitet die Multiple Sklerose (MS) die Betroffenen ein Leben lang. Diagnostiziert wird die MS meistens im Alter zwischen 25 und 34 Jahren, einem Zeitpunkt mitten im Berufsleben, an dem auch die Familienplanung oftmals noch nicht abgeschlossen ist [1]. In den letzten Jahren hat sich die Therapielandschaft der MS durch die zunehmende Verfügbarkeit krankheitsmodifizierender Therapien (DMT, disease-modifying therapy) deutlich erweitert, mit denen eine gute Kontrolle der Krankheitsaktivität erreicht werden kann. Eine zentrale Herausforderung besteht daher heute nicht mehr in der Auswahl irgendeiner Therapie, sondern in der strategischen, personalisierten Auswahl der richtigen Therapie zum richtigen Zeitpunkt. Ziel dieser CME ist es, einen umfassenden und praxisnahen Überblick über die aktuellen Therapieoptionen, wesentliche Entscheidungsfaktoren sowie Sicherheitsaspekte im klinischen Alltag zu geben.
Therapieüberblick und Klassifikation
Zum Zeitpunkt dieser Veröffentlichung (07/2025) sind insgesamt 21 Therapieoptionen zur Behandlung der schubförmig verlaufenden (remittierenden) MS [(R)RMS] zugelassen, daneben befinden sich weitere Substanzen in der klinischen Entwicklung. Zu den Injektionstherapien zählen verschiedene Interferon beta-Präparate, Glatirameracetat und monoklonale Antikörper wie Natalizumab, Ocrelizumab und Ofatumumab. Die oralen Therapien umfassen Dimethylfumarat, Diroximelfumarat, Teriflunomid, Cladribin sowie die Sphingosin-1-Phosphat-(S1P)-Rezeptor-Modulatoren Fingolimod, Ozanimod und Ponesimod. Im Bereich der Infusionstherapien stehen monoklonale Antikörper wie z. B. Natalizumab, Ocrelizumab, Alemtuzumab und Ublituximab zur Verfügung. Gegenüber kontinuierlichen Therapien weisen einige Wirkstoffe, wie z. B. Cladribin und Alemtuzumab, ein gepulstes Dosierungsschema mit langanhaltender Wirkung auf [2].
Ein hilfreiches Instrument zur Orientierung bietet ein Therapiealgorithmus, der sowohl bei der Ersteinstellung als auch bei einer notwendigen Therapieanpassung die Einordnung der verfügbaren krankheitsmodifizierenden Therapien (DMTs) hinsichtlich Wirksamkeit, Sicherheit und Verträglichkeit erleichtert [3]. Gemäß den aktuellen DGN-Leitlinien lassen sich Immuntherapeutika nach der relativen Reduktion der entzündlichen Krankheitsaktivität in den Zulassungsstudien – also im Hinblick auf Schubrate, MRT-Aktivität und schubbedingte Progression – in drei Wirksamkeitskategorien einteilen [3]. Die Immuntherapie der RRMS sollte sich nach der Aktivität der Erkrankung (unter Berücksichtigung von Schubfrequenz, Schubschwere, Ansprechen auf Schubtherapie, Krankheitsprogression und MRT-Befunden) richten. Dabei soll individuell der mögliche Nutzen der Therapie gegen die potenziellen Risiken abgewogen werden.
Darüber hinaus liefern indirekte Vergleichsstudien wichtige Daten zur relativen Wirksamkeit einzelner Substanzen. Eine umfassende Analyse von Samjoo et al. (2023) bewertete in einer systematischen Netzwerk-Metaanalyse die Reduktion der jährlichen Schubrate (ARR) im Vergleich zu Placebo [4]. Dabei zeigte sich, dass insbesondere hochwirksame Therapien wie Natalizumab, Alemtuzumab sowie die Anti-CD20-Antikörper (z. B. Ocrelizumab, Ofatumumab, Ublituximab) eine deutlich stärkere Reduktion der Schubrate bewirken als die Therapien mit Teriflunomid, Interferon beta oder Glatirameracetat. Auch die S1P-Rezeptor-Modulatoren (Fingolimod, Ozanimod, Ponesimod) und Cladribin erreichten in der Analyse eine signifikante Überlegenheit gegenüber Placebo (Abb. 1).
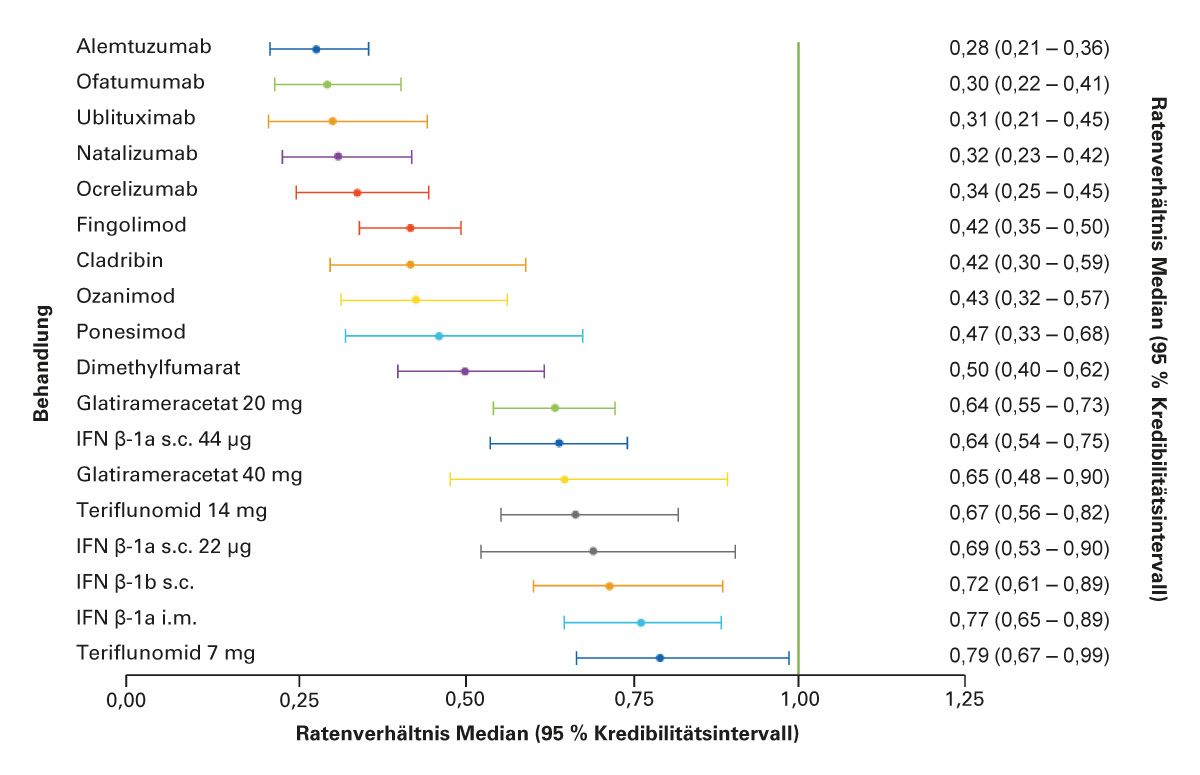
Abb. 1: Indirekter Vergleich der relativen Wirksamkeit von DMTs bei RMS. (Modifiziert nach Samjoo et al. 2023 [4])
Therapiestrategie mit vorausschauender Planung bei einer lebenslangen Erkrankung
Bei der MS-Diagnosestellung im Alter zwischen 25 und 34 Jahren und einer durchschnittlichen Lebenserwartung von fast 76 Jahren [5] ist die Wahrscheinlichkeit hoch, dass der Patient im Laufe seines Lebens mehrere Wechsel der Therapie erfahren wird. Im Rahmen einer retrospektiven Analyse des Deutschen Multiple Sklerose Registers der DMSG wurde beobachtet, dass die mittlere Zeitspanne vom Beginn bis zum Absetzen der ersten Therapie 3,0 ± 2,1 Jahre betrug und der Patient beim ersten DMT-Wechsel 37,9 ± 10,8 Jahre alt war [6]. Neben ungenügender Wirksamkeit mit weiterhin bestehender Krankheitsaktivität und Nebenwirkungen sind sowohl individuelle Gründe des Patienten als auch Eigenschaften des Medikamentes ausschlaggebend. Vereinbarkeit mit der Ausbildung und dem Beruf, Kinderwunsch, Schwangerschaft sowie Stillzeit, Urlaub und Umzug, JCV-Antikörperstatus, die Darreichungsform der Therapie (i.v., s.c., oral), Anwendungshäufigkeit, Alter, Lebensqualität u.v.m. sollte bei der Therapiewahl berücksichtigt werden. Dies erfordert bereits beim Therapieeinstieg eine sorgfältige Planung im Hinblick auf einen möglichen anstehenden späteren Therapiewechsel, mit Abwägen der zahlreichen Wechselmöglichkeiten mit günstigen und weniger ungünstigen Konstellationen („wenn-dann-Denken“).
Viele Patientinnen mit MS sind im gebärfähigen Alter, ungeplante Schwangerschaften sind nicht selten. Frauen mit chronischen Erkrankungen sollten daher primär auf schwangerschaftskompatible Therapien eingestellt werden, selbst wenn kein akuter Kinderwunsch besteht [7].
Realworld-Daten aus Registerstudien zeigen, dass eine frühe Einleitung hochwirksamer Therapien (early high efficacy therapy, HET) langfristig mit einer besseren Krankheitskontrolle und geringerer Progression assoziiert ist [8, 9].
Sicherheitsaspekte und Monitoring
Die Überwachung der Therapie ist ein wesentlicher Faktor zur Beurteilung der Wirksamkeit als auch zum Erkennen von Therapierisiken und Nebenwirkungen. Ein aufwändiges (und zeitintensives) Monitoring kann die Adhärenz bzw. Persistenz einerseits fördern, andererseits auch beeinträchtigen, wenn es eine Belastung für Patientinnen und Patienten darstellt [10]. Dennoch ist ein strukturiertes Monitoring essenziell für die sichere und effektive Anwendung krankheitsmodifizierender MS-Therapien. Es umfasst eine Basis- und eine regelmäßige Routineuntersuchung mit Beurteilung der Krankheitsaktivität bzw. das Ansprechen auf die MS-Therapie, bildgebende Verfahren (z. B. MRT), klinische sowie Blutbildkontrollen (u.a. Leber- und Nierenwerte, TSH, Lymphozyten, Serum-Immunglobuline), abhängig vom Sicherheitsprofil des jeweiligen Medikaments. Unter der Therapie mit dem monoklonalen Antikörper Natalizumab spielt der JCV-Antikörperstatus für das Therapierisiko, die JCV-assoziierte progressive multifokale Leukenzephalopathie (PML), eine wichtige Rolle und bei depletierenden oder immunsuppressiven Therapien (z. B. Cladribin, Anti-CD20-Antikörper) ist eine regelmäßige Überwachung erforderlich, um Infektionen, Lymphopenien oder Hypogammaglobulinämien frühzeitig zu erkennen.
Reversibilität und Therapiesequenzen
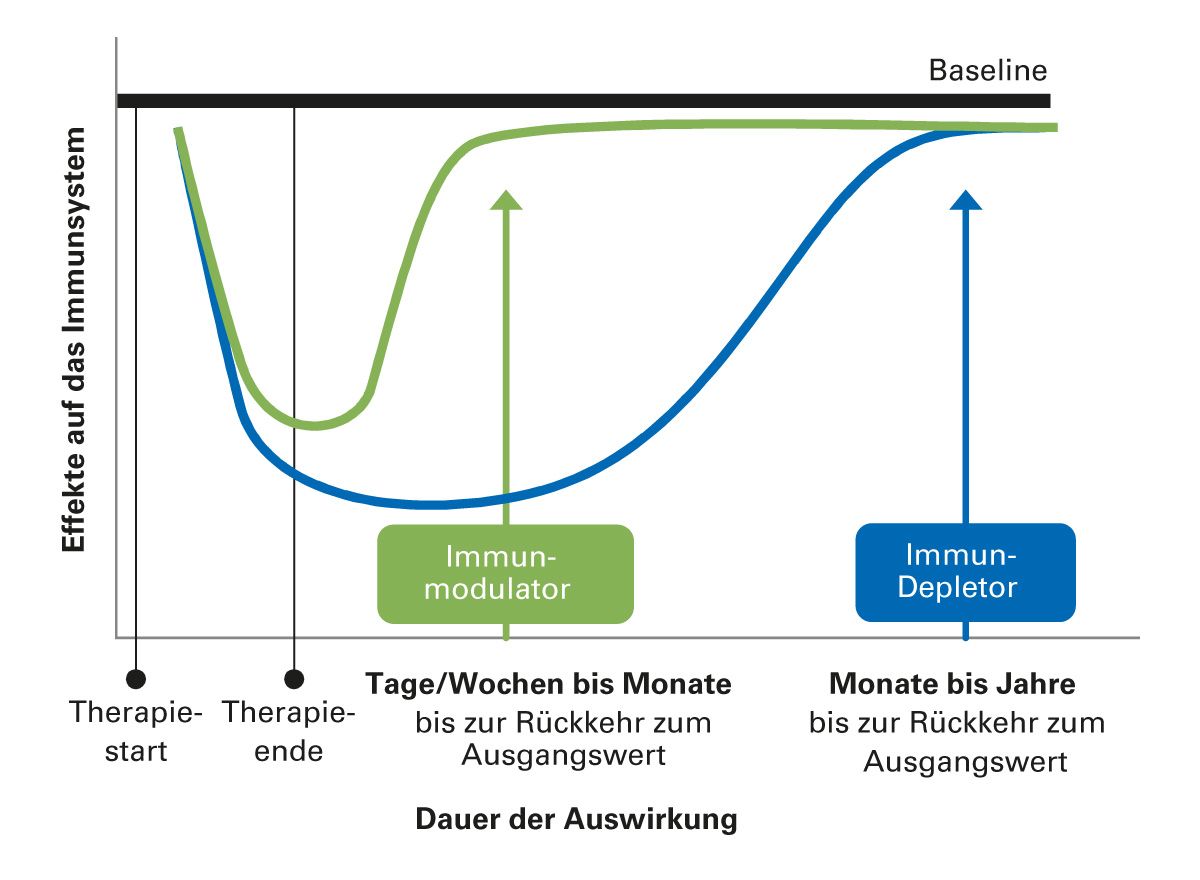
Die verfügbaren MS-Therapien können die immunvermittelte Entzündungsprozesse des zentralen Nervensystems und damit die MS-Krankheitsaktivität reduzieren, was zu einer nachweisbaren Verbesserung der klinischen und radiologischen Ergebnisse führt. Einige Therapien weisen jedoch langfristigen Auswirkungen auf das Immunsystem auf und/oder sind mit Nebenwirkungen verbunden, die den Einsatz nachfolgender Therapien erschweren können. Bei der individuellen Therapieplanung sollte die Nutzen-Risiko-Bewertung mehrere Faktoren berücksichtigen, darunter die Wirksamkeit des DMT zur Verringerung der Krankheitsaktivität, die kurz- und langfristigen Sicherheits- als auch Immunprofile jedes DMT, die Kriterien für die Therapieumstellung und die Risikotoleranz jedes Patienten [11]. Die Reversibilität immunologischer Effekte ist substanzspezifisch und beschreibt nicht nur das pharmakokinetische Eliminationsverhalten, sondern insbesondere die Dauer immunologischer Veränderungen nach Therapieende (Abb. 2). Ein bewährter Orientierungsrahmen ist die Unterscheidung in:
- Immunmodulatoren, Migrationshemmer (z. B. Fumarate, Natalizumab, Teriflunomid): eher kurzfristige bis mittelfristige Effekte
- Immundepletoren (z. B. Anti-CD20-Antikörper, Cladribin, Alemtuzumab): langanhaltende Wirkung
Diese Unterschiede sind bei der Sequenzierung von Therapien von praktischer Bedeutung. Die Auswahl der Folgetherapie sollte stets unter Berücksichtigung der „immunologischen Nachwirkzeit“, d.h. der Dauer der Reversibilität therapiespezifischer Effekte, sowie anhand von Lymphozyten- und ggf. auch Immunglobulinspiegelkontrollen erfolgen. Eine fundierte Kenntnis der Reversibilität pharmakologischer Effekte unterstützt ein lückenloses Management – mit dem Ziel, Krankheitsaktivität zu verhindern und Risiken zu minimieren. Daher ist es essenziell, bereits bei der Wahl der Ersttherapie schon an eine mögliche Folgetherapie zu denken.
Überlegungen zu konkreten Therapiesequenzen
Dimethylfumarat
Angesichts der langjährigen Verfügbarkeit von Dimethylfumarat (DMF) ist das Sicherheitsprofil inzwischen gut charakterisiert und die Substanz insgesamt gut verträglich. Eine Abnahme der absoluten Lymphozytenzahl ist ein bekannter pharmakodynamischer Effekt der DMF-Behandlung. Im ersten Behandlungsjahr in den zulassungsrelevanten Phase-3-Studien (DEFINE/CONFIRM) sanken die absoluten Lymphozytenzahlen (ALC) um etwa 30 % und stabilisierten sich anschließend. Bei 76 % der Patienten blieben die ALCs im ersten Behandlungsjahr über der unteren Normgrenze [12]. Somit ist ein wesentlicher zu beachtender Aspekt beim Absetzen oder Wechsel der Therapie eine potenziell verzögerte Lymphozytenrekonstitution. In Real-World-Daten betrug die mittlere Zeit bis zur Erholung auf ≥ 0,8 × 10⁹/l Lymphozyten etwa 2–4 Monate, bei längerfristiger Lymphopenie (> 3 Jahre) sogar bis zu 12-18 Monate [12]. Dieser Umstand ist insbesondere bei geplanten Umstellungen auf depletierende Substanzen oder bei akuter Infektneigung von klinischer Relevanz. Vor einer Umstellung sollte daher eine Kontrolle der Lymphozytenzahlen erfolgen [13, 14].
Fingolimod und andere S1P-Modulatoren
Fingolimod und verwandte S1P-Rezeptor-Modulatoren (Ozanimod, Ponesimod) beeinflussen die zirkulierenden Lymphozyten durch eine funktionelle Sequestrierung in Lymphknoten [15]. Durch die Blockade der S1P-Rezeptoren werden Lymphozyten im lymphatischen Gewebe zurückgehalten und es wird eine Lymphopenie verursacht. Dieser Mechanismus kann die Umstellung auf andere hochwirksame Immuntherapien erschweren. Mehrere Studien deuteten darauf hin, dass die Exposition gegenüber S1P-Rezeptor-Modulatoren die Wirksamkeit nachfolgender hochwirksamer DMT verringern könnte [16-18]. Wechsel von S1P-Rezeptormodulatoren können bei aktiver RMS z. B. aufgrund von Nebenwirkungen oder unzureichender Wirksamkeit aber erforderlich sein; ferner wurden S1PRM in der jüngeren Vergangenheit mit einem erhöhten kardiovaskulären Risikoprofil assoziiert [19]. Bei einem Wechsel beispielsweise auf depletierende Therapien wie Alemtuzumab oder Ocrelizumab besteht ein Risiko für suboptimale Wirkung, bezüglich Alemtuzumab wurde auch ein erhöhtes Risiko für eine sekundäre Autoimmunität beobachtet [16, 17]. Daten deuten darauf hin, dass Ofatumumab nach Fingolimod effektiver ist als andere Substanzen [18].
Natalizumab
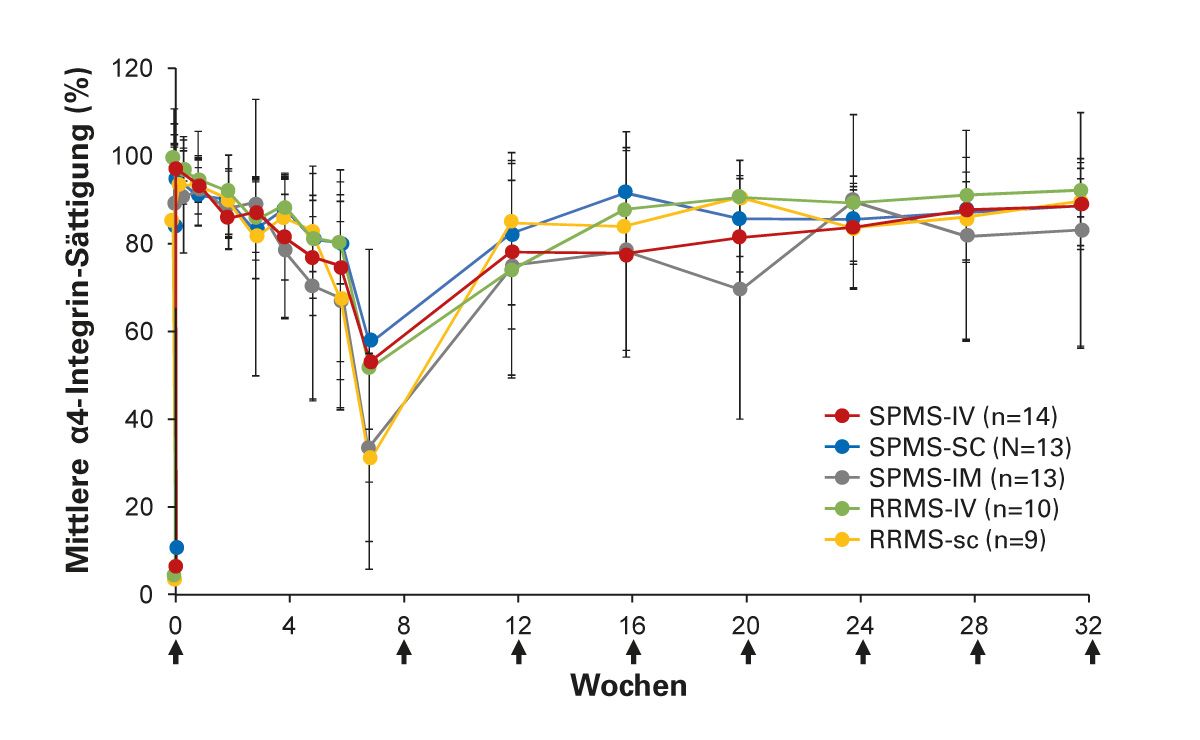
Natalizumab bindet an die α4-Untereinheit humaner Integrine, die auf T- und B-Zellen vorhanden sind, unterbricht die Interaktion zwischen α4-Integrin und dem vaskulären Zelladhäsionsmolekül-1 (VCAM-1) und verhindert dadurch die Adhäsion und Migration von Leukozyten in das ZNS [20-22]. Der monoklonale Antikörper ist hochwirksam mit raschem Wirkungseintritt [23-25]. Die Sättigung des Rezeptors erfolgt bereits innerhalb weniger Stunden nach subkutaner oder intravenöser Gabe (Abb. 3).
Die klinische Wirkung setzt rasch ein, die Natalizumab-Anwendung zeigte u.a. schnell eine deutliche Verringerung Gadolinium-aufnehmender Läsionen. Dieser Effekt war bereits einen Monat nach der ersten Infusion sichtbar (Abb. 4). Nach Absetzen von Natalizumab lässt die Blockade des α4-Integrins verhältnismäßig schnell nach (Abb. 5). Ca. 8 Wochen nach der letzten Verabreichung traten Veränderungen auf, d.h. eine reversible Abnahme der Natalizumab-Serum-Konzentration, der α4-Integrin-Sättigung und Lymphozytenzahl [26]. Erste Anzeichen einer erneuten Krankheitsaktivität, darunter Gadolinium-aufnehmende Läsionen, können bereits etwa 8 Wochen nach der letzten Dosis auftreten. Um eine Reaktivierung der MS zu vermeiden, sollte in diesem Zeitraum rechtzeitig eine Anschlussbehandlung mit einem wirksamen DMT eingeleitet werden [23, 26]. Aufgrund der schnellen Reversibilität der pharmakologischen Effekte von Natalizumab ist ein zeitnaher Therapiewechsel, z. B. bei einer JCV-Serokonversion und Zunahme des individuellen PML-Risikos in Abhängigkeit der Höhe des Antikörper-Indexes, möglich. Real-World-Daten zeigen, dass eine Anschlusstherapie mit Ocrelizumab nach Natalizumab vermutlich effektiver ist als DMF oder Fingolimod [27].
Auch zeigten erste Daten, dass die Anti-CD20 Therapie mit Ofatumumab als Folgetherapie nach Natalizumab in den Endpunkten Schub- und MRT-Aktivität Ocrelizumab potenziell unterlegen war [18]. Bei Patientinnen und Patienten mit JCV-Positivität, längerer Therapiedauer und vorausgegangener Immunsuppression besteht potenziell ein erhöhtes PML-Risiko. Die Gesamtprävalenz von Anti-JCV-Antikörpern bei mehr als 7.700 MS-Patienten aus 10 Ländern betrug etwa 57 %, wobei die Seroprävalenz mit dem Alter ansteigt (von 47,4 % im Alter von 15–29 Jahren bis 64,1 % ≥ 60 Jahre) und bei Frauen niedriger ist als bei Männern (Frauen 55,3 %, Männer 61,6 %) [28].
Der Anti-JCV-Antikörper-Index stellt das zentrale Instrument zur Einschätzung des individuellen PML-Risikos dar. Allerdings kann dessen Aussagekraft unter bestimmten Vortherapien eingeschränkt sein. Insbesondere bei der Anwendung unter oder nach Anti-CD20-Therapien mit B-Zell-depletierender Wirkung kann es durch IgG-Reduktion zu falsch-niedrigen oder gar falsch-negativen Testergebnissen beim JCV-Index kommen [29, 30]. Der JCV-Test sollte bei der Beurteilung des individuellen PML-Risikos mit Vorsicht interpretiert werden, wenn eine Umstellung von Anti-CD20-Therapien auf Natalizumab geplant ist. Auch Fingolimod senkt den Indexwert deutlich, während bei Dimethylfumarat keine relevanten Veränderungen beobachtet wurden [31]. Daher ist bei einer geplanten Umstellung auf Natalizumab besondere Vorsicht geboten. In solchen Fällen sollte der JCV-Status nicht isoliert bewertet, sondern im klinischen Gesamtkontext interpretiert werden. Ergänzend werden häufigere MRT-Kontrollen zur PML-Überwachung empfohlen – auch bei zunächst seronegativen Patienten [31]. Somit wäre ein Therapieeinstieg auf Natalizumab mit schnellem Wirkeintritt und hoher Wirksamkeit bei jungen MS-Patienten mit niedrigerer Anti-JCV-Antikörper Prävalenz von Vorteil, damit bei einem potenziell folgenden Therapiewechsel der Weg für mögliche hochwirksame Nachfolgetherapien ohne Einschränkungen offenbleibt.
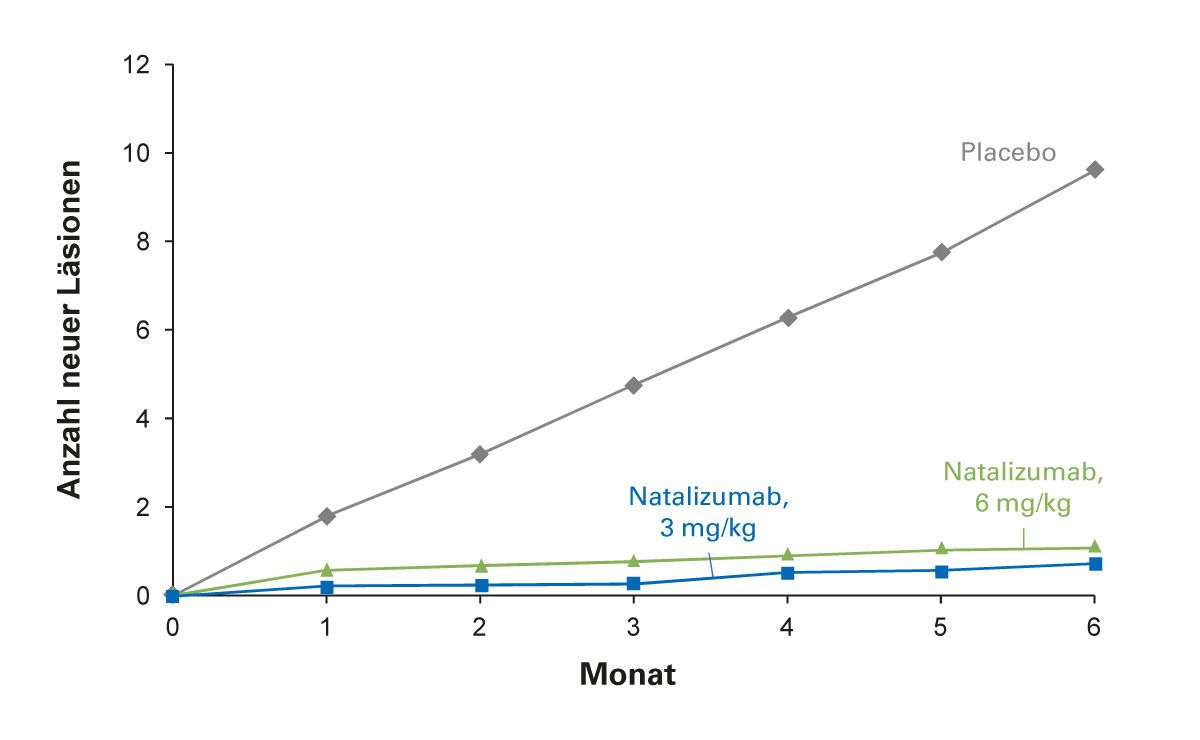
Abb. 4: Deutliche Verringerung neuer Gd+-Läsionen bereits einen Monat nach der ersten Infusion mit Natalizumab. (Modifiziert nach Miller et al. [23])
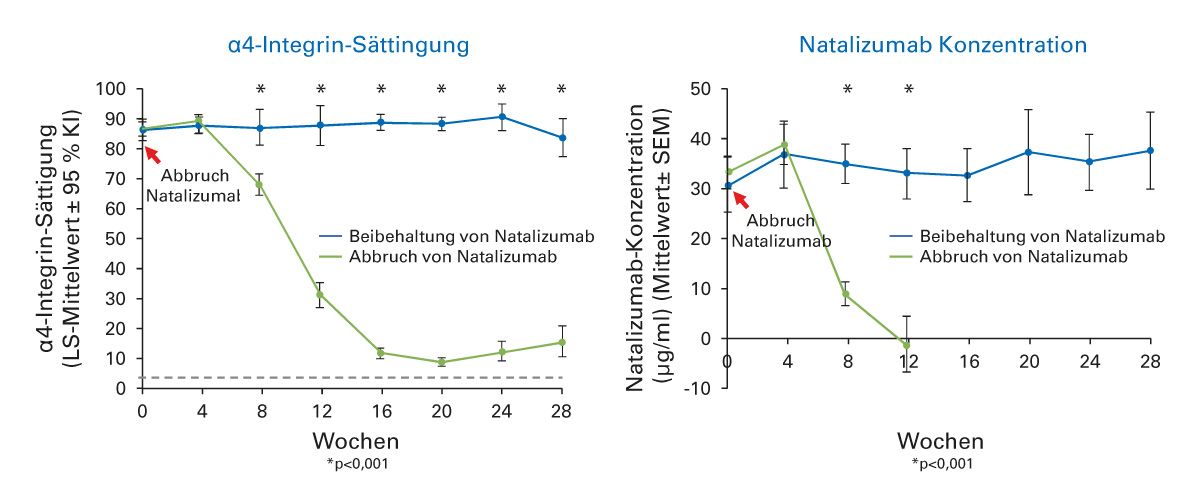
Abb. 5: Reversible Abnahme der α4-Integrin-Sättigung und der Natalizumab-Serum-Konzentration nach ca. 8 Wochen. (Modifiziert nach Plavina et al. 2017 [26])
Anti-CD20-Therapien
Anti-CD20-Therapien wie Ocrelizumab, Ofatumumab und Ublituximab sind hochwirksame B-Zell-depletierende Therapien bei Multipler Sklerose, auch für Rituximab liegen langjährige Erfahrungen aus dem off-label-use vor. Diese monoklonalen Antikörper zielen auf CD20 ab, ein transmembranes Phosphoprotein, das auf der Oberfläche von 95 % der B-Zellen sowie einer Untergruppe von T-Zellen lokalisiert ist. Der Wirkung dieser Therapien liegt weniger eine Depletion Antikörper-produzierender Zellen zugrunde. Vielmehr scheint die Unterdrückung weiterer Funktionen von (Gedächtnis-)-B-Zellen vorrangig. Diese Funktionen umfassen Antigen-Präsentation, Zytokin-Freisetzung und die Bildung lymphofollikulärer Strukturen u.a. in den Meningen MS-Erkrankter. [33].
Obgleich insgesamt gut verträglich, besteht ein mögliches Risiko in der Langzeitanwendung in der Entwicklung einer Hypogammaglobulinämie und einer Prädisposition für Infekte. Während diese Risiken in den kontrollierten klinischen Studien geringer ausgeprägt waren, deuten real world-Studien einen klaren Zusammenhang insbesondere mit dem Patientenalter und der Therapiedauer an [33-35].
Cladribin
Cladribin ist eine oral verabreichte Impulstherapie, die zunächst in vier Zyklen über zwei Jahre verabreicht wird (zweimal im Abstand von vier Wochen in den Jahren 1 und 2). Die Therapie führt über eine Interaktion mit Nukleinsäure-Synthese und Energiestoffwechsel zu einer Lymphopenie, wobei die selektive Aktivierung des Prodrugs in Lymphozyten zu einer gewissen Spezifität innerhalb des Körpers führt.
Derzeit gibt es verschiedene Expertenmeinungen bezüglich der Re-Exposition bei persistierender Krankheitsaktivität unter Cladribin [36], kontrollierte Studien hierzu liegen allerdings nicht vor. Mögliche Nebenwirkungen, insb. Infektionsrisiken korrelieren allerdings scheinbar mit der Ausprägung einer Lymphopenie [37]. IgG und IgM-Konzentrationen blieben unter Cladribin stabil [38].
Zusammenfassung
Die therapeutische Landschaft der Multiplen Sklerose hat sich in den letzten Jahren durch die zunehmende Verfügbarkeit zahlreicher krankheitsmodifizierender Therapien (DMTs) deutlich erweitert. Die strategische, personalisierte Auswahl der richtigen Therapie zum richtigen Zeitpunkt – unter Berücksichtigung von Krankheitsaktivität, Prognosefaktoren, Lebenssituation, Komorbiditäten und individuellen Präferenzen sowie möglicher Therapiewechsel – ist von größter Bedeutung.
Real-World-Daten und moderne Leitlinien sprechen sich zunehmend für eine frühe hochwirksame Therapie (early HET) bei schubförmiger MS aus, da diese mit einer besseren Kontrolle der Krankheitsprogression assoziiert ist als das „Eskalationsmodell“. Gleichzeitig gewinnt die Planung von sicheren und sinnvollen Therapiesequenzen vor dem Hintergrund einer lebenslangen chronischen Erkrankung an Bedeutung – mit dem Ziel, Optionen offen zu halten und immunologische Risiken zu minimieren.
Für die klinische Praxis bedeutet dies:
- Eine gute Kenntnis der Wirkmechanismen, Reversibilität und Langzeitwirkungen der jeweiligen Substanzen ist unerlässlich.
- Aspekte wie der JCV-Status, die Immunüberwachung (z. B. Lymphozyten, Immunglobulinspiegel), Infektionsrisiko und das individuelle Risikoprofil müssen fortlaufend einbezogen werden.
- Insbesondere Patientinnen mit Kinderwunsch oder besonderen Risikofaktoren benötigen frühzeitige und vorausschauende Therapieentscheidungen.
Insgesamt rückt ein vorausschauendes, sequenzorientiertes Denken immer stärker in den Fokus: Nicht nur der Start, sondern auch der Weg und die potenzielle Fortsetzung der Therapie müssen unter dem Motto „Heute schon an morgen denken“ in die Überlegungen einbezogen werden. Eine strukturierte, evidenzbasierte und gleichzeitig individuelle Therapieplanung bildet dabei das Fundament einer modernen MS-Versorgung.
Literatur
1. Graf J., et al., Updated multiple sclerosis incidence, 2015-2022. JAMA Neurol, 2024.81(10): p.1100-1102.
2. www.fachinfo.de.
3. Hemmer B., et al. Diagnose und Therapie der Multiplen Sklerose, Neuromyelitis-optica-Spektrum-Erkrankungen und MOG-IgG-assoziierten Erkrankungen, S2k-Leitlinie, 2024. Deutsche Gesellschaft für Neurologie (Hrsg.), Leitlinien für Diagnostik und Therapie in der Neurologie. www.dgn.org/leitlinien. 2024 (Zugriff 09.05.2025).
4. Samjoo I.A., et al., Comparative efficacy of therapies for relapsing multiple sclerosis: A systematic review and network meta-analysis. J Comp Eff Res, 2023.12(7): p.e230016.
5. Marrie R.A., et al., Effect of comorbidity on mortality in multiple sclerosis. Neurology, 2015.85(3): p.240-247.
6. Frahm N., et al., Treatment switches of disease-modifying therapies in people with multiple sclerosis: Long-term experience from the german ms registry. Ther Adv Neurol Disord, 2024.17: p.17562864241239740.
7. Krysko K.M., Considerations for family planning in adolescent and young adults with multiple sclerosis. Mult Scler, 2024: p.13524585241303481.
8. He A., et al., Timing of high-efficacy therapy for multiple sclerosis: A retrospective observational cohort study. Lancet Neurol, 2020.19(4): p.307-316.
9. Spelman T., et al., Treatment escalation vs immediate initiation of highly effective treatment for patients with relapsing-remitting multiple sclerosis: Data from 2 different national strategies. JAMA Neurol, 2021.78(10): p.1197-1204.
10. World Health Organization (WHO). Adherence to long-term therapies. http://apps.who.int/iris/bitstream/handle/10665/42682/9241545992.pdf;jsessionid=C87A012E244996A29753C9F9B0FEBF5A?sequence=1. 2003 (Zugriff: 28.07.2025).
11. Pardo G. and Jones D.E., The sequence of disease-modifying therapies in relapsing multiple sclerosis: Safety and immunologic considerations. J Neurol, 2017.264(12): p.2351-2374.
12. Chan A., et al., Lymphocyte reconstitution after dmf discontinuation in clinical trial and real-world patients with ms. Neurol Clin Pract, 2020.10(6): p.510-519.
13. Fox E.J., et al., Lymphopenia and dmts for relapsing forms of ms: Considerations for the treating neurologist. Neurol Clin Pract, 2019.9(1): p.53-63.
14. Rommer P.S., et al., Immunological aspects of approved ms therapeutics. Front Immunol, 2019.10: p.1564.
15. McGinley M.P. and Cohen J.A., Sphingosine 1-phosphate receptor modulators in multiple sclerosis and other conditions. Lancet, 2021.398(10306): p.1184-1194.
16. Pfeuffer S., et al., Impact of previous disease-modifying treatment on effectiveness and safety outcomes, among patients with multiple sclerosis treated with alemtuzumab. J Neurol Neurosurg Psychiatry, 2021.92(9): p.1007-1013.
17. Pfeuffer S., et al., Effect of previous disease-modifying therapy on treatment effectiveness for patients treated with ocrelizumab. Neurol Neuroimmunol Neuroinflamm, 2023.10(3).
18. Meuth S.G., et al., Different treatment outcomes of multiple sclerosis patients receiving ocrelizumab or ofatumumab. Ann Neurol, 2025.97(3): p.583-595.
19. Framke E., et al., Risk of cardiovascular disease in patients with multiple sclerosis treated with fingolimod compared to natalizumab: A nationwide cohort study of 2095 patients in denmark. Mult Scler, 2024.30(2): p.184-191.
20. Rudick R.A. and Sandrock A., Natalizumab: Alpha 4-integrin antagonist selective adhesion molecule inhibitors for ms. Expert Rev Neurother, 2004.4(4): p.571-580.
21. Stüve O., et al., Immunologic, clinical, and radiologic status 14 months after cessation of natalizumab therapy. Neurology, 2009.72(5): p.396-401.
22. Yu Y., et al., How natalizumab binds and antagonizes α4 integrins. J Biol Chem, 2013.288(45): p.32314-32325.
23. Miller D.H., et al., A controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med, 2003.348(1): p.15-23.
24. Polman C.H., et al., A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. N Engl J Med, 2006.354(9): p.899-910.
25. Kappos L., et al., Clinical effects of natalizumab on multiple sclerosis appear early in treatment course. J Neurol, 2013.260(5): p.1388-1395.
26. Plavina T., et al., Reversibility of the effects of natalizumab on peripheral immune cell dynamics in ms patients. Neurology, 2017.89(15): p.1584-1593.
27. Zhu C., et al., Comparison between dimethyl fumarate, fingolimod, and ocrelizumab after natalizumab cessation. JAMA Neurol, 2023.80(7): p.739-748.
28. Bozic C., et al., Anti-jc virus (jcv) antibody prevalence in the jcv epidemiology in ms (jems) trial. Eur J Neurol, 2014.21(2): p.299-304.
29. Zoehner G., et al., Reduced serum immunoglobulin g concentrations in multiple sclerosis: Prevalence and association with disease-modifying therapy and disease course. Ther Adv Neurol Disord, 2019.12: p.1756286419878340.
30. Baber U., et al., Anti-jc virus antibody index changes in rituximab-treated multiple sclerosis patients. J Neurol, 2018.265(10): p.2342-2345.
31. Farley S., et al., Anti-john cunningham virus antibody index levels in multiple sclerosis patients treated with rituximab, fingolimod, and dimethyl fumarate. Surg Neurol Int, 2019.10: p.59.
32. Plavina T., et al., A randomized trial evaluating various administration routes of natalizumab in multiple sclerosis. J Clin Pharmacol, 2016.56(10): p.1254-1262.
33. Freeman S.A. and Zéphir H., Anti-cd20 monoclonal antibodies in multiple sclerosis: Rethinking the current treatment strategy. Rev Neurol (Paris), 2024.180(10): p.1047-1058.
34. Davies L., et al., Real-world observational study of infections in people treated with ocrelizumab for multiple sclerosis. J Neurol, 2025.272(6): p.415.
35. Apostolidis S.A., et al., Cellular and humoral immune responses following sars-cov-2 mrna vaccination in patients with multiple sclerosis on anti-cd20 therapy. Nat Med, 2021.
36. Meuth S.G., et al., Long-term management of multiple sclerosis patients treated with cladribine tablets: An expert opinion. Expert Opin Pharmacother, 2020.21(16): p.1965-1969.
37. Giovannoni G., et al., Integrated lymphopenia analysis in younger and older patients with multiple sclerosis treated with cladribine tablets. Front Immunol, 2021.12: p.763433.
38. Rolfes L., et al., Immunological consequences of cladribine treatment in multiple sclerosis: A real-world study. Mult Scler Relat Disord, 2022.64: p.103931.


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.