Kompressionstherapie bei chronischer venöser Insuffizienz (CVI) und peripherer arterieller Verschlusskrankheit (pAVK)
Interessengebiete: Allgemeinmedizin und Innere Medizin, Haut- und Geschlechtskrankheiten
Die chronische Veneninsuffizienz (CVI) und die periphere arterielle Verschlusskrankheit (pAVK) treten bei älteren Menschen oft gemeinsam auf. Beinschmerzen, Schwellungen oder Hautulzera können sowohl durch eine CVI als auch durch eine pAVK (oder auch beides) bedingt sein. Hausärzte sind in der Regel die ersten Ansprechpartner für diese Patienten. Einer sorgfältigen Diagnostik kommt eine wichtige Rolle zu, denn die korrekte Einordnung in CVI und pAVK ist essenziell, um die richtigen Therapiemaßnahmen einzuleiten.
Diese CME gibt einen Überblick zu Pathophysiologie, Epidemiologie, Klassifikation, Diagnostik und Therapie der CVI und der pAVK.
Kursinhalt
Inhaltsverzeichnis
Kursbeschreibung
Die chronische Veneninsuffizienz (CVI) und die periphere arterielle Verschlusskrankheit (pAVK) treten bei älteren Menschen oft gemeinsam auf. Beinschmerzen, Schwellungen oder Hautulzera können sowohl durch eine CVI als auch durch eine pAVK (oder auch beides) bedingt sein. Hausärzte sind in der Regel die ersten Ansprechpartner für diese Patienten. Einer sorgfältigen Diagnostik kommt eine wichtige Rolle zu, denn die korrekte Einordnung in CVI und pAVK ist essenziell, um die richtigen Therapiemaßnahmen einzuleiten. Diese CME gibt einen Überblick zu Pathophysiologie, Epidemiologie, Klassifikation, Diagnostik und Therapie der CVI und der pAVK.
Einleitung
Chronische Venenerkrankungen und die periphere arterielle Verschlusskrankheit (pAVK) gehören zu den häufigsten Gefäßleiden. Beide Erkrankungen nehmen mit höherem Alter und Komorbiditäten (z. B. Diabetes) deutlich zu und treten oft gemeinsam auf. Hausärzte sind in der Regel die ersten Ansprechpartner für Patienten mit Beinschwellungen, Ulzera oder Claudicatio. Eine fundierte Einordnung in CVI und pAVK ist essenziell, um die richtige Therapie einzuleiten.
Chronische Veneninsuffizienz (CVI)
Pathophysiologie
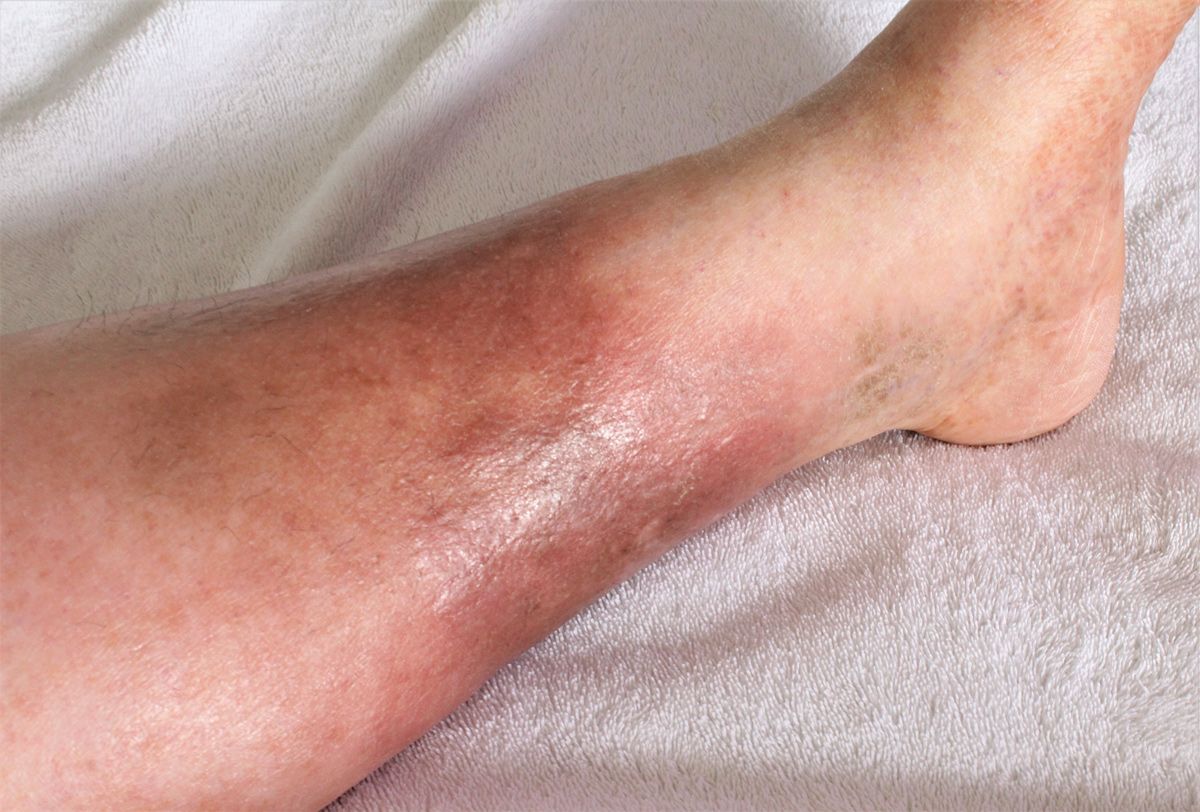
Die chronische Veneninsuffizienz ist definiert durch klinische Veränderungen, die durch venöse Abflussstörungen entstehen können (Abb. 1). Hier ist an Hautveränderungen wie Hyperpigmentierung, Stauungsdermatitis und Dermatoliposklerose zu denken. Der umfassendere Begriff ist „chronische Venenerkrankungen“. Hier werden auch Veränderungen wie Besenreiser oder asymptomatische Varizen, die noch keine Symptome bzw. Beschwerden ausgelöst haben, subsummiert. Zentral ist eine persistierende venöse Hypertonie infolge von Venenklappeninsuffizienz und/oder venöser Obstruktion (z. B. postthrombotisch), bisweilen auch durch hämodynamische Effekte der Adipositas oder eingeschränkte Beweglichkeit im Sprunggelenk. Der erhöhte Druck in den Beinvenen führt zu Mikrozirkulationsstörungen und trophischen Veränderungen im Unterschenkelbereich. Die persistierende venöse Hypertonie resultiert in Ödemen, Hautveränderungen (Hyperpigmentierung, Stauungsdermatitis, Dermatosklerose) und letztlich ulzerierenden Läsionen. Risikofaktoren sind u. a. familiäre Disposition, Lebensalter, Adipositas, Bewegungsmangel sowie vorausgegangene Thrombosen [1].
Epidemiologie
CVI ist ein häufiges Krankheitsbild. Die Prävalenz klinisch manifester CVI wird je nach Definition auf etwa 3-11 % geschätzt. Frauen erkranken tendenziell früher (Gipfel 40.-50. Lebensjahr) und dreimal häufiger als Männer, bei denen der Gipfel erst im höheren Alter liegt. Demgegenüber haben Männer häufig eine schwerere chronische Veneninsuffizienz mit vernarbenden Stadien und Ulzerationen. CVI ist eine führende Ursache chronischer Wunden am Unterschenkel: Bis zu 70 % aller Ulcus cruris-Fälle werden primär durch eine CVI bedingt [2]. Epidemiologische Schätzungen für chronische Venenerkrankungen gehen davon aus, dass 19 % der erwachsenen Bevölkerung an Krampfadern (VV) leiden, während 0,4 % eine Vorgeschichte von venösen Ulzerationen (VLU) haben [3].
Klassifikation
Die Form venöser Erkrankungen wird international nach der CEAP-Klassifikation eingeteilt (Clinical-Etiology-Anatomy-Pathophysiology). Klinisch reicht das Spektrum von C0 (keine sichtbaren Venenveränderungen) bis C6 (offenes Ulcus cruris venosum) [4] (Tab. 1).
Für die Praxis wichtig ist zudem die Unterscheidung zwischen primärer Varikose und sekundärer (postthrombotischer) Genese, da Letztere oft mit einer schwereren CVI einhergeht.
Periphere arterielle Verschlusskrankheit (pAVK)
Pathophysiologie
Bei der pAVK handelt es sich zumeist um eine chronische fortschreitende Atherosklerose der Extremitätenarterien. Durch arteriosklerotische Plaques kommt es zu Gefäßstenosen und -verschlüssen, die den Blutfluss zu den peripheren Geweben reduzieren. Die untere Extremität ist häufiger betroffen als die obere [5]. Die Folge ist eine Ischämie insbesondere unter Belastung, was klinisch zur Claudicatio intermittens (Schaufensterkrankheit) führt. In fortgeschrittenen Stadien reicht die Durchblutung auch in Ruhe nicht aus (kritische Ischämie mit Ruheschmerz, trophischen Störungen bis hin zu Nekrosen). Hauptrisikofaktoren der pAVK sind Rauchen, Diabetes mellitus, arterielle Hypertonie und Dyslipidämie. Oft liegen multiple kardiovaskuläre Risikofaktoren gleichzeitig vor.
Epidemiologie
Die pAVK ist eine häufige Systemerkrankung mit hoher Dunkelziffer (viele Betroffene sind asymptomatisch). In der allgemeinen erwachsenen Bevölkerung liegt die Prävalenz bei ca. 3-10 %, steigt aber mit dem Alter erheblich an. Ab dem 70. Lebensjahr sind 15- 20 % der Menschen von einer pAVK betroffen [5] . Allerdings verläuft nur etwa ein Drittel der Fälle symptomatisch; viele Patienten bemerken die Erkrankung lange nicht. In der Hausarztpraxis ist die pAVK dennoch relevant, da frühzeitige Erkennung (z. B. durch Abtasten peripherer Pulse oder ABI-Screening) helfen kann, kardiovaskuläre Ereignisse zu verhindern. Unbehandelt kann eine pAVK zur kritischen Extremitätenischämie führen. Diese schwere Form (Ruheschmerz, Ulzera/Gangrän) betrifft 1-3 % aller pAVK-Patienten.
Klassifikation
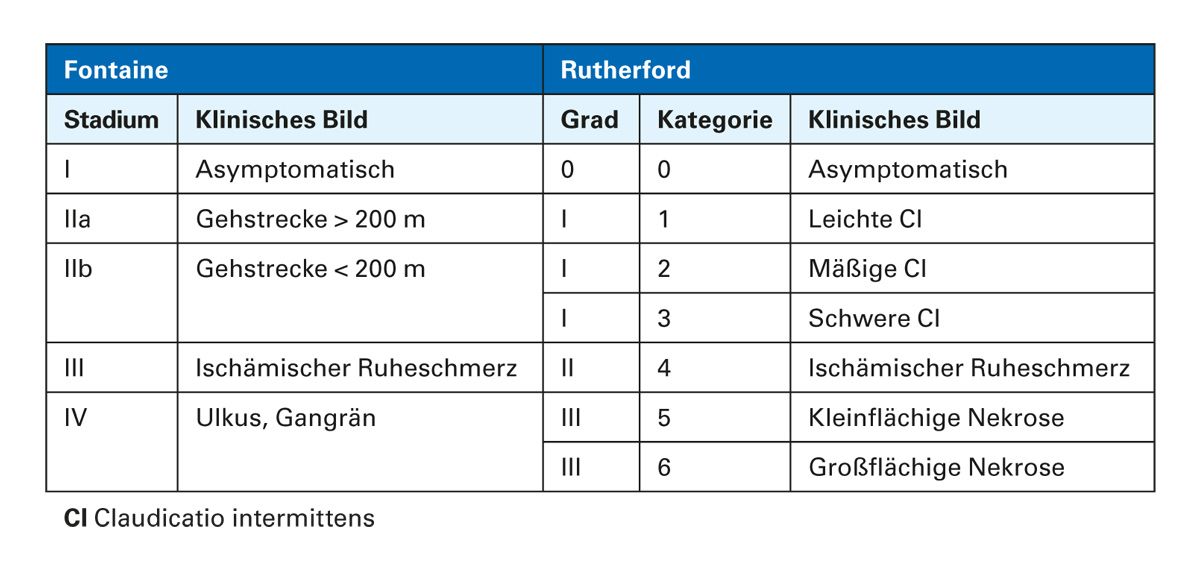
Klinisch wird die pAVK nach Fontaine in vier Stadien eingeteilt (Tab. 2): Stadium I: asymptomatisch (Zufallsbefund einer Durchblutungsstörung, z. B. pathologischer ABI); Stadium II: belastungsinduzierte Muskelschmerzen = Claudicatio intermittens (IIa: schmerzfreie Gehstrecke > 200 m; IIb: < 200 m) ; Stadium III: ischämischer Ruheschmerz; Stadium IV: trophische Gewebsverluste (Ulcera, Gangrän). Ergänzend existiert die Rutherford-Klassifikation (Grad 0-6), die ähnlich abgestuft ist und international in Studien genutzt wird (Tab. 2). Für die Praxis sind insbesondere Stadium II (Claudicatio) und höher relevant, da ab diesem Punkt Gefäßinterventionen erwogen werden. Etwa 20 % der Patienten weisen gleichzeitige Stenosen im Becken-, Oberschenkelund Unterschenkelbereich auf und bei < 10 % sind Armarterien betroffen. Die genaue Lokalisation der Stenosen (Beckentyp, Oberschenkeltyp, etc.) kann die Symptomatik beeinflussen (z. B. Gesäßschmerzen bei Aortoiliakalstenose, Wadenclaudicatio bei Femoralisstenose). Für Diagnose und Therapieplanung wird neben dem klinischen Stadium auch die hämodynamische Signifikanz (z. B. ABI-Wert) berücksichtigt [6, 7].
Einordnung von CVI und pAVK
Da Beinschmerzen, Schwellungen oder Hautulzera sowohl durch eine CVI als auch durch eine pAVK (oder beides) bedingt sein können, ist eine sorgfältige Diagnostik entscheidend. CVI und pAVK treten zudem in der älteren Bevölkerung nicht selten gemeinsam auf. Schätzungsweise jeder fünfte bis sechste Patient über 60-65 Jahre mit chronischer Venenerkrankung hat gleichzeitig eine leichte bis mittelschwere pAVK. Umgekehrt findet sich bei pAVK-Patienten (insbesondere Diabetikern) häufig eine chronische Veneninsuffizienz.
Die einfachste und wichtigste apparative Methode zur Differenzierung ist die Messung des Knöchel-Arm-Druck-Index (Ankle-Brachial-Index, ABI). Ein ABI ≤ 0,9 gilt als Hinweis auf eine pAVK (Sensitivität ~95 %, Spezifität ~95 % für ≥ 50 %-Stenosen). Werte < 0,5 deuten auf eine kritische Ischämie hin. Bei Mediasklerose (häufig bei Diabetikern) können falsch hohe ABI-Werte auftreten (>1,3). Ein normaler oder hoher ABI schließt eine pAVK weitgehend aus, so dass venöse Ursachen in den Vordergrund rücken. Vor Verordnung einer Kompressionstherapie sollte nur bei einem klinischen Verdacht auf eine relevante periphere Verschlusskrankheit stets ein ABI-Screening erfolgen, um eine kritische Ischämie mit einem ABI < 0,5 oder Knöchelarteriendruck < 60 mmHg als Kontraindikation auszuschließen [7]. Wichtig ist es, die hämodynamische Relevanz der pAVK bei CVI-Patienten abzuschätzen: Eine milde pAVK (ABI z. B. 0,6-0,9) stellt keine Kontraindikation für eine Kompressionstherapie dar [8]. Bei gleichzeitigem Vorliegen beider Erkrankungen spricht man von gemischten arterio-venösen Krankheitsbildern. Bei chronischen Wunden sollte der Begriff Ulcus cruris mixtum vermieden werden, da er nicht selten zu großen Unsicherheiten bei der Therapie führt. Die Initiative Chronische Wunden (ICW) e. V. hat eine differenzierte Nomenklatur vorgeschlagen [9]:
- Arterio-venöses Ulcus cruris: Ulcus cruris mit fortgeschrittener pAVK (FontaineStadium III oder IV bzw. Rutherford-Kategorie 4-6) und fortgeschrittener CVI (CEAP C6).
- Ulcus cruris venosum: Ulcus cruris bei fortgeschrittener CVI (CEAP C6) und begleitender, moderat ausgeprägter pAVK (Fontaine-Stadium I-IIb bzw. RutherfordKategorie 0-3).
- Ulcus cruris arteriosum: Ulcus cruris mit fortgeschrittener pAVK (Fontaine-Stadium IV bzw. Rutherford-Kategorie 5 oder 6) und begleitender, moderat ausgeprägter CVI (CEAP C3-5).
Die Anamnese gibt oft erste Hinweise auf die Genese der Beschwerden. Bei CVI klagen Patienten typischerweise über Schwere- und Spannungsgefühl in den Beinen, vermehrte Beinödeme am Abend, ggf. Hautjucken oder nächtliche Wadenkrämpfe. Langes Stehen oder Sitzen verschlechtert die Symptome, Hochlagern bringt Erleichterung. Sichtbare Varizen, Ödeme im Knöchelbereich (im Tagesverlauf zunehmend) und Hautveränderungen (Hyperpigmentierungen, Stauungsdermatitis, atrophe weiße Narbenfelder) weisen auf venöse Hypertonie hin. Im fortgeschrittenen Stadium findet man ein Ulcus cruris meist malleolennah medial mit flachem Grund und veränderter Haut in der Wundumgebung [10]. Oft findet man in der Wundumgebung Hyperpigmentierungen, Stauungsekzeme und/oder eine Dermatosklerose. Demgegenüber stehen bei pAVK belastungsabhängige Schmerzen: nach definierter Gehstrecke (Claudicatio) und Besserung nach kurzer Pause im Vordergrund. Bei schwerer pAVK (Stadium III/IV) treten Ruheschmerzen (v. a. im Liegen, Nachtschmerz) auf. Oft Besserung durch Herabhängenlassen des Beins. Objektiv sind bei pAVK die peripheren Fußpulse abgeschwächt oder nicht tastbar; die Beine können blass oder kalt sein, bei fortgeschrittener Ischämie zeigen sich trophische Störungen wie dünne atrophische Haut, Verlust der Behaarung, verdickte Nägel und schmerzhafte, tiefe Ulzera an Zehen oder Füßen (oft distal, z. B. an den Zehenkuppen oder Fersen, im Gegensatz zum typischen venösen Ulcus am Knöchel). Eine differenzierte Inspektion und Palpation (Pulse tasten!) ist daher grundlegend.
Duplexsonografie
Die farbkodierte Duplexsonografie ist der Goldstandard in der nicht-invasiven Gefäßdiagnostik beider Systeme. Venensonografie (Kompressionsultraschall, DopplerFlusskurven) erlaubt den Nachweis von Venenklappeninsuffizienzen (Reflux in V. saphena magna/parva bei Varikose, Insuffizienz der tiefen Venen bei postthrombotischem Syndrom) sowie von venösen Thrombosen. Arterielle Duplexsonografie detektiert Stenosen/Verschlüsse in den Extremitätenarterien und bewertet hämodynamisch (Strömungsgeschwindigkeit, Kollateralen). Als wertvoller zusätzlicher Parameter erweist sich die Mitbeurteilung des Dopplerfrequenzspektrums [7] (Abb. 2).
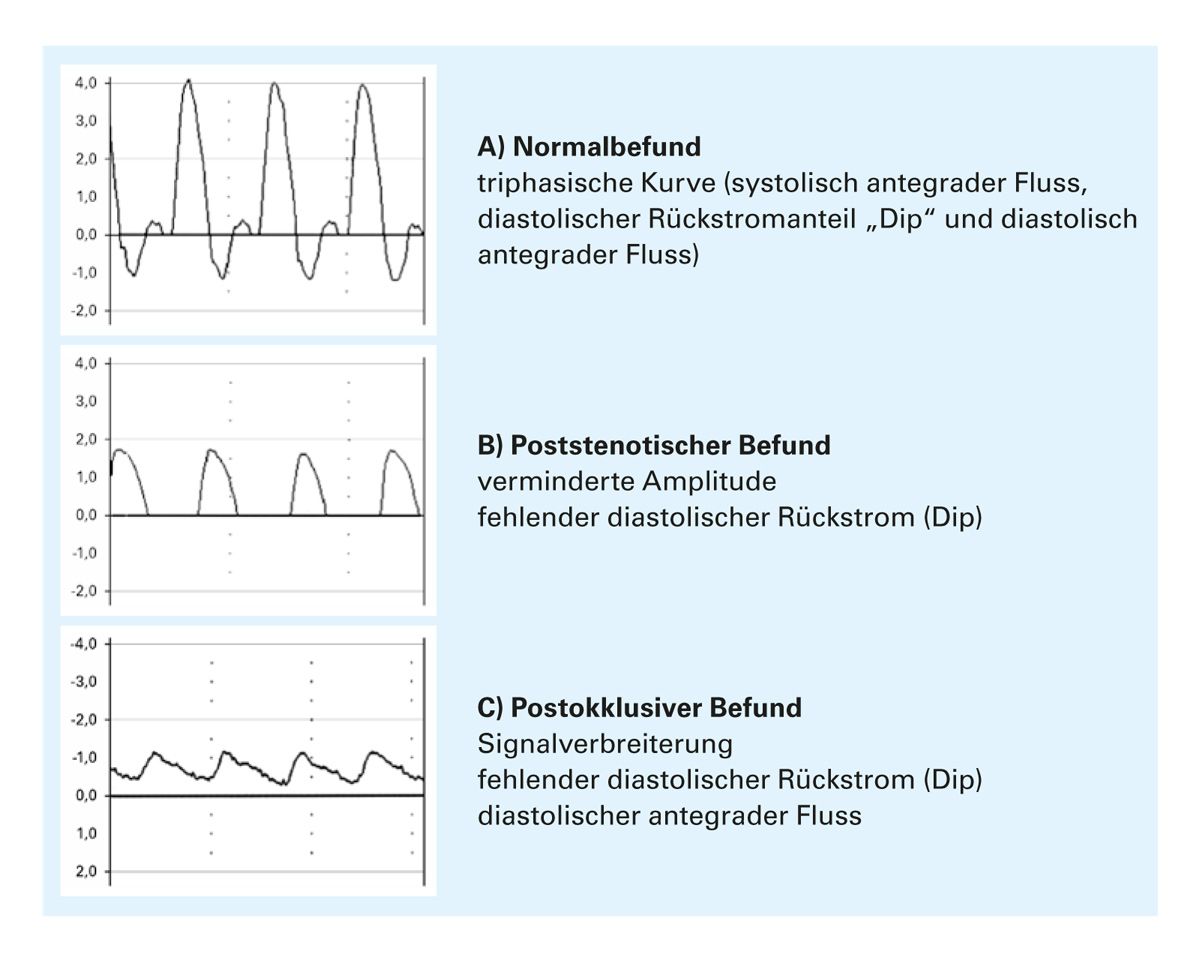
Abb. 2: Dopplerkurven bei Normalbefund (A), poststenotischem Befund (B) und postokklusivem
Befund (C) [modifiziert nach 7].
Je nach Befund können weitere Untersuchungen indiziert sein. Die Diagnostik sollte so gestaltet sein, dass vor Therapiebeginn klar ist, ob eine reine CVI, eine reine pAVK oder eine gemischte Gefäßerkrankung vorliegt. Bei gemischten Gefäßerkrankungen ist die Relevanz der beiden Komponenten zu definieren – dies bestimmt maßgeblich das weitere Vorgehen.
Differenzialdiagnosen
Neben CVI und pAVK können andere Ursachen für chronische Beinbeschwerden vorliegen, die es auszuschließen gilt. Beispielsweise deuten Lymphödeme auf eine Stauung im Lymphsystem hin (nicht eindrückbare, von Fußrücken beginnende Ödeme, Stemmer-Zeichen positiv) [11], neuropathische Schmerzen (z. B. Polyneuropathie bei Diabetes) verursachen Missempfindungen eher distal und unabhängig von Belastung, und entzündliche Veränderungen (Erysipel, Vaskulitis) gehen mit Rötung, Überwärmung oder systemischen Entzündungszeichen einher. Auch eine tiefe Venenthrombose (Phlebothrombose) muss ausgeschlossen werden, da sie akute einseitige Beinschwellung und Schmerz verursacht und unbehandelt zur postthrombotischen CVI führen kann.
Allgemeine Therapiekonzepte
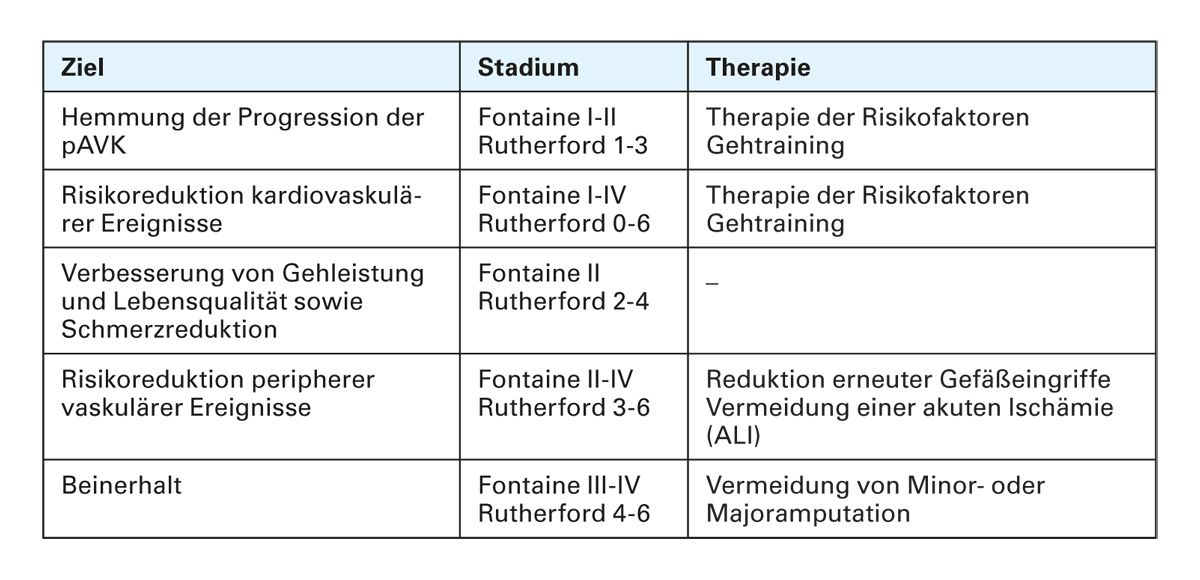
Die Herausforderung ist es oft, ein Therapiekonzept zu entwickeln, das beiden Komponenten gerecht wird. Ziel ist die Verbesserung des peripheren Blutflusses bei symptomatischen Patienten sowie die Therapie vaskulärer Risikofaktoren und Begleiterkrankungen [7, 12] (Tab. 3). Erste Säule der pAVK-Therapie ist das Management von Risikofaktoren. Dazu zählen Rauchstopp, Blutdruckkontrolle, ggf. Optimierung der Diabetestherapie und medikamentöse Senkung des LDL-Cholesterins. Die 2024 aktualisierte Leitlinie verfolgt einen ganzheitlichen Ansatz mit Bewegungstherapie und Gefäßtraining [7]:
- Strukturiertes Gehtraining mit qualifizierter Anleitung bei pAVK im Stadium II als Initialtherapie
- Häusliches Bewegungstraining mit Zielvorgaben oder Alternativen wie Radfahren oder Krafttraining
- Ein gefäßspezifisches Bewegungstraining mindestens dreimal pro Woche über 30-60 Minuten für mindestens drei Monate
Hinsichtlich der medikamentösen Behandlung empfiehlt die Leitlinie Thrombozytenaggregationshemmer für alle Patientinnen und Patienten mit symptomatischer pAVK. Dabei sollte Clopidogrel 75 mg/d gegenüber Acetylsalicylsäure 100 mg/d bevorzugt werden. Bei hohem vaskulärem Risiko kann unter Beachtung von Blutungsrisiken eine kombinierte anti-thrombotische Therapie (Dual-Pathway-Inhibition) mit Acetylsalicylsäure (100 mg/d) und Rivaroxaban (2 × 2,5 mg/d) erwogen werden. Cilostazol oder Naftidrofuryl sollten nur dann eingesetzt werden, wenn die Lebensqualität erheblich eingeschränkt ist, die Gehstrecke unter 200 Metern liegt und ein Gehtraining nicht oder nur eingeschränkt durchgeführt werden kann [7].
Die Therapie der CVI richtet sich nach den individuellen Symptomen und dem klinischen Bild. Ziele der Therapie sind die Normalisierung bzw. Besserung der venösen Hämodynamik, die Linderung der Beschwerden, die Besserung des Ödems und der trophischen Störungen, das Vorbeugen der mit der CVI assoziierten Komplikationen und die Heilung von bestehenden Ulzera [13]. Physische Aktivität gilt als Präventions- und Basismaßnahme, besonders Bewegungen, die die Sprunggelenkmuskelpumpe aktivieren wie Gehen, Schwimmen, Radfahren. Dazu kommt das Vermeiden von langem Stehen und Sitzen sowie das Erhalten eines normalen Gewichtes. Zur physikalischen Therapie gehören u. a. Krankengymnastik und manuelle Lymphdrainage.
Evidenzlage und Leitlinien zur Kompressionstherapie
Zahlreiche Studien und Reviews belegen die Wirksamkeit der Kompression bei chronisch-venösen Erkrankungen. Durch den äußeren Druck auf das Bein werden die erweiterten Venen komprimiert, der venöse Rückstrom verbessert und der venöse Hochdruck reduziert. Dies führt zu einer Abschwellung (Ödemreduktion) und besseren arteriellen Durchblutung der Haut (durch Abnahme des Gewebedrucks) [14].
Randomisierte Studien an Patienten mit venösen Unterschenkelulzera zeigen, dass Kompressionstherapie die Heilungsrate deutlich erhöht: Im Vergleich zu keiner Kompression heilen Ulcera unter Kompression signifikant schneller und häufiger ab. Kompressionsbandagen aus mehreren Komponenten (z. B. kurzzügige und langzügige Komponenten kombiniert) sind wirksamer als Systeme mit nur einer Komponente, und ein höherer Anlagedruck (z. B. Kompressionsklasse III statt II) beschleunigt tendenziell die Ulkusheilung. Auch zur Rezidivprophylaxe gibt es Evidenz: Konsequent fortgesetzte Kompression (z. B. medizinische Kompressionsstrümpfe nach Ulkusheilung) senkt die Rate neuer Ulzera deutlich [15-17]. Die deutschsprachige S2k-Leitlinie fasst evidenzbasiert zusammen, wie Kompressionstherapie korrekt anzuwenden ist [18]. Sie empfiehlt die Kompression als Basistherapie bei allen chronischen Venenleiden inklusive CVI und Ulcus cruris venosum (sofern keine Kontraindikation vorliegt). Wichtig sind dabei die Auswahl geeigneter Kompressionsmittel (medizinische Kompressionsstrümpfe – MKS, mehrkomponentige Verbände oder adaptive Kompressionssysteme). Bei Kompressionsstrümpfen zeigen Strümpfe der Klasse 1 häufig schon eine ausreichende Wirkung sowohl bei der Behandlung von Ödemen als auch in der Thromboseprophylaxe bei mobilen Menschen (Tab. 4). Ein internationales Expertenkonsensus-Papier bestätigt die deutschen Leitlinien [19].
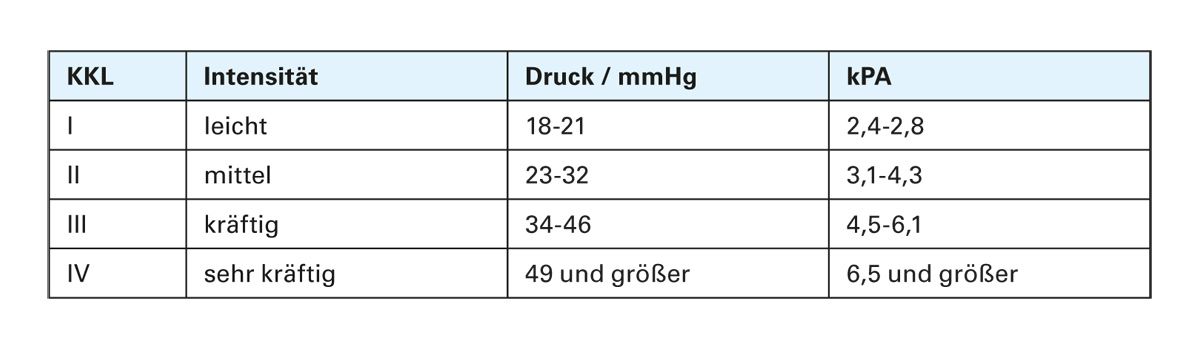
Tab. 4: Andrücke im Fesselbereich bei Verordnung der Strumpfart und Kompressionsklasse [modifiziert
nach 18].
Kontraindikationen
Bei der Kompressionstherapie gibt es nur selten Situationen, in denen sie nicht oder nur eingeschränkt angewendet werden darf. Laut AWMF-S2k-Leitlinie muss bei folgenden Zuständen auf eine Kompressionstherapie der Beine verzichtet werden:
- Fortgeschrittene pAVK: Definiert durch hämodynamisch kritische Durchblutungsparameter – z. B. ABI < 0,5; Knöchelarteriendruck < 60 mmHg; Zehendruck < 30 mmHg; oder transkutane Sauerstoffspannung (TcPO2) < 20 mmHg am Fußrücken. In solchen Fällen würde Kompression die schon mangelnde arterielle Perfusion weiter reduzieren und kann eine kritische Ischämie bis hin zur Nekrose provozieren. In Einzelfällen kann bei ABI 0,5-0,6 eine vorsichtige Kompression mit rein unelastischen Materialien unter engmaschiger Kontrolle versucht werden, allerdings nur durch erfahrene Spezialisten.
- Dekompensierte Herzinsuffizienz (NYHA III-IV): Herzinsuffizienz mit Ruhestauung ist eine Kontraindikation, da der venöse Rückstrom durch Kompression das bereits überlastete Herz weiter belasten würde. Zunächst muss die Herzinsuffizienz behandelt und stabilisiert werden.
- Septische Phlebitis: Bei einer bakteriell entzündeten, septischen Thrombophlebitis (meist mit Allgemeininfektion) darf keine Kompression erfolgen, um keine Keimverschleppung oder zusätzlichen Gewebestress zu verursachen. Hier steht die antiinfektive Therapie im Vordergrund.
- Phlegmasia cerulea dolens: Bei dieser seltenen fulminanten tiefen Venenthrombose mit fast vollständigem venösen Abstromhindernis und drohender Ischämie könnte Kompression den Abstrom nicht verbessern, aber die arterielle Minderdurchblutung verstärken.
Praktische Anwendung der Kompressionstherapie bei CVI und pAVK
Eine pAVK ist keine absolute Kontraindikation für eine Kompressionstherapie, z. B. können Patienten mit einem Ulcus cruris venosum und einer begleitenden pAVK davon profitieren [7]. Bezüglich Indikationen und Kontraindikationen sollten die aktuellen Leitlinien zur medizinischen Kompressionstherapie und Therapie des Ulcus cruris venosum beachtet werden [8, 18]. Bei einer Kompressionstherapie sollte auch bedacht werden, dass es bei einer pAVK durch die Mangelversorgung zu einer Weichteilatrophie kommen kann, was das Risiko für kritische Druckstellen erhöht. In einer Studie wurden Patienten mit Beinulzera gemischter Ätiologie untersucht, die mit unelastischen Bandagen mit einem Druck von 20 bis 30, 31 bis 40 und 41 bis 50 mm Hg versorgt wurden [20]. Die Autoren folgern, dass bei Patienten mit gemischten Ulzerationen, einem Knöchel-Arm-Index > 0,5 und einem absoluten Knöcheldruck von > 60 mm Hg eine unelastische Kompression von bis zu 40 mm Hg die arterielle Perfusion nicht behindert, jedoch zu einer Normalisierung der stark verminderten venösen Pumpfunktion führt [20]. Die intermittierende pneumatische Kompressionstherapie (IPK) gilt als vielversprechende Alternative zu herkömmlichen Behandlungen zur Linderung vieler Symptome der peripheren arteriellen Verschlusskrankheit (pAVK) in den Beinen, wobei vermutlich verschiedene Aspekte zum Wirkmechanismus beitragen [21, 22]:
- Absenken des Drucks der Beinvenen
- Erhöhung des arterio-venösen Druck-Gradienten
- Erhöhung des arteriellen Einstroms
- Erhöhung der Scherkräfte als Stimulus der Angioneogenese
Ein Review von 2021 fasst den aktuellen Wissensstand zur Rolle der Kompressionstherapie bei der Behandlung von gemischten arteriellen und venösen Beingeschwüren zusammen. Die Autoren kommen zu dem Schluss, dass die Kompressionstherapie mit Drücken zwischen 20 und 30 mmHg die Heilung bei mäßiger arterieller Insuffizienz (0,5 ≤ ABI ≤ 0,8) fördern kann. Bei einem ABI < 0,5 kann sie in Betracht gezogen werden, sobald ein akzeptabler ABPI wiederhergestellt ist [23]. Die deutsche Leitlinie [18] und das internationale Konsensus-Dokument zu Risiken und Kontraindikationen in der medizinischen Kompressionstherapie [19] geben ergänzende Empfehlungen für den Versorgungsalltag:
- Jeder Patient, der medizinische Kompressionstherapie erhält, sollte vorab klinisch auf das Vorliegen möglicher Risikofaktoren untersucht werden.
- Bei Patienten mit Polyneuropathie bzw. Sensibilitätsverlust werden besondere Vorsichtsmaßnahmen vorgeschlagen (Abpolstern knöcherner Strukturen, Überprüfung der Passform, Wahl einer niedrigen Kompressionsklasse und engmaschige Kontrollen).
- Bei jedem Patienten mit einem ABI < 0,9 soll der Effekt der medizinischen Kompressionstherapie engmaschig kontrolliert werden.
- Fortgeschrittene pAVK soll als Kontraindikation berücksichtigt werden, wenn einer dieser Parameter zutrifft: ABI < 0,5, Knöchelarteriendruck < 60 mmHg, Zehendruck < 30 mmHg oder TcPO2 < 20 mmHg Fußrücken.
- Zur sachgerechten Durchführung gehören die Abpolsterung von druckgefährdeten Bereichen und die regelmäßige Hautpflege.
Die Kompression mittels medizinischer Kompressionsstrümpfe (MKS) gilt als Standardmethode zur langfristigen Therapie der CVI. In Kombination mit einer pAVK galten MKS lange als potenziell riskant, da befürchtet wurde, dass durch den kontinuierlichen Druck die arterielle Perfusion weiter eingeschränkt werden könnte. Daten aus den 2020er-Jahren zeigen jedoch, dass MKS bei CVI und pAVK sicher eingesetzt werden können [24-26]. Die Einteilung der pAVK-Leitlinie erfolgt klassisch nach dem klinischen Beschwerdebild (z. B. Fontaine-Stadium), während sich die Kontraindikationen für Kompressionstherapie laut S2k-Leitlinie Kompressionstherapie an hämodynamischen Kriterien orientieren. Demnach sind zum Beispiel Patienten mit Fontaine-Stadium IIb (schmerzbedingte Gehstrecke < 200 m) nicht formal kontraindiziert. MKS mit niedriger Kompressionsklasse (Klasse I) und hoher Stiffness können demnach sicher bei Patienten mit ABI > 0,5 und Knöchelarteriendruck > 60 mmHg angewendet werden – vorausgesetzt, sie sind korrekt angepasst und regelmäßig kontrolliert [26]. Bei korrekt ausgewählten Patienten mit moderater pAVK kann der Einsatz spezifisch designter MKS demnach sicher und effektiv sein.
Fazit
Kompressionstherapie ist bei chronischer Veneninsuffizienz unverzichtbar und kann auch bei Vorliegen moderater pAVK und Diabetes sicher angewendet werde. Voraussetzung sind bei diesen kombinierten Erkrankungen eine sorgfältige Diagnostik, individuelle Anpassung und engmaschige Überwachung. Für den Praxisalltag bedeutet dies, zwar eine Nutzen-Risiko-Abwägung vorzunehmen, aber den Nutzen der Kompression möglichst zu nutzen. Die aktuelle Evidenz und Leitlinien bieten klare Leitplanken für den therapeutischen Entscheidungsprozess. Die pAVK-Stadieneinteilung (Fontaine) sollte in der Kompressionstherapie nicht isoliert verwendet werden, um über Kontraindikationen zu entscheiden. Hierfür gelten die Leitlinienparameter (ABI, Druckwerte) als Goldstandard.
Literatur
- Bergan JJ, Schmid-Schönbein GW, Smith PD et al (2006) Chronic venous disease. N Engl J Med 355:488-498
- Ludwig M et al. Gefäßmedizin in Klinik und Praxis. Thieme 2010: 280-285
- Salim S, Machin M, Patterson BO et al (2021) Global epidemiology of chronic venous disease: a systematic review with
pooled prevalence analysis. Ann Surg 274: 971-976 - Lurie F, Passman M, Meisner M et al (2020) The 2020 update of the CEAP classification system and reporting
standards. J Vasc Surg Venous Lymphat Disord 8(3): 342-352 - Espinola-Klein C (2024) Periphere arterielle Verschlusserkrankung. Herz 49: 313-318
- Aboyans V, Ricco JB, Bartelink MEL et al (2018) 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral
Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J 39:763-816 - S3-Leitlinie Diagnostik, Therapie und Nachsorge der peripheren arteriellen Verschlusskrankheit 2024. AWMFRegisternummer 065-003
- S2K-Leitlinie Diagnostik und Therapie des Ulcus cruris venosum 2024. AWMF-Registernummer 037-009
- Dissemond J, Bültemann A, Gerber V et al (2023) Der Begriff Ulcus cruris mixtum sollte heute nicht mehr verwendet
werden. Dermatologie 74(7): 555-559 - Riebe H, Jünger M, Hecko S et al (2023) Diagnostische Verfahren bei chronischer venöser Insuffizienz. Dermatologie
74: 145-157 - S2k-Leitlinie Diagnostik und Therapie der Lymphödeme 2017. AWMF-Registernummer 058-001
- Balletshofer B, Böckler D, Diener H et al (2024) Positionspapier zur Diagnostik und Therapie der peripheren arteriellen
Verschlusskrankheit (PAVK) bei Menschen mit Diabetes mellitus. Diabetologie 20: 261-270 - S2k-Leitlinie Diagnostik und Therapie der Varikose 2019. AWMF-Register Nr. 037/018
- O’Meara S, Cullum N, Nelson EA et al (2012) Compression for venous leg ulcers. Cochrane Database Syst Rev:
CD000265 - de Moraes Silva MA et al (2024) Compression for preventing recurrence of venous ulcers. Cochrane Database of Syst
Rev: CD002303 - Shi C et al (2021) Compression bandages or stockings versus no compression for treating venous leg ulcers. Cochrane
Database of Syst Rev: CD013397 - Dissemond J et al (2020) Evidenz der Kompressionstherapie unter besonderer Berücksichtigung der medizinischen
adaptiven Kompressionssysteme. Hautarzt 71: 301-308 - S2k-Leitlinie Medizinische Kompressionstherapie der Extremitäten mit Medizinischem Kompressionsstrumpf (MKS),
Phlebologischem Kompressionsverband (PKV) und Medizinischen adaptiven Kompressionssystemen (MAK) 2018.
AWMF-Registernummer 037-005 - Rabe E et al (2020) Risks and contraindications of medical compression treatment – A critical reappraisal. An
international consensus statement. Phlebology 35(7): 447-460 - Mosti G, Iabichella ML, Partsch H (2012) Compression therapy in mixed ulcers increases venous output and arterial
perfusion. J Vasc Surg 55(1): 122-128 - Sheldon RD et al (2013) New insights into the physiologic basis for intermittent pneumatic limb compression as a
therapeutic strategy for peripheral artery disease. J Vasc Surg 58(6): 1688-1696 - Artés A et al (2023) Effects of intermittent pneumatic compression on the recovery of cardiovascular parameters after
repeated sprint exercise. Eur J Appl Physiol 124(4): 1037-1048 - Lim SLX et al (2021) Modified compression therapy in mixed arterial-venous leg ulcers: An integrative review. Int
Wound J 18(6): 822-842 - Gastaldi G et al (2021) Chronic venous disease and diabetic microangiopathy: pathophysiology and commonalities. Int
Angiol 40(6): 457-69 - Rother U et al (2020) Safety of medical compression stockings in patients with diabetes mellitus or peripheral arterial
disease. BMJ Open Diab Res Care 8: e00131 - Stücker M et al (2020) Sicherheit eines Kompressionsstrumpfes für Patienten mit chronischer venöser Insuffizienz (CVI)
und peripherer arterieller Verschlusskrankheit (pAVK). JDDG 18: 207-214
Bildquellen
Titelbild: © Bauerfeind AG
Abb. 1: © Blue – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.