Impfungen und Immuntherapien mit TNF-Inhibitoren – Was ist zu beachten? Update 2024
Interessengebiete: Allgemeinmedizin und Innere Medizin, Neurologie, Gastroenterologie, Immunologie, Rheumatologie
Patientinnen und Patienten mit Autoimmunkrankheiten und anderen chronisch-entzündlichen Erkrankungen haben ein erhöhtes Infektionsrisiko. Grund ist ein geschwächtes Immunsystem entweder infolge der Erkrankung selbst, aufgrund von Komorbiditäten oder infolge einer immunsuppressiven Therapie. Bei Infektion mit bestimmten Erregern, wie z. B. Herpes zoster und Influenza kann der Verlauf der Infektionserkrankung schwerer sein und im Vergleich zu immunkompetenten Personen mit einem erhöhten Risiko für Komplikationen einhergehen. Zudem können Infektionskrankheiten einen Schub einer bestehenden Autoimmunerkrankung auslösen. Daher wird immundefizienten Patienten besonders empfohlen, auf ihren vollständigen Impfschutz zu achten. Der Vorteil eines vollständigen Impfschutzes schlägt sich in niedrigeren Raten an Krankenhauseinweisungen infolge von Infektionen, Besuchen in der Notfallaufnahme sowie invasiven Infektionskrankheiten nieder.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Patienten mit Autoimmunkrankheiten und anderen chronisch-entzündlichen Erkrankungen haben ein erhöhtes Infektionsrisiko [1]. Grund ist ein geschwächtes Immunsystem entweder infolge der Erkrankung selbst, aufgrund von Komorbiditäten oder infolge einer immunsuppressiven Therapie. Bei Infektion mit bestimmten Erregern, wie z. B. Herpes zoster und Influenza kann der Verlauf der Infektionserkrankung schwerer sein und im Vergleich zu immunkompetenten Personen mit einem erhöhten Risiko für Komplikationen einhergehen. Zudem können Infektionskrankheiten einen Schub einer bestehenden Autoimmunerkrankung auslösen [2]. Daher wird immundefizienten Patienten besonders empfohlen, auf ihren vollständigen Impfschutz zu achten. Der Vorteil eines vollständigen Impfschutzes schlägt sich in niedrigeren Raten an Krankenhauseinweisungen infolge von Infektionen, Besuchen in der Notfallaufnahme sowie invasiven Infektionskrankheiten nieder [3].
Dennoch ist die Inanspruchnahme von Impfungen bei chronisch kranken Personen suboptimal und variiert je nach Grunderkrankung zwischen 19 % und 44 % [4]. Beispielsweise lag die Inanspruchnahme von Influenza-Impfungen bei Patienten mit rheumatischen Erkrankungen bei teils nur 25 %, bei Impfungen gegen Pneumokokken noch niedriger [5]. Bedenken gegenüber Wirksamkeit, Immunogenität und Sicherheit bei immunsupprimierten Patienten waren die Hauptgründe für den Mangel an Überweisungen zum Impfen durch Rheumatologen und andere behandelnde Ärzte [6]. Ziel dieser CME ist es, einen umfassenden Überblick über die aktuellen Impf-Empfehlungen für Patienten mit immunsuppressiver Therapie zu geben. Der Fokus liegt dabei auf Patienten unter Therapie mit Tumor-Nekrose-Faktor- (TNF-) Inhibitoren, welche fachübergreifend in der Rheumatologie, Dermatologie und Gastroenterologie eingesetzt werden.
Allgemeines zu Immuntherapien
Die rheumatoide Arthritis (RA) als Beispiel aus der Rheumatologie ist die häufigste chronisch-entzündliche rheumatische Erkrankung bei Erwachsenen. Morbus Crohn und Colitis ulcerosa sind die am häufigsten auftretenden chronisch-entzündlichen Darmerkrankungen (CED). Psoriasis ist eine chronische, immunvermittelte systemische entzündliche Hauterkrankung. Zur Behandlung aller drei Entitäten hat sich die Pharmakotherapie mit entzündungshemmenden, immunsuppressiven Medikamenten durchgesetzt.
Als Basistherapie werden in der Regel Immunsuppressiva nicht biologischen Ursprungs, wie Glucocorticoide, Methotrexat, Leflunomid, Azathioprin oder Ciclosporin eingesetzt. Mit dem besseren Verständnis der jeweiligen krankheitsspezifischen Immunpathogenese wurden moderne Wirkstoffe entwickelt, die gezielt in die Kommunikation zwischen Immunzellen eingreifen und so besser an die jeweilige Erkrankung angepasst sind. So führte die Identifizierung der Interleukin 23 (IL-23) / T-Helfer 17 (Th17)-Immunachse als Haupttreiber der Psoriasis-Entzündung zur Entwicklung systemischer Biologika, die speziell auf diesen Weg abzielen [7]. Inhibitoren des zentralen Entzündungsfaktors TNF waren die ersten Biologika, die bei mittelschwerer bis schwerer Psoriasis eingesetzt wurden.
Zu dieser Gruppe gehören die monoklonalen, humanen Antikörper Adalimumab und Golimumab, der chimäre Antikörper Infliximab, das humanisierte Fab-Fragment Certolizumab pegol, sowie das humane Fusionsprotein Etanercept (Abb. 1). Bei nachfolgenden Entwicklungen wurden verschiedene Wirkmechanismen verwendet, beispielsweise Inhibition von Interleukin 12/23 (Indikationsgebiet CED, Psoriasis, Psoriasis-Arthritis) und IL-17-Inhibition (Indikationsgebiet RA, Psoriasis-Arthritis, Psoriasis), IL-1- und IL-6-Inhibition (RA), Hemmung der T-Zell-Aktivierung durch Abatacept und Depletion von T-Zellen durch Rituximab (RA). Der monoklonale Antikörper Vedolizumab bindet selektiv an das α4β7-Integrin auf aktivierten Lymphozyten und verhindert die Adhäsion der Lymphozyten am Gefäßendothel und die nachfolgende Migration ins Darmgewebe, sodass die lokale Entzündung eingedämmt wird (CED). Trotz des ständig wachsenden Biologika-Marktes mit „moderneren“ Wirkmechanismen gehören TNF-Inhibitoren noch immer zu den am häufigsten verschriebenen biologischen Therapeutika in der Dermatologie.
Die solide Datenlage zu Wirksamkeit und Sicherheit bei systemischer Langzeittherapie, teilweise über bereits mehr als 20 Jahre, ist dabei ein wichtiges Kriterium im Entscheidungsprozess. Zudem verfügen TNF-Inhibitoren über eine größere Indikationsbreite als die neueren Wirkstoffe. Nachdem Adalimumab zunächst 2003 in der EU erstmals für RA zugelassen wurde, wurde die Zulassung inzwischen auf 13 weitere Indikationen ausgeweitet, darunter mittelschwere bis schwere Psoriasis, Acne inversa Psoriasis-Arthritis, Morbus Crohn und Colitis ulcerosa. Mit dem Ablauf des zehnjährigen Patentschutzes ist mittlerweile auch der Markt für Biosimilars der TNF-Inhibitoren Adalimumab, Infliximab und Etanercept offen, was zu einer Kostensenkung dieser Produkte insgesamt führte und mehr Patienten den Zugang zu diesen Wirkstoffen ermöglichte.
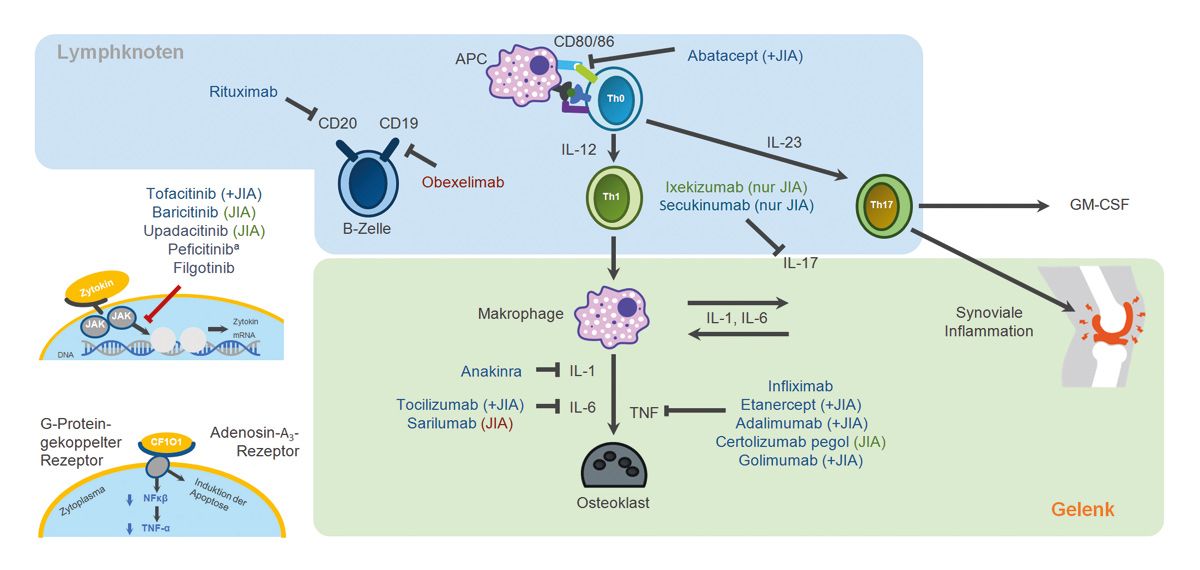
Abb. 1: Wirkmechanismus verschiedener Biologika am Beispiel Rheumatoide Arthritis und juvenile idiopathische Arthritis (JIA). Adalimumab, Golimumab, Infliximab, Certolizumab pegol und Etanercept blockieren den zentralen Entzündungsfaktor TNF. Anakinra blockiert Interleukin-1, Tocilizumab und Sarilumab hemmen IL-6. Rituximab indiziert eine B-Zell-Depletion durch Bindung an das Oberflächenmolekül CD20. Ixekizumab und Secukinumab blockieren IL-17. Auch Abatacept blockiert T-Lymphozyten. Blau=zugelassen in der EU und/oder den USA; grün=Phase III; rot=Phase II; ain Japan zugelassen (Stand Januar 2024). Modifiziert nach Her M, Kavanaugh A (2015), Kofoed K et al. (2015) und Murray GM, et al. (2021)
Allgemeines zu Impfungen
Impfungen gehören zu den wirksamsten und wichtigsten medizinischen Maßnahmen. Unmittelbares Ziel einer Impfung ist es, Geimpfte vor einer bestimmten Krankheit zu schützen. Ein weiteres Ziel ist der Gemeinschaftsschutz, da eine Impfung nicht nur die geimpfte Person, sondern auch andere schützt (Kokonstrategie). Dadurch kommt es zu einer geringeren Verbreitung von Krankheitserregern. Dies ist besonders wichtig für Personen, die sich nicht impfen lassen können (z. B. Säuglinge in den ersten 6-8 Lebenswochen und immungeschwächte Personen). Bei ausreichend hohen Impfquoten ist es möglich, bestimmte Krankheitserreger regional zu eliminieren und schließlich weltweit auszurotten. Die Erarbeitung von Empfehlungen zur Durchführung von Schutzimpfungen und anderen Maßnahmen der spezifischen Prophylaxe übertragbarer Krankheiten erfolgt in Deutschland durch die Ständige Impfkommission (STIKO), ein im Infektionsschutzgesetz (IfSG) verankertes unabhängiges Expertengremium aus 12 bis 18 Mitgliedern, das vom Bundesministerium für Gesundheit (BMG) im Benehmen mit den obersten Landesgesundheitsbehörden alle 3 Jahre berufen wird.
Die Erarbeitung von Impfempfehlungen erfolgt evidenzbasiert mittels medizinisch-epidemiologischer Nutzen-Risiko-Bewertung. Dabei geht die Bewertung der STIKO über eine individuelle Risiko-Nutzen-Bewertung hinaus und schätzt auch potenzielle Auswirkungen einer Impfung auf der Bevölkerungsebene ab. Die Empfehlungen der STIKO werden in der Regel einmal jährlich im Epidemiologischen Bulletin des Robert-Koch-Instituts (RKI) und auf den Internetseiten des RKI veröffentlicht. Der Gemeinsame Bundesausschuss (G-BA) entscheidet auf Grundlage der STIKO-Empfehlungen, ob eine Impfung in die Schutzimpfungsrichtlinie aufgenommen und damit zur Pflichtleistung der Gesetzlichen Krankenkassen wird. Die empfohlenen Standardimpfungen für Säuglinge, Kinder, Jugendliche und Erwachsene werden jeweils im jährlich aktualisierten Impfkalender veröffentlicht (Tab. 1).

Tab. 1: Impfkalender (Standardimpfungen) 2024 für Säuglinge, Kinder, Jugendliche und Erwachsene, Stand November 2024 (modifiziert nach [8]).
G=Grundimmunisierung (in bis zu 3 Teilimpfungen G1 – G3); S=Standardimpfung; A=Auffrischimpfung; N=Nachholimpfung (Grundimmunisierung aller noch nicht Geimpften bzw. Komplettierung einer unvollständigen Impfserie); U=Früherkennungsuntersuchung; J=Jugenduntersuchung (J1 im Alter von 12–14 Jahren). a RSV (monoklonale Antikörper): Zwischen April und September Geborene sollen Nirsevimab im Herbst vor Beginn ihrer 1. RSV-Saison erhalten; Neugeborene jeglichen Gestationsalters, die während der RSV-Saison (meist zwischen Oktober und März) geboren werden, sollen Nirsevimab möglichst rasch nach der Geburt erhalten, idealerweise bei Entlassung aus der Geburtseinrichtung bzw. bei der U2 (3.-10. Lebenstag). b Rota: Erste Impfstoffdosis bereits ab dem Alter von 6 Wochen, je nach verwendetem Impfstoff 2 bzw. 3 Impfstoffdosen im Abstand von mind. 4 Wochen. c TdaPHibIPV/HepB/Pnc: Frühgeborene: zusätzliche Impfstoffdosis im Alter von 3 Monaten, d. h. insgesamt 4 Impfstoffdosen. d TdaPHibIPV/HepB/Pnc: Mindestabstand zur vorangegangenen Dosis: 6 Monate. e MenB: 3 Dosen im Alter von 2 bis 23 Monaten, ab 24 Monaten besteht die Impfserie aus 2 Dosen. f HPV: Zwei Impfstoffdosen im Abstand von mind. 5 Monaten, bei Nachholimpfung beginnend im Alter ≥ 15 Jahren oder bei Impfabstand von < 5 Monaten zwischen 1. und 2. Dosis ist eine 3. Dosis erforderlich. g Td(ap): Td-Auffrischimpfung alle 10 Jahre. Nächste fällige Td-Impfung 1-malig als Tdap- bzw. bei entsprechender Indikation als Tdap-IPV-Kombinationsimpfung. h MMR: Eine Impfstoffdosis eines MMR-Impfstoffs für alle nach 1970 geborenen Personen ≥ 18 Jahre mit unklarem Impfstatus, ohne Impfung oder mit nur einer Impfung in der Kindheit. i Pnc: Impfung mit PCV20. j COVID19: Für den Schutz von Personen ohne Grunderkrankung sind (mindestens) 3 Antigen-Kontakte nötig, davon mindestens 1 als Impfung. k H. zoster: Zwei Impfstoffdosen des adjuvantierten Herpes-zoster-Totimpfstoff im Abstand von mindestens 2 bis maximal 6 Monaten. l RSV (Impfung): 1-malige Impfung mit einem proteinbasierten RSV-Impfstoff im Spätsommer/Herbst vor Beginn der RSV-Saison. * Impfungen können auf mehrere Impftermine verteilt werden. MMR und V können am selben Termin oder in 4-wöchigem Abstand gegeben werden.
Allgemeines zu Impfstoffen
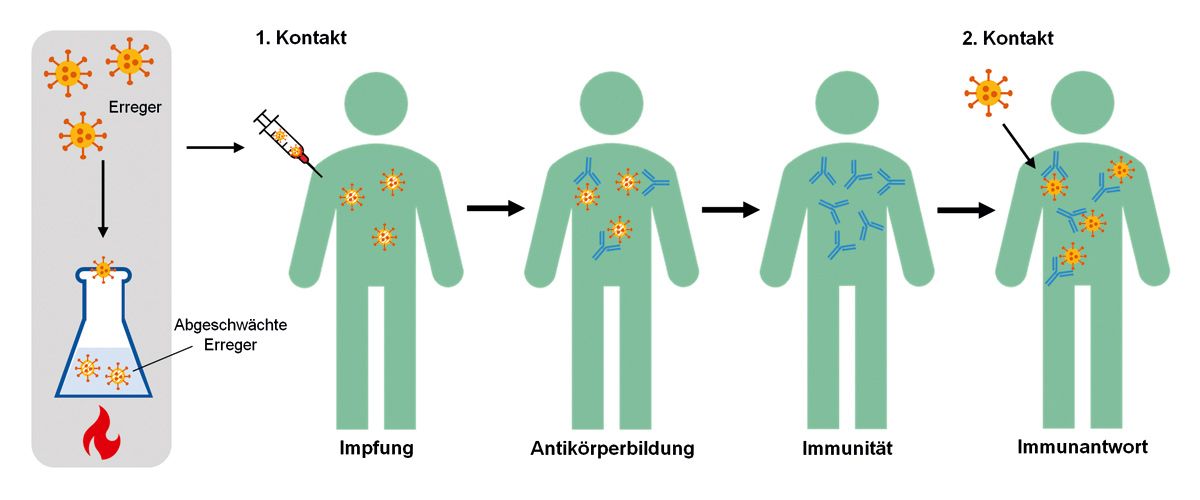
Bei einem klassischen Impfstoff handelt es sich um ein biologisch oder gentechnisch hergestelltes Antigen. Eine Ausnahme stellen die Vektorimpfstoffe und die neuen mRNA-Vakzine dar, bei denen das Antigen von körpereigenen Zellen hergestellt wird. Bis 2020 in Deutschland zugelassene Impfstoffe bestehen meistens aus Protein-Bruchstücken abgetöteter bzw. attenuierter Erreger. Der Impfstoff nutzt die natürliche Reaktion des Immunsystems, auf Erreger eine humorale (erreger-spezifische Antikörper) sowie zelluläre (T-Zellen) Immunantwort zu induzieren. Bei der Immunisierung kommt es zum langfristigen Schutz, indem der Körper Antikörper und Gedächtniszellen bildet. Bei erneutem Kontakt mit echten Erregern leiten noch vorhandene Antikörper und Gedächtniszellen eine rasche Immunantwort ein, die dann eine Erkrankung abwehren soll (Abb. 2).
Klassisch lassen sich Impfstoffe in Tot- und Lebendimpfstoffe unterteilen. Attenuierte Lebendimpfstoffe enthalten geringe Mengen vermehrungsfähiger Krankheitserreger. Diese können sich vermehren, aber die Krankheit nicht auslösen. Sie können jedoch krankheitsähnliche Beschwerden auslösen. Bei viralen Lebendimpfungen hält der Schutz nicht selten lebenslang an. Beispiele für virale Lebendimpfungen sind Gelbfieber, Masern, Mumps, Röteln, Windpocken, Denguefieber, Chikungunya-Fieber und Mpox.
Bei Totimpfstoffen werden ganze abgetötete Erreger, Bruchstücke (Subunits; meist rekombinant hergestellt) oder deren Gift (Toxoide) verabreicht.
Der Impfstoff wird vom Körper als fremd erkannt, es kommt zur Bildung von Antikörpern ohne Ausbruch der Krankheit. Die abgetöteten Erreger können sich nicht vermehren oder die Krankheit auslösen. Der Impfschutz muss in vielen Fällen regelmäßig bzw. bei Exposition aufgefrischt werden. Beispiele für Totimpfstoffe sind Vakzine gegen Diphtherie, Frühsommer-Meningoenzephalitis (FSME), Haemophilus influenzae b, Hepatitis A, Hepatitis B, Herpes zoster, Humane Papillomviren (HPV), Japanische Enzephalitis, Pertussis, Polio, Meningokokkeninfektionen, Pneumokokkeninfektionen, Tetanus, Tollwut und respiratorische Synzytial-Viren (RSV). Gegen Cholera, Influenza und Typhus sind in Deutschland sowohl Tot- als auch Lebendimpfstoffe zugelassen.
Bei allen Impfstoffen wird durch die Impfung eine humorale wie auch zellvermittelte Immunantwort ausgelöst. Dies geschieht je nach Art des Impfstoffs auf verschiedenen Wegen (Abb. 3) [9].
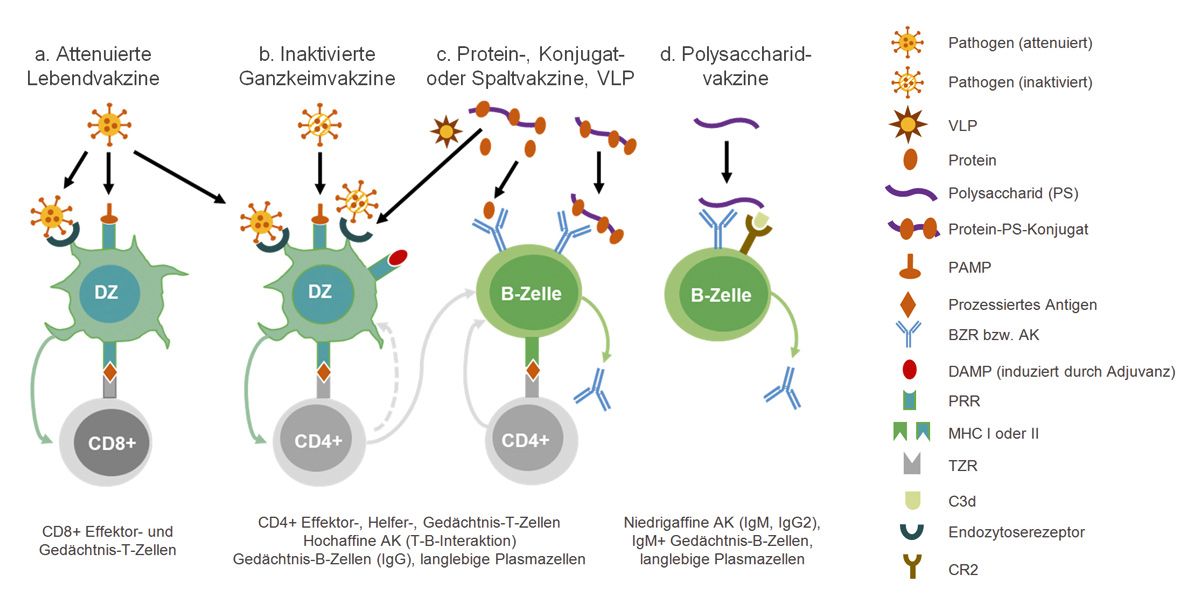
Abb. 3: (a) Impfstoffe aus lebenden attenuierten, (b) abgetöteten intakten Erregern und (c) virusähnlichen Partikeln (VLP) oder Spaltimpfstoffe werden von dendritischen Zellen (DZ) über Endozytose-Rezeptoren aufgenommen und degradiert. Die daraus resultierenden Peptide werden über Klasse I bzw. Klasse II Gewebeverträglichkeitsmoleküle (MHC) an die T-Zellrezeptoren (TZR) naiver Cluster of Differentiation (CD)8+ bzw. CD4+ T-Lymphozyten präsentiert, die sich daraufhin in Effektor-, Helfer- und Gedächtnis-T-Zellen differenzieren. Bestimmte Erregerkomponenten (sog. pathogen-associated molecular patterns, PAMPs) binden an die entsprechenden Rezeptoren auf den DZ und verstärken durch die Induktion von Zytokinen und kostimulatorischen Molekülen deren T-Zell-stimulatorische Aktivität (blaue Pfeile). Einen ähnlichen Effekt üben Adjuvantien aus, welche u. a. die Freisetzung von endogenen, immunstimulativen Gefahrenmolekülen (sog. danger-associated molecular patterns, DAMPs) auslösen. Die protektive Funktion von Vakzin-induzierten CD8+ Effektor- bzw. Gedächtniszellen besteht in der Zytotoxizität gegenüber Wirtszellen nach Infektion mit virulenten Wildtyp-Erregern. Vakzin-induzierte CD4+ T-Lymphozyten hingegen vermitteln primär Schutz durch Aktivierung von DZ (gestrichelter grauer Pfeil) und Makrophagen zur antimikrobiellen Aktivität sowie durch Stimulierung von B-Lymphozyten zur Umwandlung in Antikörper (AK)-produzierende Plasmazellen und Gedächtnis-B-Zellen (durchgezogener grauer Pfeil). (c) Bei Protein-Vakzinen kommt es zur Antigenaufnahme durch DZ (via Endozytose-Rezeptoren) oder B-Lymphozyten (via B-Zellrezeptor [BZR]) und nachfolgenden Antigenpräsentation an CD4+ T-Lymphozyten, die dann wiederum als Helferzellen die AK-Produktion von B-Zellen unterstützen. Bei Konjugat-Vakzinen (bestehend aus dem Polysaccharid [PS] und einem immunogenen Protein) wird die Anti-PS-Immunantwort der B-Zellen durch die parallele („bystander“) Zytokinfreisetzung peptidreaktiver T-Lymphozyten (welche durch proteinprozessierende und peptidpräsentierende DZ oder B-Zellen aktiviert wurden) verstärkt (graue durchgezogene Pfeile), sodass PS-reaktive hochaffine Antikörper sowie PS-spezifische klassische Gedächtnis-B-Zellen und langlebige Plasmazellen entstehen. (d) Reine Polysaccharid-Vakzine binden direkt an membranständiges Immunglobulin M (BZR) sowie nach alternativer Komplementaktivierung über C3d an den Typ 2 Komplementrezeptor (CR2) auf der Oberfläche von B-Lymphozyten. Diese T-Zell-unabhängige B-Zellaktivierung führt zur Bildung von langlebigen Plasmazellen und Immunglobulin M+ Gedächtnis-B-Zellen, die niedrigaffine Immunglobulin M und Immunglobulin G2 Antikörper synthetisieren. [Modifiziert nach Niehues 2017]
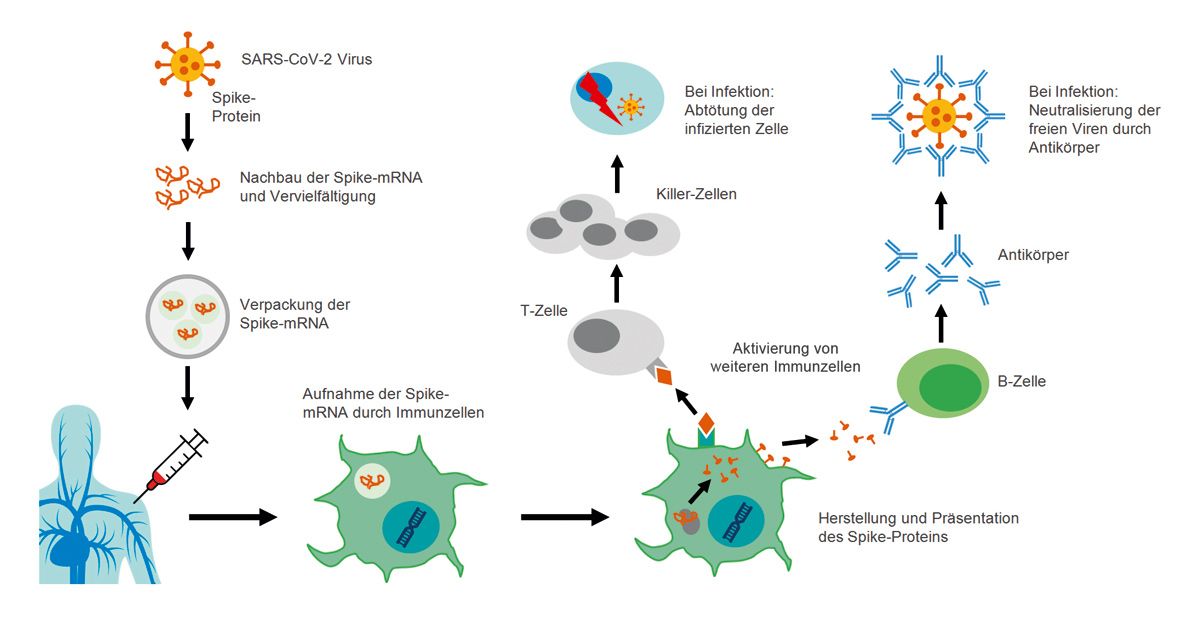
mRNA-Impfstoffe stimulieren die körpereigene Immunantwort. Die mRNA-basierten Impfstoffe werden rein synthetisch hergestellt und sind nicht infektiös. Sie enthalten selbst keine viralen Proteine, sondern nur die Informationen, die die körpereigenen Zellen benötigen, um ein virusspezifisches Protein zu produzieren, das die gewünschte Immunantwort auslöst. Ein mRNA-Impfstoff besteht aus einem mRNA-Strang, der für ein krankheitsspezifisches Protein (Antigen) kodiert. Im Fall der mRNA-Impfstoffe gegen COVID-19 wurde die mRNA des Spike-Proteins verwendet, das sich an der Oberfläche des Coronavirus befindet. Die mRNA ist von einer Lipidhülle umgeben, welche die Aufnahme der mRNA in die Körperzellen verbessert und die Impfstoffstabilität erhöht. Anhand der Informationen aus der mRNA kann der Körper das Antigen, in dem Falle das nicht infektiöse virale Spike-Protein, selbst produzieren. Dies geschieht im Zytoplasma. Antigen-präsentierende Zellen (APZ) im Körper präsentieren dann das Antigen auf ihrer Oberfläche und lösen dadurch die gewünschte spezifische Immunantwort aus. Es kommt zur Aktivierung von T-Zellen, die in der Lage sind, infizierte Zellen zu erkennen und zu eliminieren.
Zudem produzieren B-Zellen neutralisierende Antikörper gegen das Spike-Protein. Die Immunantwort wird somit hauptsächlich mithilfe von T-Zellen und über die Produktion neutralisierender Antikörper durch B-Zellen erreicht, mit dem Ziel, die Erkrankung COVID-19 zu verhindern. Wenn der Körper mit dem Virus in Kontakt kommt, erkennt das Immunsystem das spezifische Antigen und kann das Virus und somit die Infektion schnell und gezielt bekämpfen. Dadurch wird die Replikation und Ausbreitung des Virus im menschlichen Körper sowie die Übertragung auf andere Personen verhindert (Abb. 4) [10]. Alle derzeit in Deutschland verfügbaren und zugelassenen COVID-19-Impfstoffe sind in Bezug auf Patienten mit Immundefizienz wie Totimpfstoffe zu betrachten und können auch bei dieser vulnerablen Gruppe sicher angewendet werden [11].
Vektorimpfstoffe verwenden ein für den Menschen harmloses, nicht replikationsfähiges Trägervirus, um die DNA des Antigens in die menschliche Zelle zu bringen. Nachdem die Vektorimpfstoffe gegen COVID-19 keine Rolle mehr im klinischen Alltag spielen, wird diese Impfstoff-Art aktuell nur gegen Ebola eingesetzt.
Impfungen bei Patienten unter Therapie mit TNF-Inhibitoren
Der Impfstatus sollte vor Beginn einer Therapie überprüft und gemäß den aktuellen Impfempfehlungen vervollständigt werden. Danach wird eine jährliche Überprüfung des Impfstatus empfohlen. Das individuelle Impfprogramm sollte dem Patienten vom Facharztteam erklärt werden, so dass eine Grundlage für gemeinsame Entscheidungen besteht, die dann vom Hausarzt, dem Facharztteam und dem Patienten gemeinsam umgesetzt werden. Impfungen sollten bei stabiler Erkrankung erfolgen. Um einen optimalen Impferfolg zu erzielen, sollten alle Impfungen idealerweise vor Beginn einer immunsuppressiven Therapie abgeschlossen sein, wobei je nach Immunsuppressivum bestimmte zeitliche Abstände zwischen Impfung und Beginn der Therapie einzuhalten sind.
Totimpfstoffe können auch ohne ein erhöhtes Risiko für unerwünschte Wirkungen während der Therapie mit TNF-Inhibitoren verabreicht werden. In dem Fall sollte für ein bestmögliches Impfansprechen die Impfung in der Mitte des Behandlungsintervalls erfolgen, wenn die Immunsuppression möglichst gering ist [12]. In Studien zu verschiedenen Indikationen (z. B. rheumatoide Arthritis, Psoriasis, Morbus Crohn) haben Impfungen mit Totimpfstoffen während der Behandlung mit TNF-Inhibitoren eine niedrigere Immunantwort ausgelöst als bei Patienten, die keine TNF-Inhibitoren erhalten haben [13]. Daher wird empfohlen, eine Antikörperkontrolle durchzuführen. Die Stärke der Immunantwort kann je nach Therapie und Grunderkrankung unterschiedlich ausfallen (Tab. 2). Da die Wirksamkeit von Impfungen bei Personen mit angeborener oder erworbener Immundefizienz reduziert sein kann, sollten deren Kontaktpersonen gemäß der Kokonstrategie vollständig inklusive Auffrischimpfung geimpft sein.
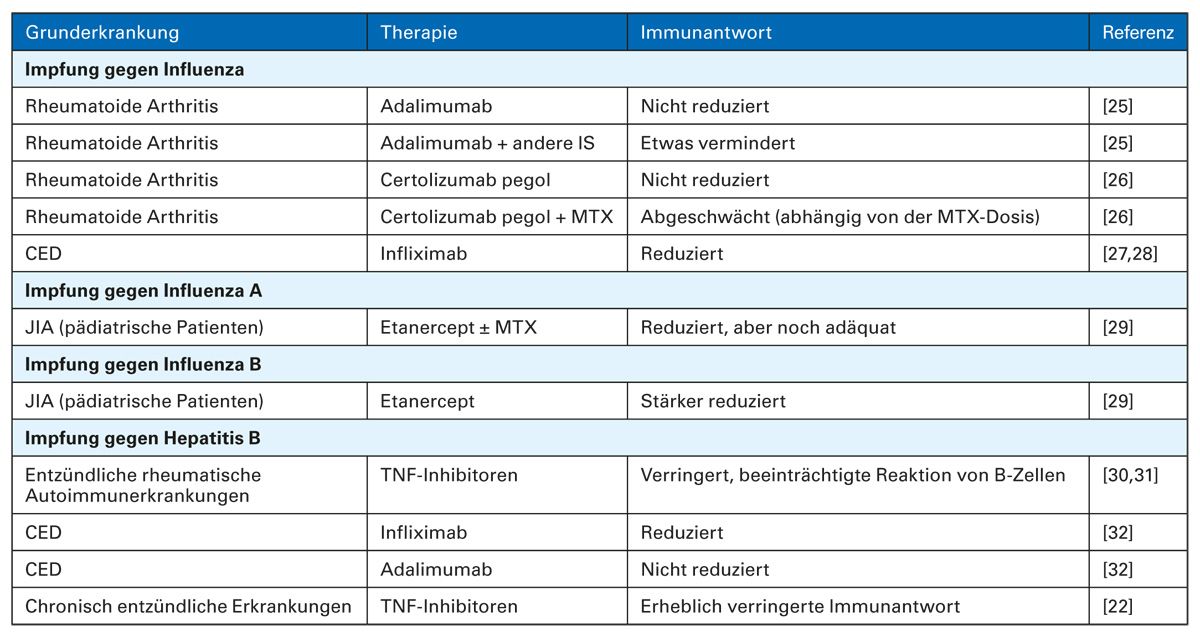
Tab. 2: Immunantwort in Anhängigkeit von Therapie und Grunderkrankung
Die Tabelle basiert auf einer Literaturrecherche und erhebt keinen Anspruch auf Vollständigkeit. Die Aussagekraft der Auswirkungen der jeweiligen TNF-Inhibitoren auf die Immunantwort ist limitiert, da keine Fallkontrollstudien durchgeführt wurden. Weitere Limitationen sind geringe Fallzahlen, Vergleiche mit und ohne MTX sowie Reduktion der Immunantwort durch Faktoren wie Alter und Komorbiditäten.
CED, chronisch-entzündliche Darmerkrankungen; IS, Immunsuppressiva; JIA, juvenile idiopathische Arthritis; MTX, Methotrexat
Die Verabreichung von Lebendimpfstoffen ist während der Therapie mit Immunsuppressiva kontraindiziert, da die Anwendung zu symptomatischen Infektionen, einschließlich disseminierten Infektionen mit schweren bis tödlichen Komplikationen durch die attenuierten Impfviren führen kann. Impfungen sind im Ausnahmefall bei geringgradiger Immunsuppression im Einzelfall möglich, erfordern jedoch eine genaue Risiko-Nutzen-Abschätzung [12]. Notwendige Impfungen mit Lebendimpfstoffen sollten mindestens vier Wochen vor Therapiebeginn abgeschlossen sein und sind, abhängig von der angewendeten Therapie, frühestens ein Monat (Infliximab: 3 Monate) nach Therapieende wieder möglich.
Gegen Influenza empfiehlt die STIKO die jährliche Impfung im Herbst mit einem inaktivierten Impfstoff mit aktueller von der WHO empfohlener Antigenkombination [14]. Für Personen ≥ 60 Jahre werden ein inaktivierter Hochdosis- oder ein MF59-adjuvanzierter Impfstoff empfohlen [14,15]. Bei Immundefizienz kann erwogen werden, zwei Impfstoffdosen des regulären Impfstoffs im Abstand von 4 Wochen zu verabreichen [16]. Bei geplanter Therapie mit Rituximab oder Abatacept sollte die Influenza-Impfung möglichst 4 Wochen vor Therapiebeginn erfolgen, um eine optimale Immunantwort zu bekommen [12]. Ergebnisse einer randomisierten klinischen Studie bei Erwachsenen mit RA haben gezeigt, dass selbst ein Pausieren einer niedrigen MTX-Dosierung von 2 Wochen vor und 2-4 Wochen nach einer Influenza-Impfung die Impfantwort verbesserte, ohne einen RA-Schub zu induzieren [17].
Die europäische Rheumaliga und die STIKO empfehlen, Patienten mit entzündlichen rheumatischen Autoimmunerkrankungen gegen Influenza und Pneumokokken impfen zu lassen [6]. Ebenso rät die Deutsche Gesellschaft für Gastroenterologie, Verdauungsund Stoffwechselkrankheiten (DGVS), nicht-immunisierte CED-Patienten zum Schutz vor einer zusätzlichen Atemwegsinfektion gegen Influenza und Pneumokokken zu impfen [18]. Dementsprechend empfiehlt die STIKO aufgrund des erhöhten Risikos einer invasiven Pneumokokkenerkrankung Personen ≥ 18 Jahre mit einer angeborenen oder erworbenen Immundefizienz eine Impfung mit PCV20. Die Anwendung von PPSV23 alleine oder als sequenzielle Impfung wird Erwachsenen nicht mehr empfohlen [19]. Derzeit wird Kindern und Jugendlichen im Alter von 2 bis 17 Jahren mit Immundefizienz weiterhin die sequenzielle Impfung mit einem für diese Altersgruppe zugelassenen Konjugat-Impfstoff (PCV13 oder PCV15), gefolgt von PPSV23 in einem Abstand von 6 – 12 Monaten, empfohlen. Aufgrund der begrenzten Schutzdauer von PPSV23 soll die Impfung mit PPSV23 mit einem Mindestabstand von 6 Jahren wiederholt werden [20].
Die Impfung gegen COVID-19 soll mit einem zugelassenen mRNA- oder Proteinbasierten Impfstoff mit einer jeweils von der WHO empfohlenen Variantenanpassung erfolgen. Die von der STIKO empfohlene Basisimmunität gegen SARS-CoV-2 wird durch mindestens 3 SARS-CoV-2-Antigenkontakte (Impfung oder Infektion) erreicht. Bei immundefizienten Personen können zusätzlich weitere Impfstoffdosen in einem Abstand von mindestens je 4 Wochen notwendig sein, um die Basisimmunität zu erreichen. Die Impfantwort kann serologisch mittels quantitativer Bestimmung spezifischer Antikörper gegen das SARS-CoV-2-Spikeprotein überprüft werden. Dies sollte frühestens 4 Wochen nach Verabreichung einer Impfstoffdosis erfolgen. Sollte trotz wiederholter Impfstoffgabe keine suffiziente Antikörperantwort erzielt worden sein, kann die Dosis als Off-Label-Use erhöht (z. B. verdoppelt) werden oder ein Impfstoff verwendet werden, der auf einer anderen Technologie beruht. Um die erzielte Schutzwirkung aufrechtzuhalten, kann die Verabreichung weiterer Impfstoffdosen zusätzlich zur jährlichen Auffrischimpfung im Herbst notwendig sein [20].
Die STIKO empfiehlt allen Personen ≥ 75 Jahre eine einmalige Impfung gegen respiratorische Synzytial-Viren (RSV). Außerdem wird immundefizienten Personen im Alter von 60 bis 74 Jahren eine einmalige RSV-Impfung empfohlen. Die RSV-Impfung sollte möglichst im September/Anfang Oktober erfolgen, um bereits in der darauffolgenden RSV-Saison (Oktober-März) einen bestmöglichen Schutz zu bieten. Die RSV-Impfung kann gleichzeitig mit der saisonalen Influenza-Impfung verabreicht werden [21]. Patienten mit entzündlichen rheumatischen Autoimmunerkrankungen sollten eine Tetanus-Diphtherie-Pertussis-Impfung gemäß den Empfehlungen für die Allgemeinbevölkerung erhalten und auch sonst entsprechend den STIKO-Impfempfehlungen geimpft sein [6].
Die europäische Rheumaliga empfiehlt die Impfung von gefährdeten Patienten mit entzündlichen rheumatischen Autoimmunerkrankungen gegen Hepatitis B [6]. Eine retrospektive Studie ergab eine wesentlich geringere Immunantwort nach der standardmäßigen Dreifach-Impfung bei Patienten unter TNF-Inhibitor-Therapie gegen chronisch entzündliche Erkrankungen im Vergleich zu gesunden Probanden. Insbesondere die Anwendung von Infliximab, männliches Geschlecht und die Impfung ≥6 Monate nach Beginn der TNF-Inhibitor-Therapie waren Risikofaktoren für ein Nichtansprechen. Patienten mit chronisch entzündlichen Erkrankungen sollten daher vor oder in den ersten 6 Monaten nach Beginn einer Anti-TNF-Therapie gegen Hepatitis B geimpft werden [22]. Die STIKO empfiehlt eine Antikörperkontrolle 4-8 Wochen nach Abschluss der Grundimmunisierung. Eine Auffrischung mit einer weiteren Dosis bzw. höheren Antigendosen kann dann abhängig vom serologischen Erfolg in Erwägung gezogen werden [12].
Immunsupprimierte Patienten haben infolge nachlassender T-Zell-spezifischer Immunität ein erhöhtes Risiko für das Auftreten eines Herpes zoster durch Reaktivierung einer latenten Varizella-Zoster-Virus-Infektion. Eine Impfung gegen Herpes zoster kann daher bei Hochrisikopatienten mit entzündlichen rheumatischen Autoimmunerkrankungen in Betracht gezogen werden. Diese Empfehlung basiert auf einer Studie, an der 633 Patienten unter Biologika, vorwiegend TNF-Inhibitoren teilnahmen [6].
Die STIKO empfiehlt, bei angeborener oder erworbener Immundefizienz Personen ab dem Alter von 50 Jahren zur Prophylaxe eines Herpes zoster die zweimalige Impfung mit dem adjuvantierten Herpes-zoster-Totimpfstoff im Abstand von mindestens 2 bis maximal 6 Monaten [20]. Laut Fachinformation kann der Totimpfstoff auch bereits Erwachsenen ab 18 Jahren mit erhöhtem Risiko für Herpes zoster verabreicht werden, wobei die 2. Dosis bei Immunsupprimierten bereits nach einem Monat gegeben werden kann [23].
Aufgrund des erhöhten Risikos für Dysplasien/Neoplasien bei HPV-Infektionen empfiehlt die STIKO eine frühzeitige HPV-Impfung für alle Kinder und Jugendlichen im Alter von 9-14 Jahren. Nachholimpfungen sollten bis zum Alter von 17 Jahren erfolgen. Da die Antikörperspiegel bei Immunsupprimierten teilweise leicht reduziert sind, können diese Patienten unabhängig von der Altersgruppe von einem 3-Dosen-Impfschema profitieren, das auch für Kinder und Jugendliche zugelassen ist. Wegen des erhöhten Infektionsrisikos bei Immundefizienz können Personen ≥18 Jahre möglicherweise von einer HPV-Impfung profitieren, jedoch muss die Kostenübernahme vorab jeweils mit der Krankenkasse geklärt werden [12].
Bei Aufenthalten in FSME-Risikogebieten empfiehlt die STIKO die rechtzeitige Grundimmunisierung gegen FSME [12]. Über aktuelle Risikogebiete informiert das RKI regelmäßig auf seinen Internetseiten sowie im Epidemiologischen Bulletin. Immundefiziente Patienten sollten über eine möglicherweise eingeschränkte Immunantwort aufgeklärt werden. Beruhend auf einer deutlich niedrigeren Immunogenität der Impfung bei Personen mit immunsuppressiven Therapien aufgrund einer rheumatoiden Arthritis empfehlen Hertzell et al. bei dieser Personengruppe ebenfalls eine zusätzliche Impfstoffdosis [24]. In Analogie kann generell bei Personen mit Immundefizienz eine zusätzliche Impfstoffdosis erwogen werden [16].
Reiseimpfungen – Empfehlungen für Reisen in Gebiete mit erhöhtem Infektionsrisiko
Laut Fallserien und Fallberichten kann eine Immunsuppression mit Biologika mit einem erhöhten Infektionsrisiko bei Reisen einhergehen [33]. Daher gilt für internationale Reisen, dass auch Personen mit Autoimmun- oder anderen chronisch-entzündlichen Erkrankungen nach den STIKO-Empfehlungen geimpft werden sollen. Die STIKO hat zusammen mit der Deutschen Gesellschaft für Tropenmedizin, Reisemedizin und Globale Gesundheit e.V. (DTG) im April 2024 ein aktualisiertes Bulletin zu Reiseimpfempfehlungen publiziert, das auch ein Kapitel zu Patienten mit Immundefizienz enthält [16].
Bei Patienten mit CED unter Vedolizumab-Therapie wurde eine verminderte Wirksamkeit eines oralen Choleraimpfstoffs gezeigt [34]. Patienten unter Vedolizumab-Therapie sollten daher generell keine oral zu verabreichenden Impfstoffe erhalten. Eine Cholera-Impfung ist nur indiziert bei Reisen in Cholera-Epidemiegebiete mit voraussichtlich ungesichertem Zugang zu Trinkwasser, längerfristige Tätigkeit in Cholera-Epidemiegebieten sowie bei Einsätzen als Katastrophenhelfer [16].
Immundefizienz ist als absolute Gegenanzeige für eine Gelbfieberimpfung aufgeführt, da derzeit nur ein attenuierter Lebendimpfstoff verfügbar ist und damit das Risiko besteht, eine Gelbfieber-Infektion auszulösen [16]. Dementsprechend rät die Europäische Rheumaliga Patienten mit entzündlichen rheumatischen Autoimmunerkrankungen eine Impfung gegen Gelbfieber generell zu vermeiden. Bei Patienten, die in die endemischen Länder reisen, kann in Betracht gezogen werden, die immunsuppressive Therapie auszusetzen, um eine sichere Impfung zu ermöglichen. Bei zuvor exponierten Patienten kann die Serologie gemessen werden. Die Dauer des Aussetzens von Immunsuppressiva sollte an die Pharmakokinetik des jeweiligen Wirkstoffs angepasst werden [6]. Auch gegen Dengue-Fieber ist derzeit nur ein attenuierter Lebendimpfstoff verfügbar, so dass Immundefizienz eine Kontraindikation darstellt [16].
Gefährdeten Patienten mit entzündlichen rheumatischen Autoimmunerkrankungen sollten gegen Hepatitis A geimpft werden [6]. Immunsupprimierte Patienten mit TNF-Blocker Therapie haben oft eine schlechte Immunantwort auf Hepatitis-A-Impfstoffe. Studien haben gezeigt, dass eine Einzeldosis des Impfstoffs gegen Hepatitis A bei Patienten mit RA und bei Patienten unter Therapie mit Immunsuppressiva keinen ausreichenden Schutz gewährleistet [35,36]. Daher wird bei Patienten mit Immundefizienz bei der Gabe der ersten monovalenten Impfstoffdosis der Grundimmunisierung eine zusätzliche Impfstoffdosis eines monovalenten Impfstoffs vor Abreise empfohlen. Die zwei Impfstoffdosen können sowohl am gleichen Tag als auch im Abstand von einem Monat gegeben werden. In beiden Fällen ist zur Vervollständigung der Grundimmunisierung eine 3. Impfstoffdosis im Mindestabstand von 6 Monaten empfohlen. Für eine Beurteilung der Wirkungsdauer bei Immundefizienz und davon abhängig der Notwendigkeit einer Auffrischung ist die Evidenz noch nicht ausreichend [16].
In tropischen Klimazonen ist Influenza ganzjährig endemisch [37]. Trotz einer wie oben bereits beschriebenen möglicherweise verringerten Immunogenität von Influenza-Impfstoffen kann die Immunantwort immer noch ausreichen, um von Vorteil zu sein. Daher wird allen Patienten, die eine Therapie mit TNF-Inhibitoren erhalten, ein Influenza-Impfstoff empfohlen [33].
Patienten, die mit TNF-Inhibitoren behandelt werden, haben ein erhöhtes Risiko für Japanische Enzephalitis. Bei Reisen in die Endemiegebiete ist daher eine Impfung mit dem in Deutschland zugelassenen Totimpfstoff indiziert [12].
Bei entsprechender Indikation für eine Meningokokkenimpfung gegen die Serotypen A, C, W, Y wird empfohlen, eine zweite Impfstoffdosis eines Meningokokken-ACWY-Konjugat-Impfstoffs im Abstand von 4–8 Wochen zur ersten Impfstoffdosis zu verabreichen. Eine Auffrischimpfung bei erneuter Exposition sollte nach 5 Jahren durchgeführt werden. Personen mit Immundefizienz und entsprechendem Risiko sollten reiseunabhängig gemäß der STIKO-Indikationsempfehlungen gegen den Meningokokken-Serotyp B geimpft sein [16].
Die Indikation für eine Impfung gegen Typhus sollte bei Patienten mit CED großzügig gestellt werden, auch wenn keine immunsuppressive Therapie durchgeführt wird. Da der Lebendimpfstoff kontraindiziert ist, muss die Impfung mit dem parenteralen Totimpfstoff durchgeführt werden [16,12].
Fazit
Bei immunsupprimierten Patienten ist ein vollständiger Impfschutz besonders wichtig. Um einen optimalen Impferfolg zu erzielen, sollten alle Impfungen idealerweise vor Beginn einer immunsuppressiven Therapie abgeschlossen sein. Die Verabreichung von Lebendimpfstoffen ist während der Therapie mit Immunsuppressiva in den meisten Fällen kontraindiziert. Totimpfstoffe können auch ohne ein erhöhtes Risiko für unerwünschte Wirkungen während einer immunsuppressiven Therapie verabreicht werden. Da die Stärke der Immunantwort je nach Therapie und Grunderkrankung unterschiedlich ausfallen kann, kann in Einzelfällen eine Messung der Impfantwort sinnvoll sein.
Hinweis
Die hier präsentierten Daten und Empfehlungen entsprechen dem Kenntnisstand vom 1.12.2024. Aus Gründen der besseren Lesbarkeit wird auf die gleichzeitige Verwendung der Sprachformen männlich, weiblich und divers (m/w/d) verzichtet. Entsprechende Begriffe gelten im Sinne der Gleichbehandlung grundsätzlich für alle Geschlechter. Die verkürzte Sprachform beinhaltet keine Wertung.
Literatur
- Doran MF, Crowson CS, Pond GR, O‘Fallon WM, Gabriel SE (2002) Frequency of infection in patients with rheumatoid arthritis compared with controls: a population-based study. Arthritis Rheum 46 (9):2287-2293. doi:10.1002/art.10524
- Oikonen M, Laaksonen M, Aalto V et al. (2011) Temporal relationship between environmental influenza A and Epstein-Barr viral infections and high multiple sclerosis relapse occurrence. Mult Scler 17 (6):672-680. doi:10.1177/1352458510394397
- Fernandez-Martinez S, Cortes X, Borrás-Blasco J, Gracia-Pérez A, Casterá ME (2016) Effectiveness of a systematic vaccination program in patients with autoimmune inflammatory disease treated with anti-TNF alpha drugs. Expert Opin Biol Ther 16 (11):1317-1322. doi:10.1080/14712598.2016.1218844
- Akmatov MK, et al. Versorgungsatlas-Bericht Nr. 20/03. Berlin 2020.
- Hmamouchi I, Winthrop K, Launay O, Dougados M (2015) Low rate of influenza and pneumococcal vaccine coverage in rheumatoid arthritis: data from the international COMORA cohort. Vaccine 33 (12):1446-1452. doi:10.1016/j.vaccine.2015.01.065
- Furer V, Rondaan C, Heijstek MW et al. (2020) 2019 update of EULAR recommendations for vaccination in adult patients with autoimmune inflammatory rheumatic diseases. Ann Rheum Dis 79 (1):39-52. doi:10.1136/annrheumdis-2019-215882
- Girolomoni G, Strohal R, Puig L et al. (2017) The role of IL-23 and the IL-23/T(H) 17 immune axis in the pathogenesis and treatment of psoriasis. J Eur Acad Dermatol Venereol 31 (10):1616-1626. doi:10.1111/jdv.14433
- Ständige Impfkommission (2024) Impfkalender. https://www.rki.de/DE/Content/Kommissionen/STIKO/Empfehlungen/Aktuelles/Ipfkalender.pdf?__blob=publicationFile. Abgerufen am: 6.12.2024
- Niehues T, Bogdan C, Hecht J et al. (2017) Impfen bei Immundefizienz : Anwendungshinweise zu den von der Ständigen Impfkommission empfohlenen Impfungen(I) Grundlagenpapier. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 60 (6):674-684. doi:10.1007/s00103-017-2555-4
- BioNTech Manufacturing GmbH. https://biontech.de/de/covid-19-portal/mRNA-impfstoffe. Abgerufen am: 19.4.2022
- Ständige Impfkommission (2024) STIKO: Aktualisierung der COVID-19-Impfempfehlung. Epid Bull 2:1-19
- Wagner N, Assmus F, Arendt G et al. (2019) Impfen bei Immundefizienz. Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz 62 (4):494-515. doi:10.1007/s00103-019-02905-1
- Kobie JJ, Zheng B, Bryk P et al. (2011) Decreased influenza-specific B cell responses in rheumatoid arthritis patients treated with anti-tumor necrosis factor. Arthritis Res Ther 13 (6):R209. doi:10.1186/ar3542
- Ständige Impfkommission (2024) STIKO: Stellungnahme zur PCV20-Anwendung; Beschluss zum Wechsel von quadri- zu trivalenten Influenzaimpfstoffen. Epid Bull 31
- Ständige Impfkommission (2024) STIKO: Anpassung der Empfehlung zur saisonalen Influenza-Impfung für Personen ≥60 Jahre. Epid Bull 44:1-26
- Ständige Impfkommission (2024) Empfehlungen der Ständigen Impfkommission (STIKO) und der Deutschen Gesellschaft für Tropenmedizin, Reisemedizin und Globale Gesundheit e. V. (DTG) zu Reiseimpfungen. Epid Bull 14
- Park JK, Lee MA, Lee EY et al. (2017) Effect of methotrexate discontinuation on efficacy of seasonal influenza vaccination in patients with rheumatoid arthritis: a randomised clinical trial. Ann Rheum Dis 76 (9):1559-1565. doi:10.1136/
annrheumdis-2017-211128 - Stallmach A, Sturm A, Blumenstein I et al. (2020) [Addendum to S3-Guidelines Crohn‘s disease and ulcerative colitis: Management of Patients with Inflammatory Bowel Disease in the COVID-19 Pandemic – open questions and answers].
Z Gastroenterol 58 (7):672-692. doi:10.1055/a-1193-5475 - Ständige Impfkommission (2023) STIKO: Aktualisierung der Empfehlungen zur Pneumokokken-Impfung. Epid Bull 39:3-4
- Ständige Impfkommission (2024) Empfehlungen der Ständigen Impfkommission beim Robert Koch-Institut 2024. Epid Bull 4:1-72
- Ständige Impfkommission (2024) STIKO: 1-malige RSV-Impfung für alle ≥ 75-Jährigen sowie Indikationsimpfung für 60- bis 74 -Jährige mit Risikofaktoren. Epid Bull 32:1-28
- Okay G, Biberci Keskin E, Akkoyunlu Y et al. (2021) Evaluation of hepatitis B vaccine efficacy and factors affecting vaccine nonresponse in patients receiving anti-tumor necrosis factor agents. Eur J Gastroenterol Hepatol 33 (8):1091-1096. doi:10.1097/meg.0000000000001849
- Varizellen-Impfstoff (Subunit) Fachinformation (Oktober 2023). https://www.fachinfo.de/suche/fi/021976. Abgerufen am: 20.08.2024
- Hertzell KB, Pauksens K, Rombo L et al. (2016) Tick-borne encephalitis (TBE) vaccine to medically immunosuppressed patients with rheumatoid arthritis: A prospective, open-label, multi-centre study. Vaccine 34 (5):650-655. doi:10.1016/j.vaccine.2015.12.029
- Kaine JL, Kivitz AJ, Birbara C, Luo AY (2007) Immune responses following administration of influenza and pneumococcal vaccines to patients with rheumatoid arthritis receiving adalimumab. J Rheumatol 34 (2):272-279
- Kivitz AJ, Schechtman J, Texter M et al. (2014) Vaccine responses in patients with rheumatoid arthritis treated with certolizumab pegol: results from a single-blind randomized phase IV trial. J Rheumatol 41 (4):648-657. doi:10.3899/
jrheum.130945 - deBruyn J, Fonseca K, Ghosh S et al. (2016) Immunogenicity of Influenza Vaccine for Patients with Inflammatory Bowel Disease on Maintenance Infliximab Therapy: A Randomized Trial. Inflamm Bowel Dis 22 (3):638-647. doi:10.1097/ mib.0000000000000615
- Hagihara Y, Ohfuji S, Watanabe K et al. (2014) Infliximab and/or immunomodulators inhibit immune responses to trivalent influenza vaccination in adults with inflammatory bowel disease. J Crohns Colitis 8 (3):223-233. doi:10.1016/j.crohns.2013.08.008
- Dell‘Era L, Corona F, Daleno C et al. (2012) Immunogenicity, safety and tolerability of MF59-adjuvanted seasonal influenza vaccine in children with juvenile idiopathic arthritis. Vaccine 30 (5):936-940. doi:10.1016/j.vaccine.2011.11.083
- Morel J, Czitrom SG, Mallick A, Sellam J, Sibilia J (2016) Vaccinations in adults with chronic inflammatory joint disease: Immunization schedule and recommendations for patients taking synthetic or biological disease-modifying antirheumatic drugs. Joint Bone Spine 83 (2):135-141. doi:10.1016/j.jbspin.2015.08.008
- Salinas GF, De Rycke L, Barendregt B et al. (2013) Anti-TNF treatment blocks the induction of T cell-dependent humoral responses. Ann Rheum Dis 72 (6):1037-1043. doi:10.1136/annrheumdis-2011-201270
- Pratt PK, Jr., David N, Weber HC et al. (2018) Antibody Response to Hepatitis B Virus Vaccine is Impaired in Patients With Inflammatory Bowel Disease on Infliximab Therapy. Inflamm Bowel Dis 24 (2):380-386. doi:10.1093/ibd/izx001
- Hall V, Johnson D, Torresi J (2018) Travel and biologic therapy: travel-related infection risk, vaccine response and recommendations. J Travel Med 25 (1). doi:10.1093/jtm/tay018
- Wyant T, Leach T, Sankoh S et al. (2015) Vedolizumab affects antibody responses to immunisation selectively in the gastrointestinal tract: randomised controlled trial results. Gut 64 (1):77-83. doi:10.1136/gutjnl-2014-307127
- Askling HH, Rombo L, van Vollenhoven R et al. (2014) Hepatitis A vaccine for immunosuppressed patients with rheumatoid arthritis: a prospective, open-label, multi-centre study. Travel Med Infect Dis 12 (2):134-142. doi:10.1016/j.tmaid.2014.01.005
- van den Bijllaardt W, Siers HM, Timmerman-Kok C et al. (2013) Seroprotection after hepatitis a vaccination in patients with drug-induced immunosuppression. J Travel Med 20 (5):278-282. doi:10.1111/jtm.12050
- Goeijenbier M, van Genderen P, Ward BJ et al. (2017) Travellers and influenza: risks and prevention. J Travel Med 24 (1). doi:10.1093/jtm/taw078
Bildquellen
Titel: © shintartanya – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.