Durch Behandlung der COPD das kardiopulmonale Risiko senken
Interessengebiete: Allgemeinmedizin und Innere Medizin, Kardiologie, Pneumologie
Die chronisch obstruktive Lungenerkrankung (COPD) ist weltweit eine der häufigsten Todesursachen. Kardiovaskuläre Erkrankungen tragen maßgeblich zur hohen Mortalität bei COPD-Patienten bei. Das kardiopulmonale Risiko findet im Praxisalltag oft zu wenig Beachtung, obwohl eine frühzeitige Erkennung und Therapie essenziell sind, um die Sterblichkeit zu senken und eine leitliniengerechte Versorgung sicherzustellen.
Diese Fortbildung beleuchtet die komplexe Verbindung zwischen COPD und kardiovaskulären Erkrankungen. Es werden die Pathophysiologie, die erhöhten Risiken für kardiovaskuläre Ereignisse und die Bedeutung von Exazerbationen als deren Treiber thematisiert. Zudem werden umfassende Diagnostikstrategien, interdisziplinäres Management und aktuelle Therapieempfehlungen zur Reduktion des kardiopulmonalen Risikos vorgestellt, einschließlich der Bedeutung inhalativer Triple-Therapien.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Hohe Gesamtmortalität bei COPD
- Risiko für CV-Ereignisse bei COPD-Patient:innen erhöht
- Exazerbationen – Treiber für CV-Ereignisse
- Das kardiopulmonale Risiko
- Lunge und Herz als Einheit
- Patient:innen mit COPD regelmäßig auf CV- Risikofaktoren und -Erkrankungen screenen
- CV-Diagnostik bei COPD
- Patient:innen mit hohem therapeutischem Bedarf identifizieren
- GOLD-Empfehlung 2025: Exazerbationen durch adäquate Therapieeskalation vermeiden
- Anforderungen an COPD-Leitlinien
- DMP COPD
- COPD-Patient:innen erhalten häufig keine leitliniengerechte Therapie
- Inhalative Triple-Therapie kann die Gesamtmortalität bei COPD senken
- Phänotypisierung von Patient:innen notwendig
- Fazit
- Fußnoten
- Literatur
Einleitung
Das Gesamtmortalitätsrisiko bei der chronisch obstruktiven Lungenerkrankung (COPD) ist im Vergleich zu Patient:innen ohne COPD deutlich erhöht [1]. Kardiovaskuläre (CV) Erkrankungen tragen dabei zur hohen Mortalität bei COPD-Patient:innen bei [2]. Die Pathophysiologie, die hinter der Verbindung zwischen COPD und kardiovaskulären Erkrankungen steht, ist komplex und multifaktoriell. Ein höheres Lebensalter, Entzündungsprozesse, Hypoxie, Hyperinflation und eine reduzierte körperliche Aktivität sind nur einige der Faktoren, die zur Entwicklung von Herz-Kreislauf-Erkrankungen bei diesen Patient:innen beitragen können [3]. Ein wesentlicher Treiber dieser Ereignisse sind COPD-Exazerbationen [2].
Das kardiopulmonale Risiko stellt nach wie vor eine große Herausforderung in der COPD-Therapie dar, u. a. weil dieses Thema im Praxisalltag noch zu wenig Beachtung findet. In der klinischen Praxis liegt der Fokus oftmals auf der Behandlung der pulmonalen Symptome. Kardiovaskuläre Risiken werden hingegen nicht ausreichend betrachtet, weshalb COPD-Patient:innen häufig nicht leitliniengerecht therapiert werden [1]. Die kardiovaskuläre Gesundheit bei COPD-Patient:innen sollte deshalb in den Schwerpunkt der klinischen Praxis gerückt werden. Ein ganzheitliches Management dieser Patient:innen, das sowohl die pulmonalen Symptome als auch die kardiovaskulären Risiken berücksichtigt, sollte hierfür angestrebt werden [4].
Expert:innen aus Pneumologie, Kardiologie und Allgemeinmedizin diskutierten im Rahmen eines Workshops dazu, wie das kardiopulmonale Risiko adressiert und minimiert werden kann. Prof. Dr. Kathrin Kahnert, niedergelassene Pneumologin aus Germering, stellt die wichtigsten Erkenntnisse aus dem Workshop in dieser CME vor.
Hohe Gesamtmortalität bei COPD
Die Mortalität bei Patient:innen mit COPD ist weiterhin hoch: Etwa 100 Betroffene sterben in Deutschland täglich an dieser Erkrankung [5]. Im Jahr 2021 war COPD weltweit nach der ischämischen Herzkrankheit, COVID-19 und Schlaganfall die vierthäufigste Todesursache [6]. CV-Erkrankungen tragen maßgeblich zur hohen Mortalität der COPD bei [7]. So sterben die meisten Menschen mit COPD nicht an respiratorischen Komplikationen, sondern an Krebs oder Herz-Kreislauf-Erkrankungen [8]: Bis zu 4 von 10 Betroffene sterben dabei an CV-Ereignissen [7]. Insbesondere Patient:innen mit leichter bis mittelschwerer COPD sterben häufiger an atherosklerotischen Erkrankungen als an respiratorischer Insuffizienz [9].
Risiko für CV-Ereignisse bei COPD-Patient:innen erhöht
Untersuchungen konnten zeigen, dass Menschen mit COPD ein höheres Risiko für CV-Komorbiditäten haben als Menschen ohne COPD [10-14]. Bei Menschen mit COPD ist das Risiko für ein CV-Ereignis, wie z. B. einen akuten Myokardinfarkt, eine koronare Herzerkrankung (KHK) oder eine Angina pectoris [12], signifikant höher (Tab. 1, Abb. 1) [10,12,14]. Im Vergleich zu Menschen ohne COPD ist das Risiko für CV-Erkrankungen und -Ereignissen bei COPD-Patient:innen etwa 2- bis 3-fach erhöht [12, 13]. Zu der erhöhten CV-Sterblichkeit bei COPD-Patient:innen trägt die Unterdiagnose von CV-Erkrankungen bei.
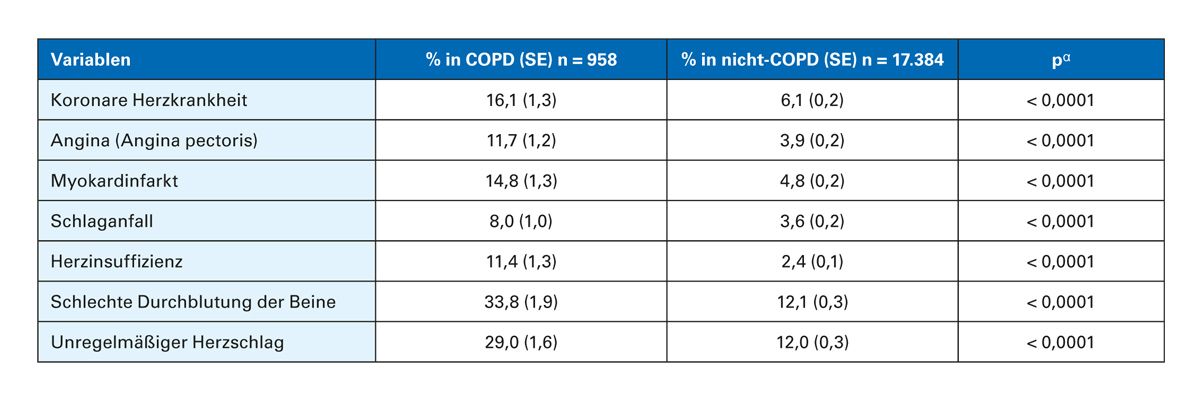
Tab. 1: Kardiovaskuläre Komorbiditäten bei Menschen mit und ohne COPD (mod. nach Finkelstein et al. [12])
α Wald-Chi-Quadrat-Test; SE: Standardfehler
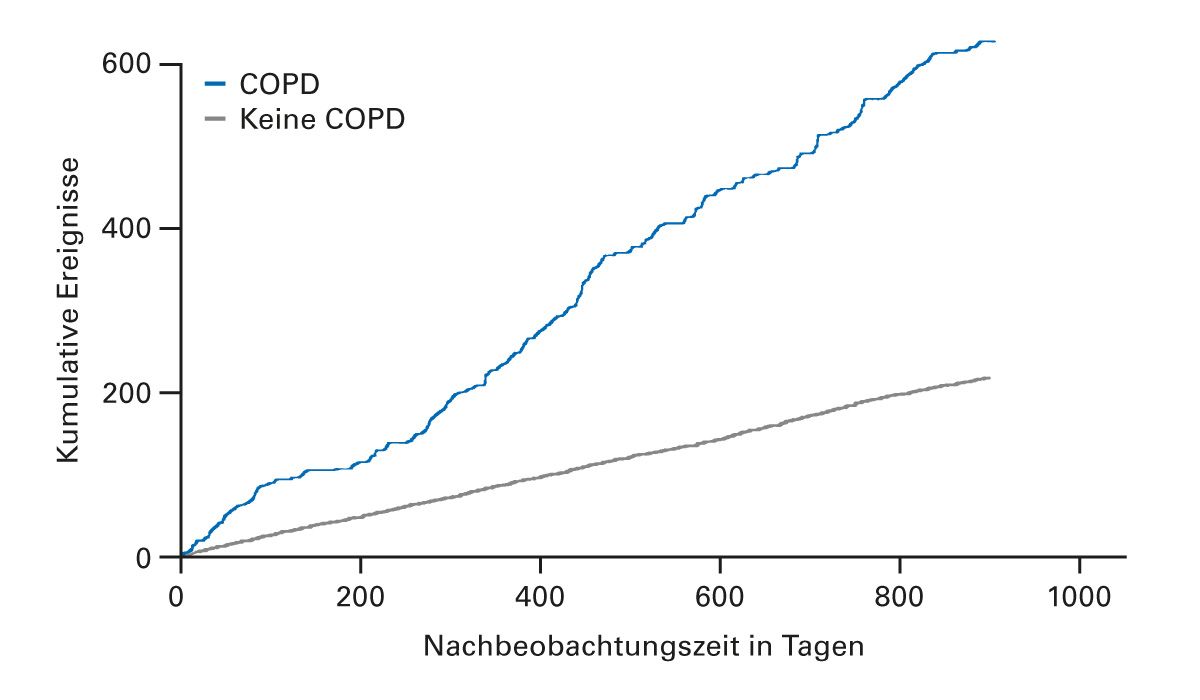
Abb. 1: Die Inzidenz an Myokardinfarkten ist bei COPD-Patient:innen höher als bei Menschen ohne
COPD (mod. nach Feary et al. [14])
36,6 % der Patient:innen mit auffälliger Echokardiographie hatten keine kardiale Diagnose oder eine entsprechende Medikation [4]. Eine mögliche Erklärung ist, dass das Symptom Dyspnoe bei Patient:innen mit einer diagnostizierten COPD primär der COPD zugeschrieben wird und dadurch andere Komorbiditäten übersehen werden. Auch das erhöhte CV-Risiko bei COPD-Patient:innen in der klinischen Praxis, insbesondere in der Kardiologie, wird bisher unzureichend berücksichtigt. In der Leitlinie der European Society of Cardiology (ESC) zur Prävention von kardiovaskulären Erkrankungen wird COPD zwar als zu behandelnde Komorbidität genannt, jedoch nicht explizit als Risikofaktor, wie es beispielsweise bei Diabetes der Fall ist [17]. Die Dunkelziffer an kardialen Erkrankungen bei Patient:innen mit COPD ist dementsprechend hoch, was zu der erhöhten CV-Sterblichkeit bei COPD-Patient:innen beitragen kann [4, 18].
Exazerbationen – Treiber für CV-Ereignisse
Die EXACOS-CV Studie wertete Krankenkassendaten aus Deutschland aus und belegte, dass in den ersten 30 Tagen nach einer mittelschweren Exazerbation das Risiko für ein kardiovaskuläres Ereignis oder Tod bis zu 3-fach erhöht war. Nach einer schweren Exazerbation stieg das Risiko um das 5- bis mehr als 10-fache an. Das gesteigerte kardiovaskuläre Risiko nach einer schweren Exazerbation hielt bis zu zwölf Monate an [2]. Auch eine Metaanalyse von Müllerová et al. sowie eine populationsbasierte Studie von Graul et al. zeigten eine Assoziation von Exazerbationen und CV-Ereignissen [19, 20]. Nach mittelschweren COPD-Exazerbationen war das Risiko für CV-Ereignisse etwas geringer als nach schweren Exazerbationen [19, 20]. Bei der Behandlung der COPD sollte laut Prof. Dr. Kahnert deshalb ein Umdenken stattfinden: Exazerbationen sollten dabei die gleiche Bedeutung erlangen wie CV-Ereignisse in der Kardiologie. Weiterhin sollte COPD anstatt einer Lungenerkrankung mit Begleiterkrankungen, als Teil eines multimorbiden Zustandes betrachtet werden, um Prävention, Diagnose und Behandlung voranzutreiben [8]. Dazu ist eine umfassende Diagnostik und Beurteilung von (kardiovaskulären) Komorbiditäten bei Patient:innen mit COPD essenziell.
Das kardiopulmonale Risiko
Singh et al. definierten das kardiopulmonale Risiko kürzlich wie folgt: Auftreten schwerer respiratorischer und/oder kardiovaskulärer Ereignisse bei Menschen mit COPD. Dazu gehören u. a. COPD-Exazerbationen, Myokardinfarkt, Schlaganfall, Dekompensation einer Herzinsuffizienz, Herzrhythmusstörungen und Tod aufgrund eines dieser Ereignisse. Dem Review zufolge triggern akute Exazerbationen das Fortschreiten der COPD, verringern die Lungenfunktion und erhöhen das Risiko für weitere Exazerbationen und CV- Erkrankungen bzw. -Ereignisse [21]. Singh et al. wiesen zudem auf den hohen Anteil der COPD-Patient:innen mit CV-Erkrankungen hin und betonten, dass COPD ein Risikofaktor für ein schlechtes Outcome bei CV-Erkrankungen ist (Abb. 2) [21]. Das bedeutet konkret, dass CV-Patient:innen mit gleichzeitiger COPD durch eine adäquate COPD-Therapie (=Exazerbationsprophylaxe) ihr COPD-bedingtes erhöhtes CV-Risiko senken können. Die Expert:innen-Runde des Workshops betonte einstimmig, dass das kardiopulmonale Risiko bisher nicht ausreichend erkannt und nicht optimal adressiert wird.
Sowohl CV-Erkrankungen bei Menschen mit COPD als auch eine COPD bei Menschen mit einer CV-Erkrankung werden oft nur unzureichend diagnostiziert. Für die Reduktion des kardiopulmonalen Risikos und der Mortalität sind die frühzeitige Erkennung von Exazerbationen sowie ein sofortiges Eingreifen mit geeigneten Therapien wichtig zur Verhinderung einer Abwärtsspirale der Erkrankung (Tab. 2) [22]. Darüber hinaus sollte die Primärprävention mit Impfungen berücksichtigt werden [23]. Aktuelle Daten zeigen deutlich, dass Impfungen dazu beitragen können, kardiale Ereignisse zu verhindern [24].
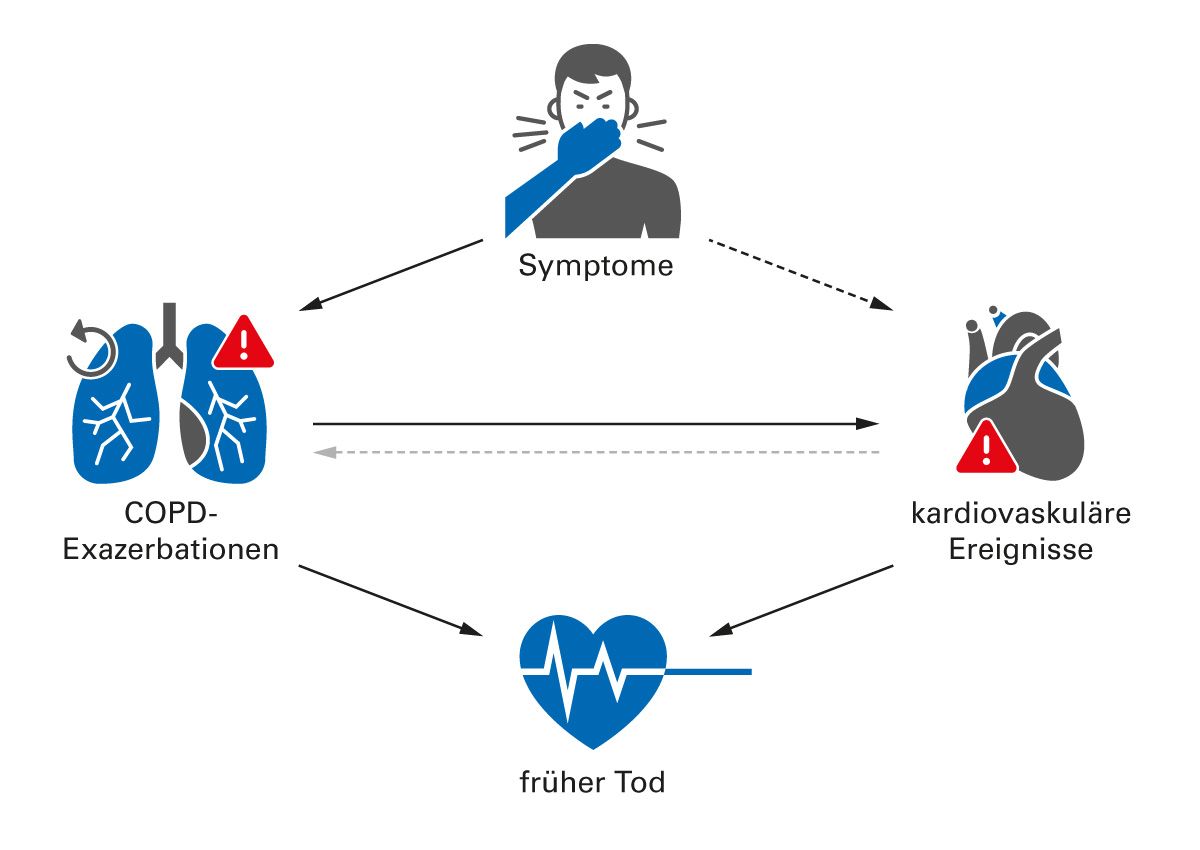
Abb. 2: Schwere respiratorische und/oder kardiovaskuläre Ereignisse tragen zum Tod von Menschen mit einer COPD bei. Symptome, Exazerbationen und CV-Ereignisse sind dabei unterschiedlich eng assoziiert (mod. nach Singh et al. [21]).
Durchgehende Pfeile schwarz: starker Zusammenhang, gestrichelte Pfeile schwarz: zunehmende Evidenz für Zusammenhang, hellgrauer gestrichelter Pfeil: vermuteter Zusammenhang
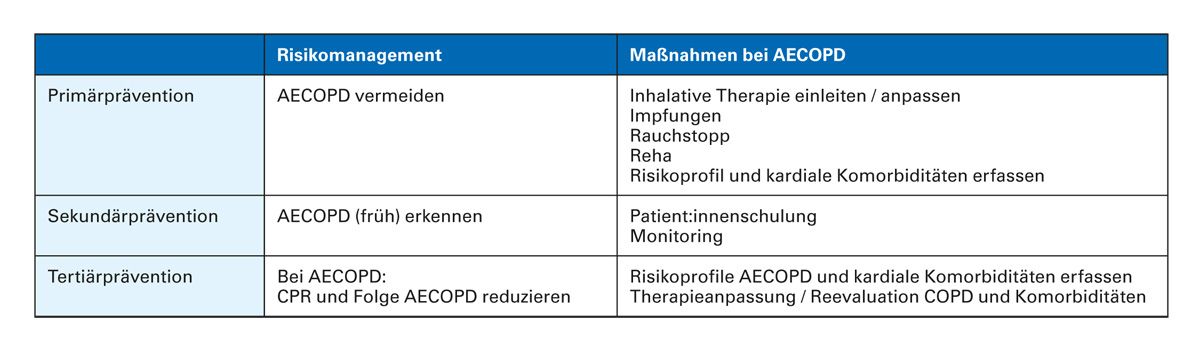
Tab. 2: Kardiopulmonale Risikoreduktion durch Prävention von Exazerbationen (mod. nach Gellmann (Ed.) [25] und GOLD Report 2025 [23])
AECOPD: akute Exazerbation der COPD; CPR: kardiopulmonales Risiko
Lunge und Herz als Einheit
Mögliche Erklärungen für diesen Zusammenhang zwischen Herz und Lunge sind insbesondere Inflammation [26,27], Hyperinflation [28-30] und Hypoxämie [31]. Exazerbationen können ein Katalysator für diese Mechanismen [31-33] und Vorläufer pulmonaler und kardialer Ereignisse sein [26,33].
Eine COPD-bedingte Entzündung der Lunge kann eine systemische Inflammation auslösen und zu atherosklerotischen Gefäßschäden führen [26, 27]. Die Hypoxämie kann eine pulmonale Hypertonie und Rechtsherzversagen zur Folge haben [31, 32]. Zudem kann die Hyperinflation mittels Kompression eine verminderte Herzleistung verursachen [28, 29]. Bereits 2010 demonstrierten Watz et al., dass ein zunehmender Schweregrad der COPD mit einer Abnahme der Herzgröße und einer reduzierten Füllung des linken Ventrikels einhergeht [34]. Aktuelle Daten von Abdo et al. bestätigen die erhöhte Rate an kleinen linken Ventrikeln bei COPD-Patient:innen, die mit einer geringeren Überlebenswahrscheinlichkeit einhergehen [35].
Patient:innen mit COPD regelmäßig auf CV-Risikofaktoren und -Erkrankungen screenen
Menschen mit COPD haben ein vergleichbar hohes Risiko für atherosklerotische CV- Ereignisse wie Menschen mit Diabetes [36]. Die Guidelines der ESC empfehlen daher, COPD-Patient:innen regelmäßig auf atherosklerotische Risikofaktoren und CV-Erkrankungen zu screenen [17]. Bei Diabetes gelten je nach CV-Risikokategorie in den Leitlinien bspw. angepasste Low Density Lipoprotein (LDL)-Zielwerte [37], eine vergleichbare Vorgabe zur Risikoreduktion gibt es jedoch für COPD nicht. Prof. Dr. Jochen Müller-Ehmsen, niedergelassener Kardiologe aus Bremen, schlug im Rahmen des Expert:innen-Workshops einen „Risiko-Rechner“ für COPD- Patient:innen vor, z. B. in Anlehnung an den American Heart Association Risk Calculator [38]. Dieser könnte helfen, die COPD-Patient:innen zu identifizieren, die auch in der Kardiologie vorgestellt werden sollten. Insbesondere die Liegezeit in Kliniken könnte dafür genutzt werden, um stationäre Patient:innen mit einer COPD-Exazerbation auf CV-Komorbiditäten zu untersuchen. So könnten diese adäquat therapiert und möglicherweise eine Wiedereinweisung verhindert werden.
Prof. Dr. Franziska Christina Trudzinski von der Thoraxklinik in Heidelberg erläuterte im Rahmen des Workshops: „Kardiolog:innen sollten häufiger eine Spirometrie durchführen. Spätestens bei einer Hospitalisierung infolge einer Exazerbation sollte eine kardiologische Abklärung obligat sein. Dem erhöhten CV-Risiko nach einer Exazerbation sollte z. B. durch ein intensiveres Monitoring – analog zum Vorgehen nach Myokardinfarkt – begegnet werden.“
CV-Diagnostik bei COPD
Zur Aufdeckung kardialer Komorbiditäten können beispielsweise EKG-Untersuchungen und CV-Belastungstests verwendet werden [39]. Im Rahmen des Workshops betonte Prof. Dr. Müller-Ehmsen jedoch: „Bei der CV-Diagnostik von COPD-Patient:innen muss berücksichtigt werden, dass die Lungenerkrankung einen Einfluss auf kardiovaskuläre Tests hat, so dass z. B. Adenosin zur Ischämiediagnostik nicht eingesetzt werden kann, eine Stress-Echokardiographie durch eingeschränkte Schallbarkeit bei Überblähung schwierig und die Ausbelastung, auch bei der Myokardszintigraphie, durch eine COPD- bedingte Dyspnoe eingeschränkt sein kann.“ Eine Auswertung der Kohortenstudie COSYCONET legt zudem nahe, dass das High-sensitivity Troponin I bei Patient:innen mit stabiler COPD ein starker Prädiktor für die Gesamtmortalität ist. Dieser ist nicht von einer breiten Palette an CV-Risikofaktoren und vorherrschenden Erkrankungen abhängig [40]. Zudem konnte eine weitere Subgruppenanalyse der Studie zeigen, dass eine anhand von CT-Scans festgestellte Verkalkung von Herzkranzgefäßen ein Risikovorhersagefaktor für Herzerkrankungen ist [41].
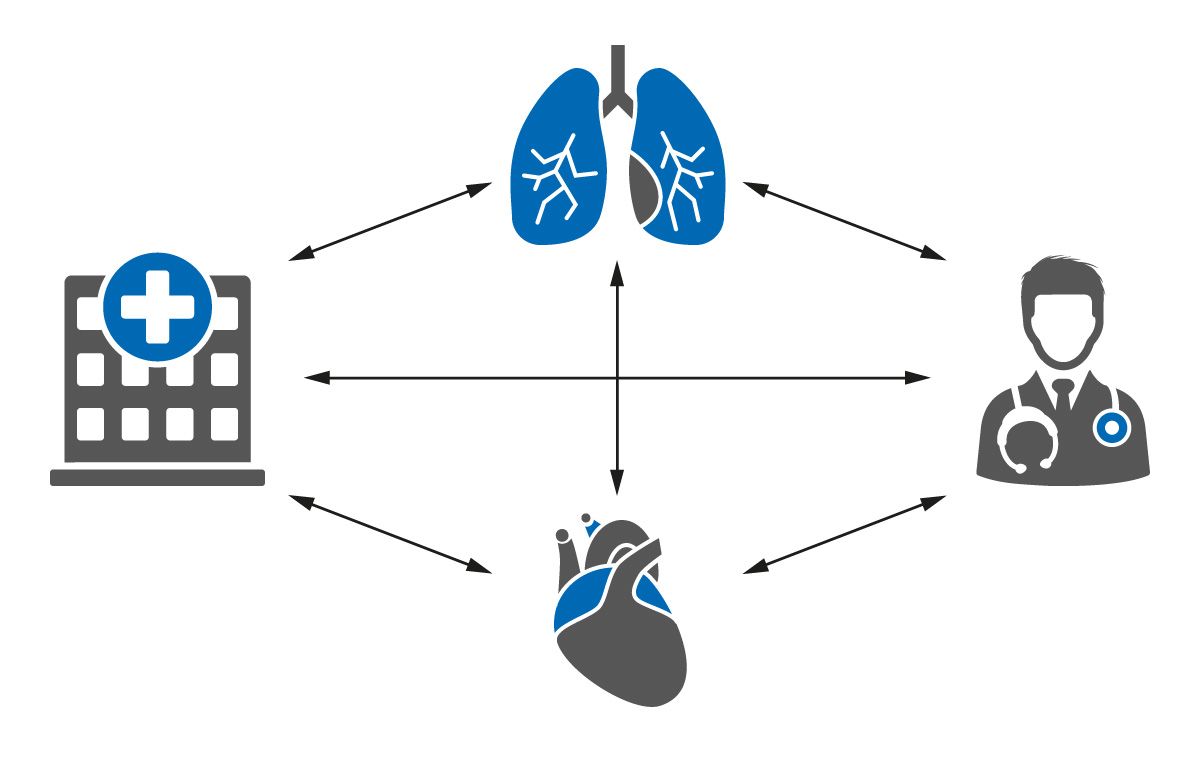
Abb. 3: Für die optimale Versorgung von COPD-Patient:innen ist eine enge interdisziplinäre und intersektorale Vernetzung wichtig (mod. nach K. Kahnert).
Auch im Hausarztbereich können gezielte Strategien dazu beitragen, CV-Erkrankungen bei Menschen mit COPD und/oder Typ-2-Diabetes frühzeitig zu identifizieren. In einer aktuellen Studie konnte gezeigt werden, wie durch relativ einfache Maßnahmen die Anzahl neu diagnostizierter Fälle von Herzinsuffizienz, Vorhofflimmern und KHK im hausärztlichen Bereich im Vergleich verdoppelt werden konnte [42]. Dazu kann im ersten Schritt ein Fragebogen zur Anwendung kommen. Anschließend sollte eine körperliche Untersuchung, ein EKG sowie die Bestimmung des Herzinsuffizienzmarkers N-terminales Prohormon des natriuretischen Gehirnpeptids (NT-proBNP) erfolgen. Bei Auffälligkeiten sollten diese Patient:innen zu einer:m Kardiolog:in überwiesen werden [42]. Prof. Dr. Kahnert rief zudem dazu auf, bei Patient:innen mit hohem CV-Risiko frühzeitig eine kardiologische Anbindung anzustreben. Bei der interdisziplinären Versorgung von COPD-Patient:innen sollte stets sichergestellt werden, dass alle Beteiligten über alle verfügbaren Informationen verfügen, um optimale Therapieentscheidungen treffen zu können (Abb. 3).
Patient:innen mit hohem therapeutischem Bedarf identifizieren
Laut Prof. Dr. Kahnert eignen sich eine Reihe weiterer diagnostischer Tools, um Patient:innen mit einem hohen therapeutischen Bedarf zu identifizieren. Dazu gehören Patient:innen mit pulmonalen Komorbiditäten wie beispielsweise Bronchiektasen. In Zukunft können aber auch Imaging Biomarker, wie z. B. Pi10 [43], oder Mucus Plugs [44] hilfreich sein, Risikopatient:innen zu erkennen. Aktuelle Daten geben immer mehr Hinweise darauf, dass in Zukunft auch der Stellenwert der Bestimmung des fraktionierten exhalierten Stickstoffmonoxids (FeNO) bei COPD-Patient:innen steigen wird [45, 46]. Zur Identifikation einer bakteriellen Besiedelung kann eine Sputumanalyse genutzt werden.
GOLD-Empfehlung 2025: Exazerbationen durch adäquate Therapieeskalation vermeiden
Die GOLD-Empfehlung definiert die Therapieziele bei der Behandlung der COPD. Zum einen sollen mit der Therapie kurzfristige Ziele wie Symptomlinderung, eine verbesserte Belastbarkeit und ein verbesserter Gesundheitszustand erreicht werden. Zu den langfristigen Therapiezielen gehören die Vorbeugung der Krankheitsprogression, die Vermeidung von zukünftigen Exazerbationen und die Reduktion der Mortalität [23].
Laut der aktuellen GOLD-Empfehlung sollen zur Erstbehandlung der COPD lang wirksame Beta-2-Rezeptoragonisten (LABA) und/oder lang wirksame Muskarin-Rezeptorantagonisten (LAMA) eingesetzt werden (Abb. 4). Ab einem Wert von über 300 Eosinophilen/&mikro;l im Blut kann laut GOLD-Report bei therapienaiven COPD-Patient:innen der Gruppe E eine Triple-Therapie (inhalatives Corticosteroid (ICS)/LAMA/LABA) in Betracht gezogen werden, was jedoch außerhalb der Zulassung liegt.
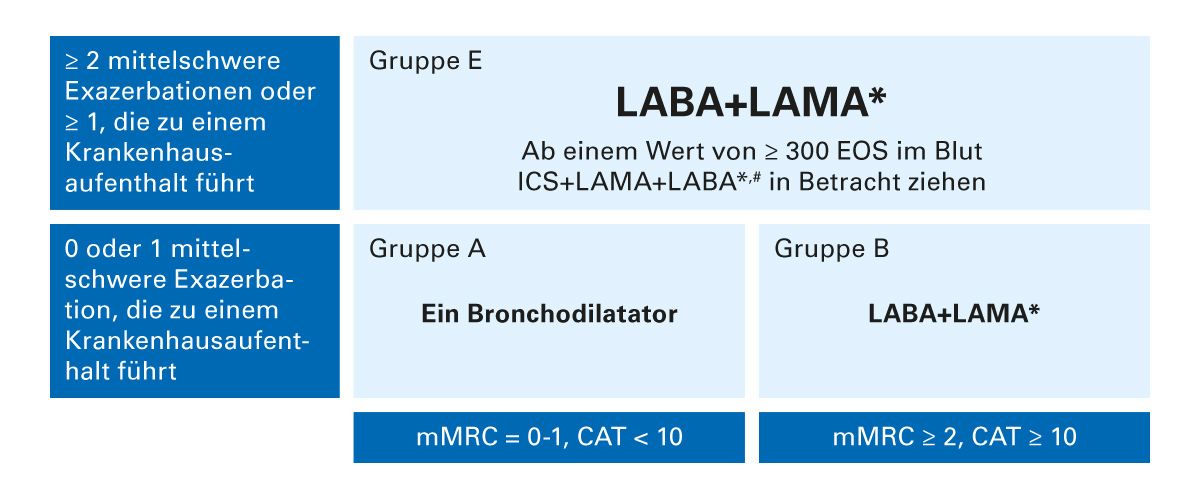
Abb. 4: Initialer Therapiealgorithmus nach GOLD 2025 (mod. nach GOLD 2025 [23]). CAT = COPD Assessment Test; EOS = Anzahl der Eosinophilen pro µl Blut; mMRC = modified British Medical Research Council. *Die Therapie mit einem Inhalator kann vorteilhafter und effektiver sein als eine Therapie mit mehreren Inhalatoren. Einzelne Inhalatoren können die Adhärenz verbessern. #Fixdosis-Triple-Therapien sind nur für Patient:innen mit einer vorbestehenden dualen inhalativen Therapie zugelassen.
Ist eine Therapieeskalation erforderlich, richtet sich der Eskalationspfad nach dem führenden Symptom (Abb. 5). Beispielsweise wird einer:m exazerbierenden COPD-Patient:in, welcher momentan auf LAMA/LABA eingestellt ist und mindestens 100 Eosinophile/&mikro;l Blut aufweist eine Eskalation zu LAMA/LABA/ICS empfohlen. Eine duale Therapie mit LABA/ICS ist insgesamt bei COPD kein Teil der aktuellen Empfehlungen [23]. Bei instabilen Patient:innen unter ICS/LABA sollte die Therapie überprüft werden [23]. Bei einer ICS-Indikation wird ebenfalls eine Triple-Therapie (ICS/LAMA/ LABA) empfohlen [23]. Dieses Vorgehen wird auch durch eine Subgruppenanalyse der KRONOS-Studie gestützt [47].
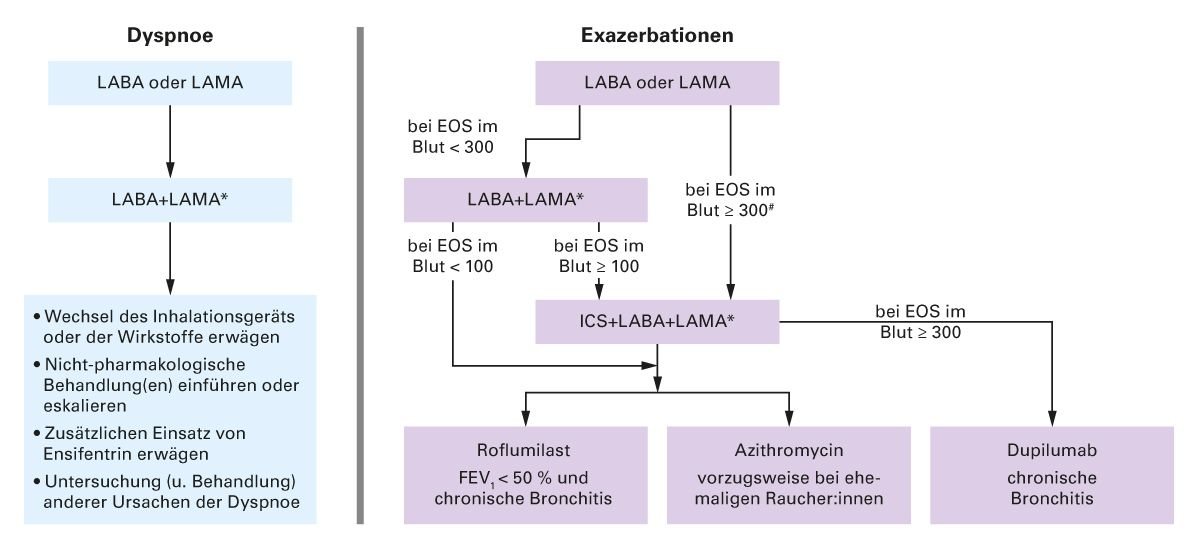
Abb. 5: Therapieeskalation der nicht-therapienaiven COPD-Patient:innen in Abhängigkeit der führenden Symptomatik nach GOLD 2025 (mod. nach GOLD 2025 [23]).
EOS = Anzahl der Eosinophile pro μl Blut; FEV1 = Einsekundenkapazität; ICS = inhalative Corticosteroide; LABA = langwirksame Beta2-Rezeptoragonisten; LAMA = langwirksame Muskarin- Rezeptorantagonisten. §Erwägung einer Deeskalation der ICS bei Lungenentzündung oder anderen erheblichen Nebenwirkungen. Bei einem EOS-Wert von ≥ 300 Zellen/µl ist eine Deeskalation der Therapie eher mit der Entwicklung von Exazerbationen verbunden. Exazerbationen bezieht sich auf die Anzahl der Exazerbationen pro Jahr. *Die Therapie mit einem Inhalator kann vorteilhafter und effektiver sein als eine Therapie mit mehreren Inhalatoren. Einzelne Inhalatoren können die Adhärenz verbessern. #Fixdosis-Triple-Therapien sind nur für Patient:innen mit einer vorbestehenden dualen inhalativen Therapie zugelassen.
Anforderungen an COPD-Leitlinien
Um das Management von COPD-Patient:innen zu verbessern, müssen aktuelle Leitlinien auch von den behandelnden Ärzt:innen konsequent in der Praxis umgesetzt werden. Eine Reihe internationaler Guidelines empfiehlt bei symptomatischen COPD-Patient:innen die kombinierte Anwendung von LAMA/LABA als First-Line-Therapie [48, 49]. Eine deutsche fachärztliche Leitlinie zur COPD befindet sich derzeit in der Erstellung. In dieser Leitlinie werden neue, seit dem Erscheinen der Nationalen VersorgungsLeitline (NVL) COPD veröffentlichte, relevante Studiendaten aufgegriffen und in die Therapieempfehlungen einbezogen. Das Kapitel der NVL zu Exazerbationen wurde bereits aktualisiert und Ende 2024 als Anlage veröffentlicht [50].
Aus Sicht von Prof. Dr. Kahnert sollten Leitlinien:
- praxisnah und klar sein
- deutliche Aufforderungen zum Handeln („Call-to-Action“) beinhalten
- interdisziplinär gedacht sein (bspw. mit kardiologischen und pneumologischen
Inhalten)
DMP COPD
Um die Umsetzung einer leitliniengerechten Versorgung chronisch kranker Menschen zu fördern und die Bindung von Patient:innen und Behandelnden zu stärken, wurden Disease-Management-Programme (DMPs) eingeführt. Diese Programme nutzen Erkenntnisse evidenzbasierter Medizin.
Das kardiopulmonale Risiko findet im DMP COPD [51] jedoch bislang kaum Beachtung. Prof. Dr. Dr. Charles Adarkwah, niedergelassener Allgemeinmediziner aus Kreuztal, merkte im Rahmen des Workshops bezüglich des DMP COPD an: „Im DMP-COPD ist zwar unter bestimmten Voraussetzungen (z. B. bei unzureichendem Therapieerfolg trotz intensivierter Behandlung) die Einbeziehung von Pneumolog:innen vorgesehen [51], trotzdem funktioniert die Achse Hausärzt:in – Pneumologie – Kardiologie nicht flächendeckend. Obwohl die Definition des kardiopulmonalen Risikos klar und eingängig ist, gibt es bisher im hausärztlichen Bereich zu wenig Awareness dafür – es fehlt ein Link zum kardialen Erkrankungsrisiko. Außerdem hängt die Zusammenarbeit stark von regionalen Strukturen und dem Engagement der einzelnen Beteiligten ab.“ Zudem werde laut Prof. Dr. Dr. Adarkwah nicht systematisch nach Symptomen im Rahmen der verpflichtenden Dokumentation gefragt – dabei sei eine gezielte Erhebung von Symptomen und Exazerbationen erforderlich. Hierbei sollte auf die Beachtung patientengeeigneter Formulierungen Wert gelegt werden. Die Nutzung von Scores wie z. B. dem COPD Assessment Test (CAT) oder dem modifizierten Medical Research Council Dyspnea Scale (mMRC) sollte als verpflichtender Teil des DMPs eingebaut werden. Weiterhin gebe es keine Verlinkung zum Stufentherapieschema mit expliziten Hinweisen zur Therapieanpassung. Dabei wäre laut Prof. Dr. Dr. Adarkwah das DMP eine gute Gelegenheit zur Optimierung der Therapie, da Patient:innen viermal pro Jahr die Praxis aufgrund des DMPs besuchen. Prof. Dr. Kahnert ergänzte: „Bei jeder Kontrolle sollte die Medikation von Patient:innen geprüft werden und immer eine Eskalation der Therapie in Betracht gezogen werden.“
Weiterhin befürwortet Prof. Dr. Dr. Adarkwah den Aufbau und die Förderung regionaler Strukturen und eine stärkere Praxisorientierung des DMP-COPD. „Zur Verbesserung der Versorgungssituation könnte außerdem die Implementierung von ‚COPD-Nurses‘ – in Anlehnung an bewährte ‚Herzinsuffizienz-Nurses‘ – beitragen, denn vieles von dem, was zu einer besseren Versorgung beitragen könnte, wäre delegierbar und Delegationsmodelle sind die Zukunft“, so Prof. Dr. Dr. Adarkwah.
COPD-Patient:innen erhalten häufig keine leitliniengerechte Therapie
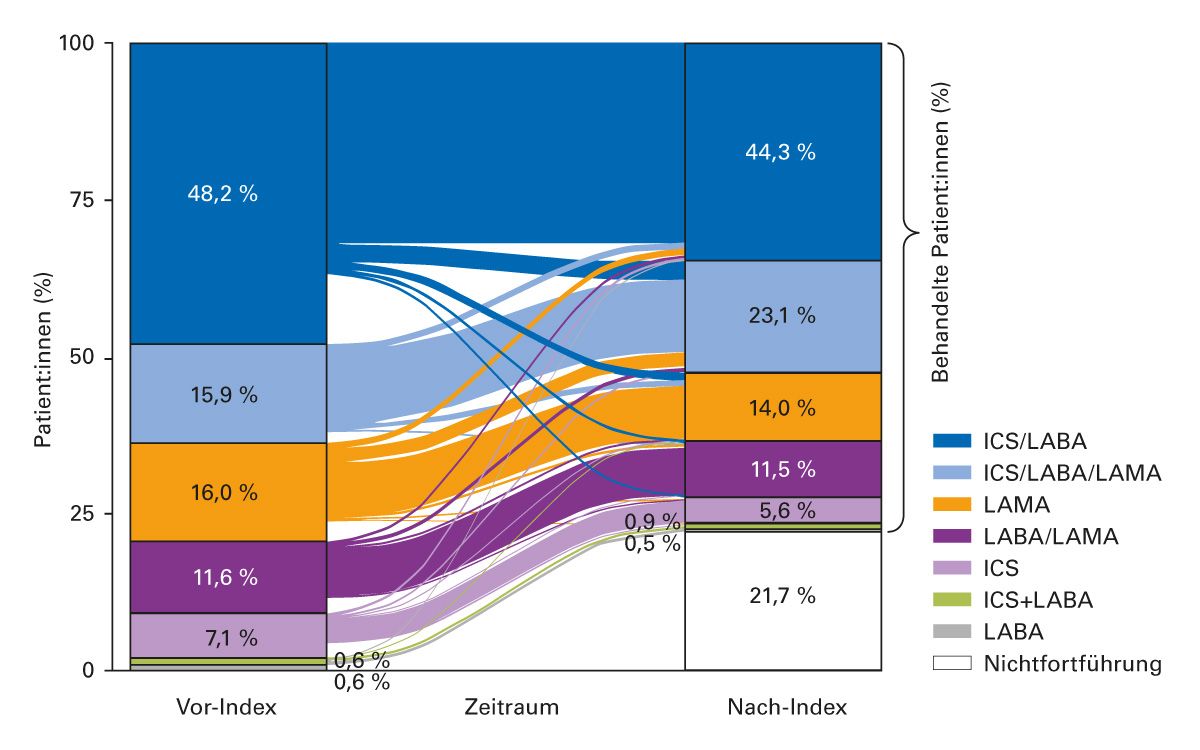
Die Studie AvoidEx unterstreicht, dass die Versorgungsrealität bei COPD in Deutschland aktuell häufig kritisch ist. 43 % aller Patient:innen erhielten in den letzten 12 Monaten vor dem Tod keine dauerhafte COPD-Medikation. Obwohl die Patient:innen einem Hochrisikokollektiv zuzurechnen waren, erfolgte der Studie zufolge kaum eine Therapieanpassung [1]. Auch aus der DACCORD-Studie lässt sich ableiten, dass nur bei wenigen Patient:innen eine Anpassung der Therapie stattfindet [52]. Internationale Studien betonen ebenfalls die unzureichende Versorgung von COPD-Patient:innen. Eine Auswertung von Krankenkassendaten aus den USA zeigte, dass der Anteil an Patient:innen mit COPD-Medikation nach einer Exazerbation sogar abnahm (Abb. 6) [53].
Inhalative Triple-Therapie kann die Gesamtmortalität bei COPD senken
Dass die jährliche Rate mittelschwerer und/oder schwerer Exazerbationen mit fixen inhalativen Triple-Therapien im Vergleich zu dualen Therapien reduziert werden kann, konnten die Studien IMPACT [54] und KRONOS*,** [55] zeigen (KRONOS mit der Triple-Therapie bestehend aus dem ICS Budesonid, dem LAMA Glycopyrronium und dem LABA Formoterol (BUD/GLY/FORM) und IMPACT mit Fluticasonfuroat/Umeclidinium/Vilanterol (FF/UMEC/VI). Darüber hinaus demonstrierten die Studien ETHOS#,## [56] und IMPACT [57] einen Rückgang der Gesamtmortalität unter der inhalativen Triple-Therapie im Vergleich zu dualen Therapien.
Eine Post-hoc-Analyse der ETHOS-Studie# konnte eine Reduktion der Gesamtmortalität um 49 % von BUD/GLY/FORM gegenüber GLY/FORM (LAMA/LABA) über 52 Wochen belegen [56]. Das Gesamtmortalitätsrisiko im BUD/GLY/FORM (160/7,2/5 μg, 2×2)-Arm war niedriger vs. GLY/FORM (LAMA/LABA) (sekundärer Endpunkt, absolute Todesrate 1,4 % vs. 2,6 %; Hazard Ratio [HR]: 0,51 [95 %-KI: 0,33–0,80]; nicht adjustierter p-Wert = 0,0035) (Abb. 7) [56]. #,## In der Studie wurden dabei nicht nur die pulmonalen Todesfälle verringert, sondern auch die kardiovaskuläre Mortalität [56].
Eine weitere Post-hoc-Analyse von ETHOS konnte dies bestätigen: Das Risiko für schwere kardiopulmonale Ereignisse (u. a. schwerwiegendes kardiovaskuläres Ereignis [MACE], schwere Exazerbation, Tod) unter BUD/GLY/FORM vs. GLY/FORM konnte über 52 Wochen um 20 % (HR§ 0,80; 95 %-KI 0,67; 0,95; p = 0,0122) bei Patient:innen mit vorhergehenden Exazerbationen gesenkt werden. Das Risiko für kardiale unerwünschte Ereignisse (definiert nach Medical Dictionary for Regulatory Activities [Med-DRA]) wurde um 40 % reduziert (HR§ 0,60; 95 %-KI 0,48; 0,76; p < 0,0001) [58]. Die übliche COPD-Medikation einschließlich LAMA und LABA ist nicht mit CV-Nebenwirkungen allgemein bei Patient:innen mit COPD assoziiert [17].
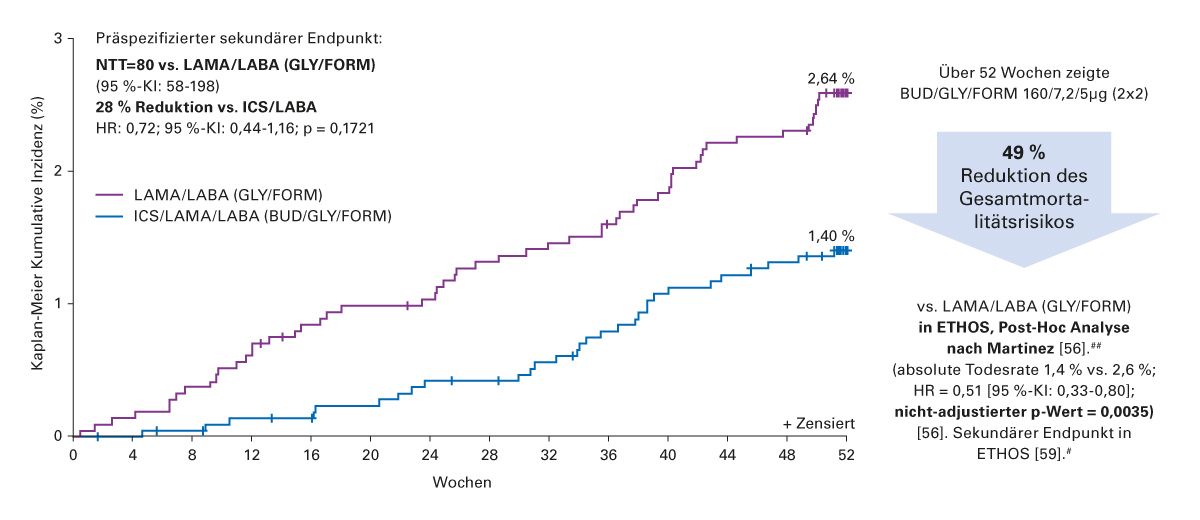
Abb. 7: ETHOS-Studie: Triple-Therapie BUD/GLY/FORM reduziert Gesamtmortalität um 49 % gegenüber GLY/FORM#,## (mod. n. Martinez et al. [56]) [59]
Phänotypisierung von Patient:innen notwendig
Prof. Dr. Kahnert erklärte: „Zur Verhinderung von Exazerbationen kann auch eine bessere Phänotypisierung der Patient:innen beitragen“. Sie ergänzte: „Damit müssen neue Studienkonzepte einhergehen, um die besser charakterisierten Patient:innen individuell und adäquat auf Basis der neuen Daten behandeln zu können.“ Ein Beispiel für eine solche Studie sei die laufende THARROS-Studie. Diese untersucht den Effekt einer zeitnahen und adäquaten Behandlungseskalation auf eine inhalative Triple-Therapie. THARROS vergleicht die Triple-Therapie BUD/GLY/FORM mit LAMA/LABA (GLY/ FORM). Kardiale Outcomes, z. B. die Zeit bis zum ersten schweren CV-Ereignis sind Endpunkte der Studie [60].
Fazit
COPD-Patient:innen erhalten im klinischen Alltag häufig keine adäquate Therapie gemäß Leitlinienempfehlungen. Dabei ist die Befolgung dieser für ein optimales Management von COPD-Patient:innen essenziell. Inhalative (Erhaltungs-)Therapien werden auch bei einer diagnostizierten COPD in vielen Fällen nicht initiiert bzw. nicht adäquat eskaliert. Zudem erhalten viele Patient:innen mit COPD trotz eines hohen kardiopulmonalen Risikos kein adäquates Management von CV-Erkrankungen und Risikofaktoren.
Dabei konnte gezeigt werden, dass das Risiko für kardiopulmonale Ereignisse bei Patient:innen mit vorhergehenden Exazerbationen durch medikamentöse Therapien gesenkt werden kann. Dies unterstreicht, dass das kardiopulmonale Risiko bei Menschen mit COPD insbesondere in der Pneumologie, der Kardiologie und der Allgemeinmedizin mehr Aufmerksamkeit erhalten sollte. Bei Luftnot sollte immer sowohl an die Lunge als auch an das Herz gedacht werden, d. h. bei COPD an CV-Erkrankungen und umgekehrt. Dazu sollte nach einem CV-Ereignis eine Lungendiagnostik und nach einer Exazerbation eine kardiologische Abklärung erfolgen. Nach einer Exazerbation sollte umgehend die Therapie eskaliert und bei anhaltender Dyspnoe mögliche Komorbiditäten abgeklärt werden, denn: Jede Exazerbation ist eine Exazerbation zu viel.
Fußnoten
* 52 % Reduktion mittelschwerer/schwerer Exazerbationen vs. GLY/FORM (LAMA/LABA) in KRONOS über 24 Wochen (p < 0,0001), signifikant. Die geschätzte jährliche Rate im BUD/GLY/FORM (160/7,2/5 µg [2×2])-Arm (n= 639) lag niedriger vs. GLY/FORM (LAMA/LABA) (n = 625) (0,46 vs. 0,95 [95 %-KI: 0,37–0,64]; p < 0,0001) [55].
** KRONOS-Studie: Randomisierte, multizentrische Phase-III-Studie über 24 Wochen. 1.902 Patient:innen mit moderater bis schwerer COPD: ≥ 2 Inhalationstherapien, CAT ≥ 10, 74 % ohne Exazerbationshistorie zu Studienbeginn. Eine Exazerbationshistorie war kein Einschlusskriterium. Primäre Endpunkte: FEV1-AUC von 0–4 Std. vs. BUD/FORM (ICS/LABA) und Änderung des morgendlichen Prä-Dosis FEV1-Talwertes vs. GLY/FORM (LAMA/LABA) über 24 Wochen. Sekundärer Endpunkt: u. a. die Rate mittelschwerer/ schwerer Exazerbationen [55].
# ETHOS-Studie: 52-wöchige, randomisierte, multizentrische Phase-III- Studie, > 8.500 Patient:innen mit moderater bis sehr schwerer COPD: COPD Assessment Test (CAT) ≥ 10; Einsekundenkapazität [FEV1] 25–65 % des voraussichtlichen Normalwertes, ≥ 2 inhalative Erhaltungstherapien, Exazerbationen in den letzten 12 Monaten: FEV1 < 50 %: ≥ 1 mittelschwere/schwere Exazerbation; FEV1 ≥ 50 %: ≥ 2 moderate oder ≥ 1 schwere Exazerbation. Primärer Endpunkt: Rate mittelschwerer/ schwerer Exazerbationen. Sekundärer Endpunkt: u.a. Gesamtmortalitätsrate [59].
## Das Gesamtmortalitätsrisiko im BUD/GLY/FORM (160/7,2/5 µg, 2×2)-Arm war niedriger vs. LAMA/LABA (GLY/FORM) (absolute Todesrate 1,4 vs. 2,6 %; HR = 0,51; [95%-KI 0,33–0,80]; nicht adjustierter p-Wert = 0,0035) und niedriger vs. ICS/LABA (BUD/FORM) (absolute Todesrate 1,4 vs. 1,9 %; HR = 0,72; [95 %-KI: 0,44–1,16]; nicht adjustierter p-Wert = 0,1721). Finaler Datensatz inkl. weiterer Daten zum Vitalstatus. p-Werte gelten als nicht adjustiert, wenn ein Endpunkt der Typ-I-Fehlerkontrollprüfung keine Signifikanz erreicht. Post-hoc Analyse [56].
§ HR geben das relative Risiko, nicht das absolute Risiko an. Die Behandlungsvergleiche wurden anhand von Cox-Regressionsmodellen bewertet; nicht adjustierter p-Wert.
Literatur
- Vogelmeier CF et al. Respir Med. 2024:222:107506.
- Vogelmeier CF et al. BMJ Open Respir Res. 2024;11:e002153.
- Aisanov Z, Khaltaev N. J Thorac Dis. 2020;12:2791–2802.
- Alter P et al. Int J Chron Obstruct Pulmon Dis. 2019;14:2163–2172.
- OECD/European Observatory on Health Systems and Policies, State of Health in the EU. Deutschland: Länderprofil Gesundheit 2021. https://health.ec.europa.eu/system/files/2021-12/2021_chp_de_german.pdf (letzter Zugriff: 25.07.2025).
- World Health Organization (WHO). The top 10 causes of death. 2024. www.who.int/news-room/fact-sheets/detail/ the-top-10-causes-of-death (letzter Zugriff: 25.07.2025).
- Berry CE, Wise RA. COPD. 2010;7:375–382.
- Fabbri LM et al. Lancet Respir Med. 2023;11:1020–1034.
- Sin DD et al. Eur Respir J. 2006;28:1245–1257.
- Curkendall SM et al. Ann Epidemiol. 2006;16:63–70.
- Müllerova H et al. Chest. 2013;144:1163–1178.
- Finkelstein J et al. Int J Chron Obstruct Pulmon Dis. 2009;4:337–349.
- Chen W et al. Lancet Respir Med. 2015;3:631–639.
- Feary JR et al. Thorax. 2010;65:956–962.
- Karch A et al. Respir Med. 2016;114:27–37.
- Kahnert K et al. Pneumologie. 2023;77:81–93.
- Visseren FLJ et al. Eur Heart J. 2021;42:3227–3337.
- Kibbler J et al. ERJ Open Res. 2023;9:00548–2023.
- Müllerová H et al. Ther Adv Respir Dis. 2022;16:1–11.
- Graul EL et al. Am J Respir Crit Care Med. 2024;209:960–972.
- Singh D et al. Adv Ther. 2024;41:2151–2167.
- Pullen R et al. Int J Chron Obstruct Pulmon Dis. 2021;16:2301-2322.
- Global Initiative for Chronic Obstructive Lung Disease. GOLD Report 2025. https://goldcopd.org/wp-content/ uploads/2024/11/GOLD-2025-Report-v1.0-15Nov2024_WMV.pdf (letzter Zugriff: 19.05.2025).
- Rademacher J et al. Eur J Prev Cardiol. 2024;31:877-888.
- Gellmann M (Ed.) Encyclopedia of Behavioral Medicine. 2017; doi.10.1007/978–1–4614–6439–6_135–2.
- Van Eeden S et al. Am J Respir Crit Care Med. 2012;186:11–16.
- Barnes PJ et al. Nat Rev Dis Primers. 2015;1:15076.
- O´Donnell DE et al. Am J Respir Crit Care Med. 2001;164:770–777.
- García-Río F et al. Chest. 2012;142:338–346.
- Solidoro P et al. Front Med (Lausanne). 2022:9:816843.
- Kent BD et al. Int J Chron Obstruct Pulmon Dis. 2011;6:199–208.
- Rabe KF et al. Eur Respir Rev. 2018;27:180057.
- Crisan L et al. Front Cardiovasc Med. 2019;6:79.
- Watz H et al. Chest. 2010;138:32–38.
- Abdo M et al. Am J Respir Crit Care Med. 2025;211:477–485.
- Polman R et al. Expert Rev Cardiovasc Ther. 2024;22:177-191.
- Task Force for the management of dyslipidaemias of the European Socienty of Cardiology (ESC) and European Atherosclerosis Society (EAS). 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. https://academic.oup.com/eurheartj/article-pdf/41/1/111/33707502/ehz455.pdf (letzter Zugriff: 25.07.2025).
- American Heart Association. PREVENTTM Online Calculator. https://professional.heart.org/en/guidelines-and- statements/prevent-calculator (letzter Zugriff: 25.07.2025).
- Miravitlles M et al. Ther Adv Respir Dis. 2023;17:17534666231208630.
- Waschki B et al. Eur Respir J. 2020; 27;55:1901314.
- Kahnert K et al. Respir Med. 2022;204:107014.
- Groenewegen A et al. Lancet Public Health. 2024;9:e88-e99.
- Kahnert K et al. Ther Adv Respir Dis. 2023;17:17534666221148663.
- Diaz AA et al. JAMA. 2023; 329:1832–1839.
- Bhatt SP et al. N Engl J Med. 2023; 389:205-214.
- Bhatt SP et al. N Engl J Med. 2024;390:2274-2283.
- Singh D et al. European Respiratory Society (ERS) InternationalCongress, 2023;PA4687.
- Nici L et al. Am J Respir Crit Care Med. 2020;201:E56-E69.
- Bourbeau J et al. Can J Respir Crit Care Sleep Med. 2023;7:173–191.
- Bundesärztekammer (BÄK), Kassenärztliche Bundesvereinigung (KBV), Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). Nationale VersorgungsLeitlinie COPD, Ergänzung zur 2. Auflage: Kapitel 8. 2024. https://register.awmf.org/de/leitlinien/detail/nvl-003 (letzter Zugriff: 25.07.2025).
- Gemeinsamer Bundesausschuss (G-BA). DMP-Anforderungen-Richtlinie (DMP-A-RL). https://www.g-ba.de/downloads/62-492-3839/DMP-A-RL_2024-11-22_iK-2025-07-01.pdf (letzer Zugriff: 25.07.2025).
- Kardos P et al. Respir Med. 2017;124:57.
- Bogart M et al. Int J Chron Obstruct Pulmon Dis. 2023;18:1575–1586.
- Lipson DA et al. N Engl J Med. 2018;378:1671–1680.
- Ferguson GT et al. Lancet Respir Med. 2018;6:747–758.
- Martinez FJ et al. Am J Respir Crit Care Med. 2021;203:553–564.
- Lipson DA et al. Am J Respir Crit Care Med. 2020; 201:1508–1516.
- Singh D et al. American Thoracic Society International Conference (ATS) 2024. Poster ID 913.
- Rabe KF et al.: N Engl J Med 2020; 383:35–48 + Supplement.
- Clinical Trials.gov ID: NCT06283966.
Bildquellen
Titel: © Rasi – stock.adobe.com


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.