Atopische Dermatitis – Sonderlokalisationen wie Head & Neck und Genitalien
Interessengebiete: Allgemeinmedizin und Innere Medizin, Haut- und Geschlechtskrankheiten, Allergologie
Die atopische Dermatitis (AD) ist eine der häufigsten chronisch-entzündlichen Hauterkrankung mit erheblicher Belastung für die Patientinnen und Patienten. Neben den klassischen Ekzemen rücken zunehmend Sonderlokalisationen in den Fokus, insbesondere der Kopf-Hals-Bereich (Head & Neck) und der Genitalbereich. Diese Lokalisationen sind klinisch besonders relevant, da sie funktionell sensibel, kosmetisch sichtbar und häufig therapieresistent sind. Registerdaten, unter anderem aus TREATgermany, zeigen, dass über 80 % der moderat bis schwer betroffenen Patientinnen und Patienten einen Kopf-Hals-Befall aufweisen. Damit ist dies die häufigste betroffene Region bei schwerer AD. Gleichzeitig werden genitale Ekzeme in der klinischen Praxis häufig übersehen, obwohl sie die Lebensqualität in starkem Maße beeinträchtigen.
Dieser Beitrag beleuchtet die Pathophysiologie der AD, insbesondere die Rolle von Interleukin‑13 (IL‑13), erklärt die Besonderheiten der Head-Neck-Dermatitis sowie der genitalen AD und gibt einen Überblick über moderne Therapieoptionen.
Kursinhalt
Inhaltsverzeichnis
- Einleitung
- Pathomechanismus der atopischen Dermatitis
- Therapieentscheidung und die S3-Leitlinie
- Der Head-Neck-EASI: Definition und Bedeutung in der Bewertung der Krankheitsaktivität
- Die TRACE-Studie (NIS): Real-World-Wirksamkeit und Versorgungsbild
- Lebrikizumab: Wirksamkeit des zweiten IL-13-Inhibitors auf die Head-Neck-Dermatitis
- Genitale Beteiligung der atopischen Dermatitis: Relevanz im klinischen Alltag
- Zusammenfassung
- Literaturverzeichnis
Einleitung
Die atopische Dermatitis (AD) ist eine der häufigsten chronisch-entzündlichen Hauterkrankungen mit erheblicher Belastung für die Patientinnen und Patienten. Neben den klassischen Ekzemen rücken zunehmend Sonderlokalisationen in den Fokus, insbesondere der Kopf-Hals-Bereich (Head & Neck) und der Genitalbereich. Diese Lokalisationen sind klinisch besonders relevant, da sie funktionell sensibel, kosmetisch sichtbar und häufig therapieresistent sind. Registerdaten, unter anderem aus TREATgermany, zeigen, dass über 80 % der moderat bis schwer betroffenen Patientinnen und Patienten einen Kopf-Hals-Befall aufweisen. Damit ist dies die häufigste betroffene Region bei schwerer AD. Gleichzeitig werden genitale Ekzeme in der klinischen Praxis häufig übersehen, obwohl sie die Lebensqualität in starkem Maße beeinträchtigen.
Dieser Beitrag beleuchtet die Pathophysiologie der AD, erklärt die Besonderheiten der Head-Neck-Dermatitis sowie der genitalen AD und gibt einen Überblick über moderne Therapieoptionen, insbesondere die Rolle von Interleukin‑13 (IL‑13).
Pathomechanismus der atopischen Dermatitis
Der Pathomechanismus der atopischen Dermatitis ist komplex und multifaktoriell. Mehrere pathogenetische Einflussgrößen wirken zusammen und führen letztlich zu dem klinischen Bild der Ekzeme. Eine zentrale Rolle spielt dabei die genetische Prädisposition. Am bekanntesten ist die Mutation im Filaggrin-Gen, die mit einer Störung der epidermalen Barriere einhergeht. Klinisch kann sie sich unter anderem durch eine palmare Hyperlinearität bemerkbar machen. Darüber hinaus sind weitere Gene identifiziert worden, die insbesondere in immunologischen Signalwegen Funktionen übernehmen und zur Krankheitsentstehung beitragen.
Umweltfaktoren sind ein weiterer entscheidender Auslöser für entzündliche Schübe. Allergene können Exazerbationen triggern; erstmals konnte 2015 in Hannover experimentell gezeigt werden, dass die kontrollierte Exposition von Patientinnen und Patienten mit atopischer Dermatitis gegenüber Pollen unmittelbar zu Ekzemschüben führen kann.
Auch das Hautmikrobiom trägt zur Krankheitsaktivität bei. Insbesondere Staphylococcus aureus wird häufig auf den betroffenen Hautarealen gefunden. Es verstärkt die Entzündung und spielt eine wichtige Rolle bei der Aufrechterhaltung der Ekzemaktivität.
Die Störung der Hautbarriere ist ein zentrales Merkmal der atopischen Dermatitis. Durch eine veränderte Struktur der Keratinozyten liegen diese weniger dicht aneinander, wodurch pathogene Keime und irritative Substanzen leichter in die Haut eindringen können. Vor diesem Hintergrund ist die konsequente Basistherapie mit geeigneten Emollienzien essenziell, um die Barriere zu stabilisieren und die Haut gegenüber äußeren Reizen zu schützen.
Ein weiteres zentrales Element ist die immunologische Dysregulation. Das Immunsystem der Patientinnen und Patienten zeigt einen charakteristischen Shift hin zu einer Typ-2-vermittelten Entzündung, die unter anderem durch Zytokine wie IL-4 und IL-13 geprägt ist. Diese entzündliche Achse spielt eine wesentliche Rolle in der Pathogenese der Erkrankung und wird in modernen Therapieansätzen gezielt adressiert.
Die Gruppe um Prof. Emma Guttman aus New York hat die Vielfalt der Erkrankung in einem Review Artikel dargestellt, indem sie unterschiedliche Entzündungssignaturen der AD-Subtypen gegenübergestellt hat. So unterscheidet sich die europäische atopische Dermatitis immunologisch deutlich vom asiatischen Subtyp, der zum Teil andere Muster der Entzündungsaktivität zeigt. Auch bei der kindlichen atopischen Dermatitis finden sich wiederum eigene Charakteristika in der Zusammensetzung und Aktivität der Immunzellpopulationen.
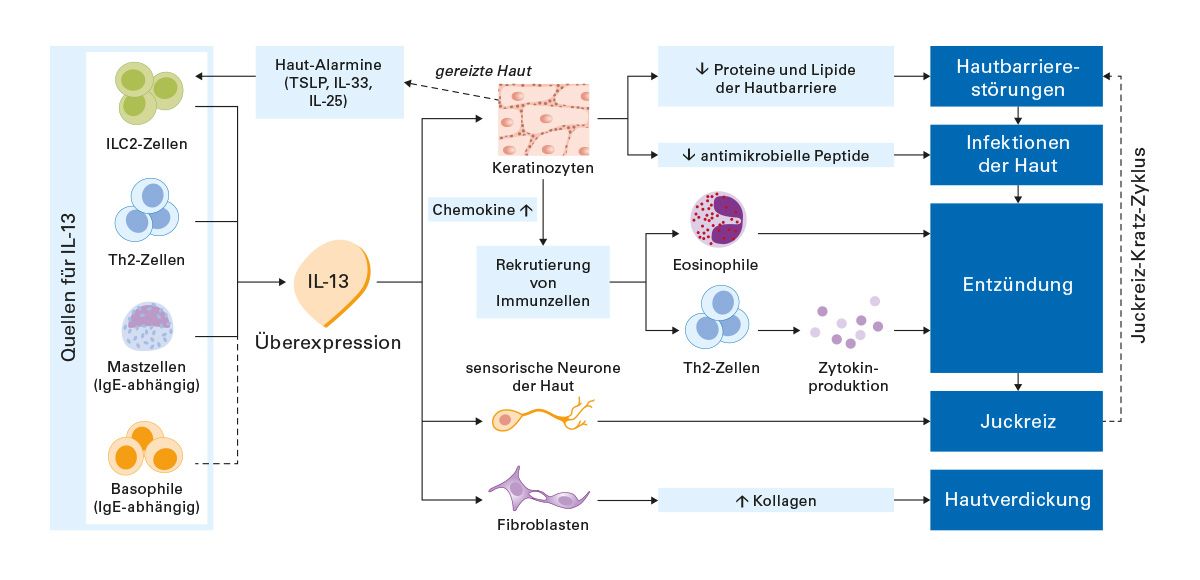
Trotz dieser Unterschiede gibt es einen gemeinsamen Nenner: In allen Subtypen spielt die Typ-2-Immunantwort eine zentrale Rolle. Insbesondere Th2-Zellen sind regelmäßig beteiligt; sie setzen charakteristische Entzündungsmediatoren frei, vor allem Interleukin-4 (IL-4) und Interleukin-13 (IL-13). Diese Zytokine gelten als wesentliche Treiber der Entzündungsprozesse bei der atopischen Dermatitis und stehen deshalb im Fokus moderner zielgerichteter Therapien.
Moderne Einzelzellanalysen („Single Cell“-Technologien) ermöglichen einen tiefen Einblick in die immunologischen Mechanismen der atopischen Dermatitis. Auf der Grundlage solcher Untersuchungen lassen sich einzelne Immunzellen – insbesondere T-Zellen – hinsichtlich ihres Transkriptoms, also ihrer Genexpressionsmuster, analysieren. In den entsprechenden Darstellungen repräsentiert jeder Punkt eine einzelne Zelle.
Diese Analysen zeigen, dass sich innerhalb der T-Zellpopulation spezielle Subgruppen finden, darunter die sogenannten Th2-22-Zellen, die in der grafischen Darstellung durch gelblich-bräunliche Farbtöne hervorgehoben werden. Entscheidend ist, welche Zytokine diese Zellen produzieren. Die Auswertung der Transkriptionsprofile zeigt klar, dass diese Zellen überwiegend Interleukin-13 (IL-13) bilden, während Interleukin-4 (IL-4) nur in vergleichsweise geringem Maße exprimiert wird.
IL-13 trägt deutlich zur Störung der Hautbarriere bei, indem es die Differenzierung epidermaler Zellen beeinflusst und die Integrität der Barriere schwächt. Gleichzeitig spielt es eine zentrale Rolle bei der Vermittlung von Juckreiz, indem es über sensorische Nervenfasern pruritogene Signale verstärkt. Dies führt zum bekannten Juckreiz-Kratzer-Kreislauf, der die Entzündung weiter antreibt.
Darüber hinaus beeinflusst IL-13 das Hautmikrobiom, indem es die Produktion antimikrobieller Peptide reduziert und so die mikrobielle Abwehr schwächt. Auch auf Ebene des Bindegewebes entfaltet IL-13 Wirkung: Es stimuliert Fibroblasten, fördert die Kollagenproduktion und trägt so zur Hautverdickung und zur klinisch sichtbaren Lichenifikation bei – ein typisches Merkmal chronischer Ekzeme.
IL-13 stammt nicht ausschließlich aus Th2-Zellen. Mehrere weitere Immunzelltypen sind in der Lage, IL-13 freizusetzen, was dessen zentrale Stellung in der Entzündung weiter unterstreicht. Insgesamt zeigt sich, dass IL-13 ein Schlüsselakteur ist, der Barrierefunktion, Juckreiz, Mikrobiom, Immunantwort und dermale Umbauprozesse wesentlich steuert und damit ein hoch relevantes therapeutisches Target darstellt.
Therapieentscheidung und die S3-Leitlinie
Die immunologischen Mechanismen verdeutlichen, warum Interleukin-13 (IL-13) ein zentrales therapeutisches Target moderner Biologika ist. Die Frage ist, wie diese Erkenntnisse in konkrete klinische Therapieentscheidungen einfließen. Orientierung bietet das aktuelle Stufenschema der S3-Leitlinie „Atopische Dermatitis“, das eine strukturierte Vorgehensweise bei der Behandlung der Erkrankung vorgibt.
In Stufe 1 steht die Behandlung der trockenen Haut und der gestörten Hautbarriere im Vordergrund. Hier ist die topische Basistherapie essenziell. Sie umfasst die regelmäßige Pflege mit Emollienzien („Emollient“ oder „Emollient plus“), um die Barriere zu stabilisieren und den transepidermalen Wasserverlust zu reduzieren.
In Stufe 2 werden zusätzlich antientzündliche topische Therapien eingesetzt, also insbesondere topische Kortikosteroide oder Calcineurininhibitoren. Ergänzend weist die Leitlinie ausdrücklich darauf hin, dass bei Patientinnen und Patienten mit atopischer Dermatitis sowohl eine topische als auch gegebenenfalls eine systemische antimykotische Therapie in Betracht zu ziehen ist. Dies gilt besonders für die Head-Neck-Variante der AD, bei der mykologische Trigger eine relevante Rolle spielen können. Die Grundlage für diese Empfehlung bilden Untersuchungen, unter anderem aus dem Jahr 2005, in denen Patientengruppen mit Head-Neck-AD, Nicht-Head-Neck-AD, Kontaktallergien und seborrhoischer Dermatitis miteinander verglichen wurden. Ein besonderer Fokus lag auf dem Malassezia furfur-spezifischen IgE, also Antikörpern, die auf eine Sensibilisierung gegenüber Hefepilzen der Gattung Malassezia hinweisen. Die Daten zeigen, dass Patienten mit Head-Neck-AD signifikant häufiger erhöhte Malassezia-IgE-Spiegel aufweisen. Dies unterstützt die Annahme, dass Malassezia-assoziierte Mechanismen zur Entzündung im Kopf-Hals-Bereich beitragen können und erklärt, warum antimykotische Maßnahmen hier therapeutisch besonders sinnvoll sind.
In Stufe 3 werden zusätzlich systemische antiinflammatorische Therapien eingesetzt.
Bedeutung der Malassezia-Sensibilisierung
Untersuchungen zeigen, dass Patientinnen und Patienten mit Head-Neck- Dermatitis sehr häufig erhöhte Malassezia-spezifische IgE-Antikörper aufweisen. Im Gegensatz dazu sind diese IgE-Spiegel bei Personen ohne Befall im Kopf-Hals-Bereich deutlich seltener erhöht. Dies stützt die Annahme, dass bei der Head-Neck-Variante der AD eine allergische Reaktion auf Bestandteile von Hefepilzen, insbesondere Malassezia furfur, eine zentrale Rolle spielt. Diese Antigene befinden sich als kommensale Bestandteile auf der Hautoberfläche und können bei entsprechender Sensibilisierung eine lokale Entzündungsreaktion auslösen und die Ekzeme im Kopf-Hals-Bereich triggern.
Antimykotische Maßnahmen können daher therapeutisch wirksam sein. Neben topischen Präparaten gibt es auch Hinweise darauf, dass systemische Antimykotika einen Nutzen haben können. In einer Studie aus dem Jahr 2004 wurde gezeigt, dass die Gabe von Itraconazol in einer Dosierung von 200 mg zu einer klinischen Besserung der Head-Neck-Dermatitis führte. Gleichwohl zeigt die klinische Erfahrung, dass eine rein antimykotische Therapie in vielen Fällen nicht ausreicht, um die Erkrankung langfristig zu kontrollieren.
In diesen Situationen ist ein Therapiewechsel notwendig. Wenn trotz leitliniengerechter topischer Behandlung und adäquater antimykotischer Therapie keine ausreichende Krankheitskontrolle erreicht wird, erfolgt der Übergang in Stufe 3 der S3-Leitlinie: die Systemtherapie.
Entscheidungsfaktoren für den Einsatz einer Systemtherapie
Bei der Wahl einer geeigneten Systemtherapie spielen zahlreiche Faktoren eine Rolle. Einer dieser Aspekte ist das klinische Verteilungsmuster der Ekzeme, zu dem auch die Head-Neck-Dermatitis gehört. Um die Entscheidung für eine Systemtherapie strukturiert zu treffen, bietet die S3-Leitlinie eine praxisnahe Checkliste, die in drei Kategorien unterteilt ist: objektive Kriterien, subjektive Kriterien und Therapiekriterien.
Für die Indikationsstellung zur Systemtherapie muss in jeder dieser drei Kategorien mindestens ein Kriterium erfüllt sein.
Unter den objektiven Kriterien findet sich auch der Hinweis auf therapierefraktäre Ekzeme an sensitiven und sichtbaren Arealen. Damit wird der Kopf-Hals-Bereich berücksichtigt. Liegt also ein persistierender Head-Neck-Befall vor, der sich trotz leitliniengerechter topischer Therapie nicht ausreichend kontrollieren lässt, ist das objektive Kriterium für eine Systemtherapie bereits erfüllt.
Kommen zusätzlich subjektive Beschwerden wie ausgeprägter Juckreiz hinzu – und dieser lässt sich durch äußerliche Maßnahmen nicht ausreichend behandeln –, so ist die Indikation zur Systemtherapie praktisch gegeben. Dieser strukturierte Ansatz erleichtert die therapeutische Entscheidung und schafft Klarheit im klinischen Alltag.
Im nächsten Schritt stellt sich die Frage, welche systemischen Behandlungsoptionen zur Verfügung stehen. Derzeit sind sieben moderne Wirkstoffe zugelassen. Hierzu zählen auf der einen Seite die Biologika – alphabetisch geordnet: Dupilumab, Lebrikizumab, Nemolizumab und Tralokinumab – und auf der anderen Seite die Januskinase-Inhibitoren: Abrocitinib, Baricitinib und Upadacitinib. Diese Präparate unterscheiden sich hinsichtlich Wirkmechanismus, Wirksamkeitsprofil, Sicherheitsaspekten und Anwendungsgebieten und ermöglichen dadurch eine individualisierte Therapieentscheidung. In den folgenden Darlegungen werden die JAK Inhibitoren nicht näher beleuchtet.
Unterschiede im Wirkmechanismus der IL-13-gerichteten Biologika Tralokinumab und Lebrikizumab
Im Rahmen der systemischen Therapie fokussieren wir uns auf die Biologika, die gezielt in die Typ-2-Entzündung eingreifen. Der Wirkmechanismus von Tralokinumab verdeutlicht dabei wichtige Unterschiede zu Lebrikizumab, obwohl beide Antikörper gegen dasselbe Schlüsselzytokin gerichtet sind.
Interleukin-4 (IL-4) und Interleukin-13 (IL-13) gehören zu den zentralen Effektormolekülen der Typ-2-Entzündung. Wie bereits dargestellt, spielt IL-13 in der Haut eine besonders bedeutende Rolle und scheint das maßgebliche Zytokin in der lokalen Entzündungsreaktion der atopischen Dermatitis zu sein.
IL-13 kann an zwei unterschiedliche Rezeptoren binden:
- IL-13-Rezeptor α1 (IL-13Rα1)
– bildet gemeinsam mit einer a-Untereinheit des IL-4-Rezeptors den Rezeptor. - IL-13-Rezeptor α2 (IL-13Rα2)
– besitzt eine hohe Affinität zu IL-13.
– Seine genaue Funktion ist noch nicht abschließend geklärt.
– Aktuell wird er häufig als möglicher Decoy-Rezeptor interpretiert, der IL-13 bindet, ohne ein klassisches Signal weiterzugeben.
Der entscheidende therapeutische Unterschied zwischen den beiden IL-13-Antikörpern liegt exakt in diesem Bereich:
- Tralokinumab neutralisiert IL-13 vollständig, indem es die Bindung an beide Rezeptoren – IL-13Rα1 und IL-13Rα2 – verhindert.
- Lebrikizumab hingegen blockiert primär die Interaktion von IL-13 mit IL-13Rα1, hemmt jedoch nicht die Bindung an IL-13Rα2.
Diese unterschiedliche Rezeptorinteraktion könnte erklären, weshalb sich die klinischen Wirkprofile der beiden Therapien in bestimmten Aspekten voneinander unterscheiden. Aktuelle Metaanalysen zeigen, dass Lebrikizumab gemessen an dem Erreichen des EASI-75 besser zu wirken scheint und vergleichbar mit Dupilumab. Head-to-Head Studien liegen aber nicht vor.
Wirksamkeit von Dupilumab bei Head-Neck-Dermatitis und Besonderheiten der DAHND
Dupilumab gilt im klinischen Alltag als wirksame Therapie für die moderate bis schwere atopische Dermatitis und ist aktuell das am häufigsten eingesetzte Biologikum zur Behandlung der atopischen Dermatitis in Deutschland. Die Frage, die sich jedoch besonders bei Sonderlokalisationen stellt, lautet: Wie effektiv ist Dupilumab speziell bei der Head-Neck-Dermatitis? Genau hierzu liefern Registerdaten wertvolle Hinweise.
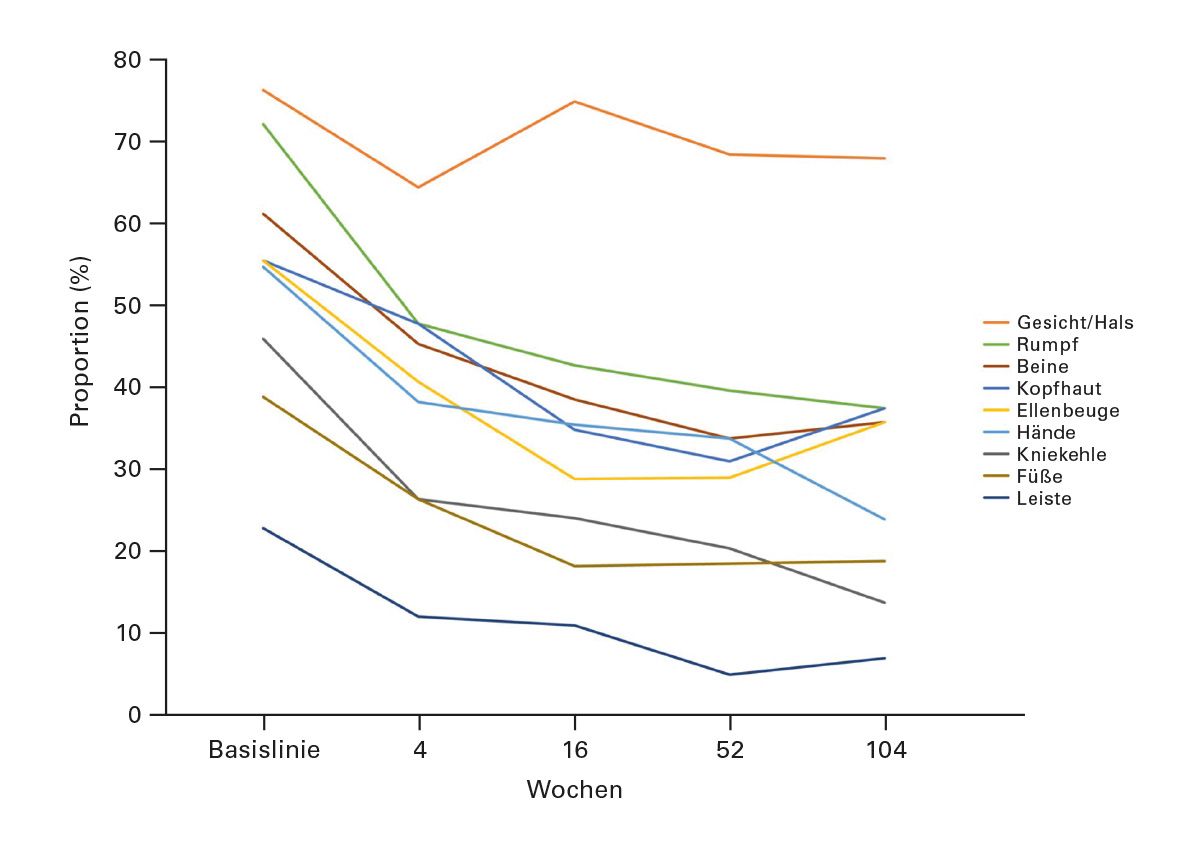
Im dänischen nationalen Register, das alle universitären dermatologischen Zentren einbezieht, wurden 347 erwachsene Patientinnen und Patienten mit atopischer Dermatitis erfasst, die mit Dupilumab behandelt wurden. Das Behandlungskollektiv zeigte ein hohes Drug Survival, was bedeutet, dass die Therapie in der Regel über lange Zeit fortgeführt wurde und nur selten aufgrund von Nebenwirkungen oder mangelnder Wirksamkeit abgesetzt werden musste.
Betrachtet man jedoch den Kopf-Hals-Befall, ergibt sich ein differenziertes Bild:
- Zu Therapiebeginn wiesen 76 % der Patientinnen und Patienten eine Head-Neck-Dermatitis auf.
- Nach 104 Wochen – also zwei Jahren kontinuierlicher Behandlung – lag dieser Anteil immer noch bei 68 %.
Diese Daten verdeutlichen, dass die Kurve über den gesamten Beobachtungszeitraum nicht wesentlich abfällt. Anders ausgedrückt: Bei der Sonderlokalisation Head-Neck scheint Dupilumab deutlich weniger wirksam zu sein als bei Ekzemen anderer Körperareale. Diese Beobachtung deckt sich auch mit klinischen Erfahrungen vieler Behandlerinnen und Behandler.
Ein weiterer relevanter Aspekt sind die sogenannten Dupilumab-associated Head and Neck Dermatitis (DAHND). Dabei handelt es sich um subakut bis akut wirkende Ekzeme, die erst unter laufender Dupilumab-Therapie auftreten und insbesondere den Kopf-Hals-Bereich betreffen. Klinisch zeigen sich klassische ekzematöse, teils erythematöse oder schuppige Veränderungen, die sich deutlich vom Ausgangsbefund abheben.
Die Arbeitsgruppe um Christine Bangert und Patrick Brunner aus Wien und New York hat diese Läsionen wissenschaftlich untersucht. Aus den betroffenen Arealen wurden Hautproben entnommen und anschließend mithilfe hochauflösender Single-Cell-Transkriptomanalysen ausgewertet. Diese Untersuchungen zeigen eine charakteristische Immunzellzusammensetzung und spezifische Veränderungen der Transkriptionsaktivität. Die Daten deuten darauf hin, dass bei den DAHND-Läsionen entzündliche Signaturen auftreten, die sich von der klassischen AD-Entzündung unterscheiden. Die Autoren haben zytotoxische CD8⁺-T-Zellen identifiziert, die überwiegend Interleukin-22 (IL-22) produzieren.
Diese vermehrte IL-22-Produktion deutet auf einen Inflammationsshift hin: Unter der Blockade der IL-4/IL-13-Signalachse durch Dupilumab scheinen alternative entzündliche Signalwege – insbesondere die IL-22-Achse – stärker aktiviert zu werden. Dies könnte wesentlich zur Entstehung oder Persistenz der Head-Neck-Dermatitis während der Dupilumab-Therapie beitragen.
Zusätzlich spielt auch die bereits oben beschriebene Malassezia-Sensibilisierung eine Rolle. Wie schon zuvor dargestellt, finden sich erhöhte Malassezia-spezifische IgE-Spiegel bei Patientinnen und Patienten mit Head-Neck-Dermatitis deutlich häufiger. Dieses Muster zeigt sich auch bei Personen mit DAHND, was darauf hindeutet, dass Hefepilz-assoziierte allergische Reaktionen einen weiteren Trigger dieser entzündlichen Veränderungen darstellen können. Daraus ergibt sich, dass antimykotische Therapien – topisch oder systemisch – bei DAHND eine therapeutische Option sein können.
In einer aktuellen Untersuchung wurde zudem evaluiert, ob ein Therapiewechsel von Dupilumab auf einen IL-13-spezifischen Inhibitor klinische Vorteile bringen kann. Dabei wurden insbesondere die Effekte auf den EASI-Score für den Kopf-Hals-Bereich betrachtet. Die Ergebnisse zeigten, dass es unter Tralokinumab und Lebrikizumab zu einer Abnahme des Head&Neck-EASI kam, wenn gleich der Effekt für Tralokinumab statistisch nicht signifikant war.
Diese Daten legen nahe, dass bei Patientinnen und Patienten mit DAHND ein Wechsel von Dupilumab zu einem IL-13-spezifischen Biologikum – also Tralokinumab oder Lebrikizumab – eine sinnvolle therapeutische Strategie darstellen kann, insbesondere wenn die Head-Neck-Beteiligung unter Dupilumab persistiert oder sich sogar verschlechtert.
Der Head-Neck-EASI: Definition und Bedeutung in der Bewertung der Krankheitsaktivität
Bevor die Studiendaten zur Wirksamkeit moderner Therapien auf die Head-Neck-Dermatitis betrachtet werden, lohnt sich ein Blick auf den Head–Neck-EASI (H&N-EASI), also den für diese Körperregion spezifisch abgeleiteten Teil des etablierten Eczema Area and Severity Index (EASI). Der EASI ist einer der zentralen Scores zur objektiven Erfassung der Schwere der atopischen Dermatitis und kombiniert zwei Komponenten:
- die betroffene Körperoberfläche und
- die Intensität der klinischen Ekzemmerkmale.
Für die Bewertung wird der Körper in vier anatomische Regionen unterteilt: Kopf/Hals, Stamm, obere Extremitäten und untere Extremitäten. Jede Region wird separat hinsichtlich der Schwere der typischen Ekzemmerkmale beurteilt:
- Erythem,
- Ödem/Induration,
- Exkoriation und
- Lichenifikation.
Diese Merkmale werden jeweils auf einer Skala von 0 bis 3 bewertet, sodass sich für eine Region maximal 12 Punkte ergeben.
Hinzu kommt ein Flächenscore, der den Anteil der betroffenen Körperoberfläche abbildet und zwischen 0 und 6 Punkten liegt. Um den Regionswert in den Gesamt-EASI zu integrieren, wird dieser mit einem gewichtenden Faktor multipliziert. Für den Kopf-Hals-Bereich beträgt dieser Faktor 0,1.
Daraus ergibt sich für den Head-Neck-EASI ein maximaler Wert von 7,2 Punkten (12 Punkte × 6 Flächenscore × 0,1).
Diese isolierte Auswertung des Kopf-Hals-Befalls wurde in mehreren klinischen Studien genutzt, um gezielt die Wirksamkeit von Therapien in dieser besonders relevanten und oft schwierigen Lokalisation der atopischen Dermatitis zu analysieren.
Der Head-Neck-EASI und Ergebnisse aus ECZTRA 1/2 sowie der ECZTEND-Langzeitphase
ECZTRA1/2 sind die Phase 3 Zulassungsstudien des Medikaments Tralokinumab. Neben den klassischen Phase-3-Studien wurde insbesondere die ECZTEND-Langzeitstudie bezüglich des Kopf-Hals Befalls ausgewertet, die eine Fortführung der ursprünglichen Zulassungsstudien darstellt. Während die Kernstudien ECZTRA 1 und ECZTRA 2 über ein Jahr liefen, wurde Tralokinumab in ECZTEND über weitere drei Jahre verabreicht.
In dieser Langzeitkohorte wurden 1.192 Patientinnen und Patienten untersucht. Insgesamt handelte es sich um eine schwer betroffene Population: Der mittlere Gesamt-EASI lag bei 32,2, was einen hohen Ausgangsschweregrad widerspiegelt. Auch der Head-Neck-EASI zeigte mit 3,2 Punkten einen deutlichen Befall im Kopf-Hals-Bereich – zur Erinnerung: Der mögliche Wertebereich reicht von 0 bis maximal 7,2.
87,8 % der Studienteilnehmenden wiesen einen Head-Neck-EASI über 1 auf, also klinisch relevante Ekzemveränderungen in dieser Lokalisation. Diese hohe Ausgangsprävalenz unterstreicht die besondere Bedeutung des Kopf-Hals-Befalls in schwereren AD-Kollektiven.
Die Wirksamkeitsdaten aus ECZTRA 1/2 und der ECZTEND-Langzeitphase zeigen ein konsistentes Bild:
- Der Anteil der Patientinnen und Patienten, die im Verlauf einen Head-Neck-EASI < 1 erreichten, stieg kontinuierlich an. In ECZTEND lag dieser Wert bei 86,1 %.
- Darüber hinaus erreichten 80,6 % der Behandelten eine Verbesserung des Head-Neck-EASI um mindestens 75 % (Head-Neck-EASI 75).
Die TRACE-Studie (NIS): Real-World-Wirksamkeit und Versorgungsbild
Weitere Einblicke liefert die nichtinterventionelle Studie TRACE, die unter Alltagsbedingungen die Wirksamkeit und Sicherheit von Tralokinumab untersucht. Eingeschlossen wurden erwachsene Patientinnen und Patienten mit diagnostizierter atopischer Dermatitis, die Tralokinumab-naiv waren. Eine vorausgegangene andere Systemtherapie war jedoch zulässig.
Mit 824 Studienteilnehmenden aus über 160 Zentren weltweit bildet die TRACE-Studie ein breites, realitätsnahes Patientenspektrum ab. Die Erkrankungsschwere, Vortherapien und Begleiterkrankungen variieren entsprechend und entsprechen weitgehend dem Versorgungsalltag.
Es erfolgten festgelegte Visiten bei 3, 6, 9 und 12 Monaten. Dadurch lässt sich sowohl der frühe Therapieeffekt als auch die längerfristige Stabilität des Ansprechens detailliert beurteilen.
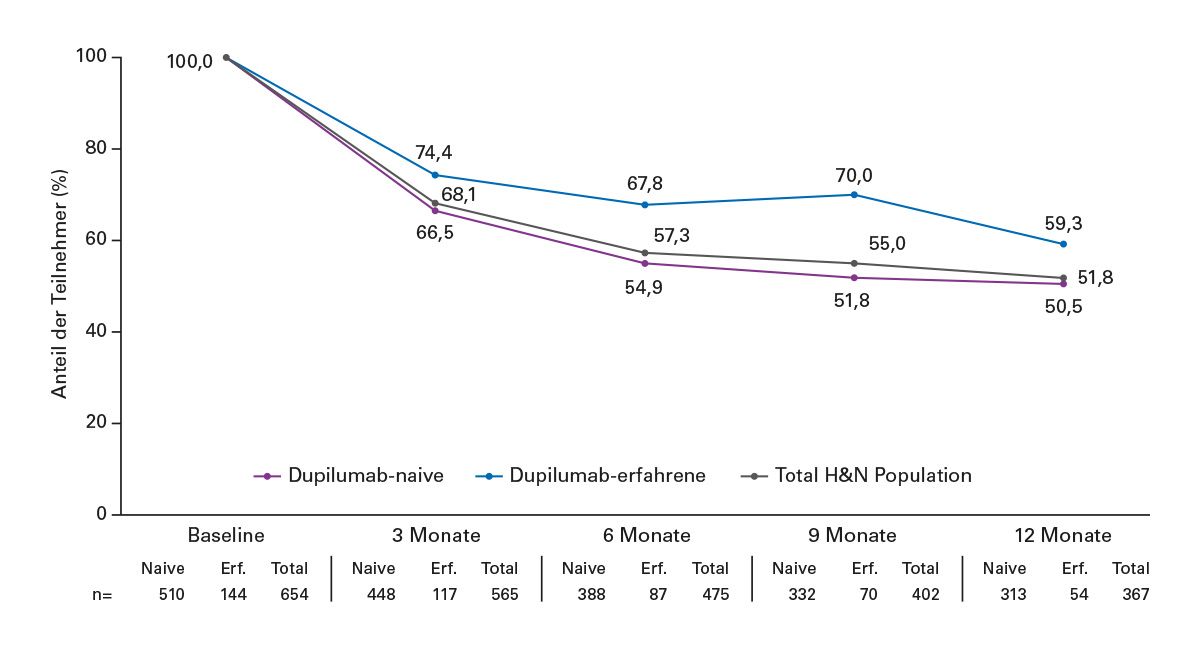
Abb. 5: TRACE (Real World):Reduktion der H&N-AD unter Tralokinumab in 12 Monaten – unabhängig von der Vortherapie mit Dupilumab
Für die Analyse der Head-Neck-Dermatitis wurden ausschließlich jene Personen berücksichtigt, die zu Beginn der Studie eine Kopf-Hals-Beteiligung aufwiesen. Im weiteren Verlauf wurde dann beurteilt, wie sich der Anteil der Betroffenen über die Zeit veränderte. Eine abfallende Kurve bedeutet also eine Abnahme der klinischen Beteiligung im Kopf-Hals-Bereich, also eine Verbesserung der AD in dieser Lokalisation.
Die Auswertung zeigt ein konsistentes Bild:
- Sowohl bei Dupilumab-naiven als auch bei Dupilumab-vorbehandelten Patientinnen und Patienten nimmt der Anteil der Betroffenen mit Head-Neck-Befall im Verlauf der zwölfmonatigen Beobachtungszeit kontinuierlich ab.
- In der Grafik erscheint die Kurve der vorher Dupilumab-erfahrenen Patientengruppe zwischenzeitlich leicht ansteigend; dieser Effekt ist jedoch nicht statistisch signifikant und ändert die Gesamttendenz nicht.
Insgesamt verdeutlichen die TRACE-Daten, dass Tralokinumab im Real-World-Setting bei der Head-Neck-Dermatitis zu einer klinisch relevanten Verbesserung führt, unabhängig davon, ob zuvor bereits Dupilumab eingesetzt wurde oder nicht. Dies spricht für eine robuste Wirksamkeit des IL-13-Inhibitors in dieser häufig therapieresistenten Sonderlokalisation.
Lebrikizumab: Wirksamkeit des zweiten IL-13-Inhibitors auf die Head-Neck-Dermatitis
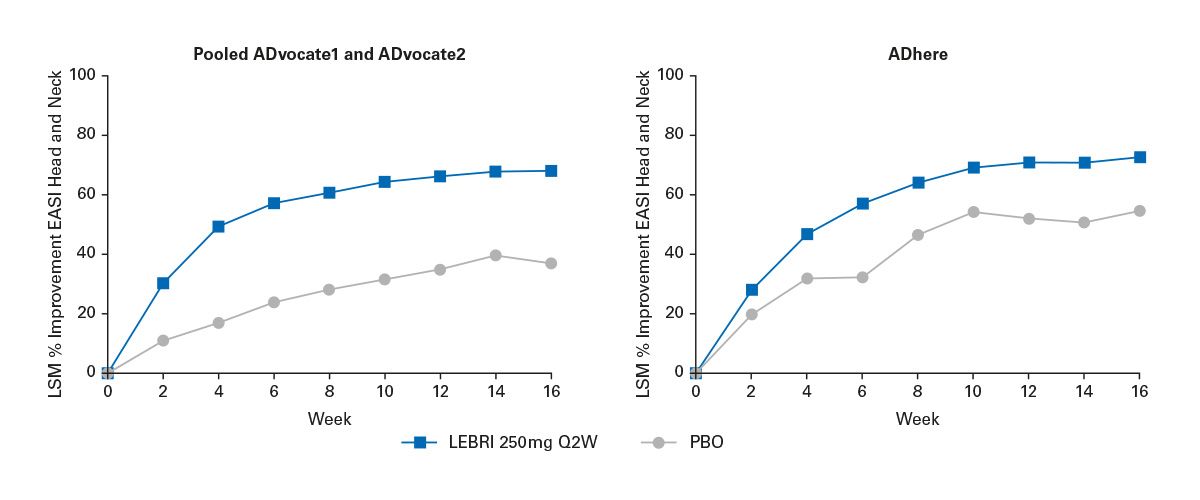
Neben Tralokinumab steht mit Lebrikizumab ein weiterer spezifischer IL-13-Inhibitor zur Verfügung, für den ebenfalls umfassende Studiendaten vorliegen. Ähnlich wie bei den ECZTRA-Studien für Tralokinumab wurden bei Lebrikizumab die Phase-3-Studien ADvocate 1 und ADvocate 2 sowie die ADhere-Studie ausgewertet.
Die ADvocate-Studien verglichen Lebrikizumab gegen Placebo, während in der ADhere-Studie Lebrikizumab in Kombination mit topischen Kortikosteroiden untersucht wurde. Die eingeschlossenen Patientinnen und Patienten wiesen – wie häufig bei Phase-3-Programmen – überwiegend eine moderate bis schwere atopische Dermatitis auf. Dies zeigt sich auch an den mittleren EASI-Werten zu Studienbeginn, die bei 30, 26 bzw 27 Punkten lagen und damit eine deutlich ausgeprägte Krankheitsaktivität dokumentieren.
In den Auswertungen wird die prozentuale Verbesserung des Head-Neck-EASI betrachtet. In den Grafiken (Abb. 7) erscheinen die Placebo-Arme in Grau, während die Lebrikizumab-Behandlungsgruppen in einem Pinkton dargestellt sind – jeweils für ADvocate 1 und 2 sowie für ADhere. Bei ADhere ist zusätzlich zu berücksichtigen, dass die Teilnehmenden eine begleitende Behandlung mit topischen Kortikosteroiden erhielten, was den Therapieeffekt beeinflussen kann.
Für die Auswertung wurde nicht der einfache arithmetische Mittelwert verwendet, sondern der sogenannte Least Squares Mean (LS-Mean). Dabei handelt es sich um einen modellbasierten Schätzwert, der die Daten unter Berücksichtigung relevanter Kovariablen – etwa Ausgangswerte oder demografische Faktoren – korrigiert. Dies ermöglicht eine robustere statistische Bewertung der tatsächlichen Behandlungseffekte.
Die Ergebnisse zeigen, dass Lebrikizumab in allen drei Studien eine deutliche und klinisch relevante Verbesserung der Head-Neck-Dermatitis bewirkte, die gegenüber Placebo konsistent überlegen war. Dies bestätigt die Bedeutung der IL-13-Blockade auch für diese besonders therapieresistente Lokalisation der atopischen Dermatitis.
Eine weitere Darstellung der Daten fängt den klinischen Nutzen präzise ein: Dort wird ausgewiesen, wie viele Patientinnen und Patienten eine Verbesserung („Improved“) oder vollständige Abheilung („Cleared“) der Kopf-Hals-Beteiligung erreichten. Die Ergebnisse sind sowohl für ADvocate 1 und 2 (oberer Teil der Grafik) als auch für die ADhere-Studie (unterer Teil) dargestellt.
Über alle drei Studien hinweg zeigt sich ein konsistenter Effekt:
Rund 60 % der Behandelten erreichten eine deutliche Besserung oder sogar eine vollständige Abheilung der Head-Neck-Dermatitis.
Diese Daten unterstreichen, dass Lebrikizumab – wie auch Tralokinumab – in der Lage ist, Ekzemveränderungen im Kopf-Hals-Bereich effektiv zu reduzieren, selbst in Patientengruppen mit moderater bis schwerer Ausgangserkrankung.
Genitale Beteiligung der atopischen Dermatitis: Relevanz im klinischen Alltag
Ein Blick in den klinischen Alltag zeigt, dass die atopische Dermatitis in ihrer schweren Ausprägung häufig mit ausgeprägten Ekzemen am gesamten Integument einhergeht. Was jedoch oft übersehen wird – und worauf die Praxis aufmerksam machen sollte – ist die Beteiligung des Genitalbereichs. Dieser wird bei der Untersuchung nicht immer routinemäßig mit inspiziert, und auch in der Anamnese wird oft nicht gezielt nach entsprechenden Beschwerden gefragt.
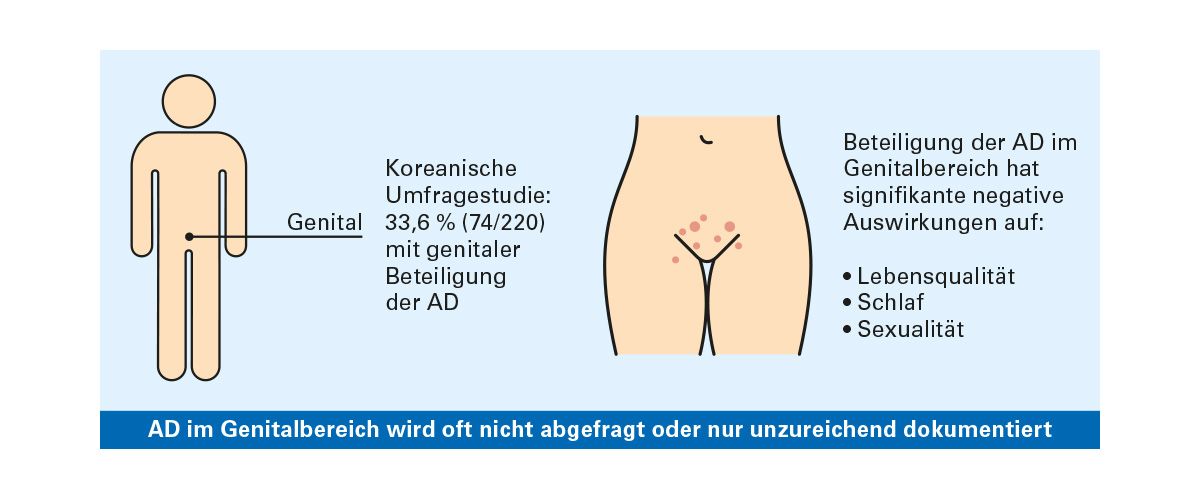
Daten aus dem TREATgermany-Register unterstreichen die Relevanz dieser Lokalisation: 17 % der Patientinnen und Patienten mit moderater bis schwerer atopischer Dermatitis weisen Ekzeme im Genitalbereich auf – also nahezu jeder Fünfte. Andere Erhebungen zeigen sogar noch höhere Werte. Eine koreanische Umfragestudie berichtete, dass fast ein Drittel der Befragten eine genitale Beteiligung angab.
Die Auswirkungen genitaler Ekzeme auf die Lebensqualität sind erheblich. Sie betreffen nicht nur Schlafqualität und Alltagsfunktion, sondern haben auch einen direkten Einfluss auf die Sexualität und können zu Schamgefühl, Vermeidung sozialer Nähe oder psychischer Belastung führen. Trotz dieser klinischen Bedeutung wird die genitale AD in der klinischen Routine häufig nicht systematisch erfragt und unzureichend dokumentiert.
Gerade deshalb ist es entscheidend, die Awareness für diese Sonderlokalisation zu erhöhen. Das routinemäßige Erfragen und gegebenenfalls gezielte Untersuchen des Genitalbereichs sollte integraler Bestandteil der Versorgung von Patientinnen und Patienten mit atopischer Dermatitis sein.
Therapieeffekte im Genitalbereich: Studiendaten aus Italien und der TRACE-Real-World-Kohorte
Für die genitale Beteiligung der atopischen Dermatitis liegen bislang nur wenige, meist kleinere Datensätze vor, die jedoch wichtige Einblicke in die Wirksamkeit systemischer Therapien geben. Eine kleine italienische Fallserie analysierte zehn Patientinnen und Patienten mit atopischer Dermatitis und genitalen Ekzemen. Zur Bewertung des Therapieansprechens wurden der IGA (Investigator’s Global Assessment) sowie ein weiterer Score von 0 bis 10 herangezogen. Über einen Zeitraum von 16 Wochen wurde dokumentiert, wie sich die Befunde entwickelten.
Die Ergebnisse zeigten eine deutliche klinische Verbesserung in der Mehrzahl der Fälle. Zu beachten ist jedoch, dass zwei Patientinnen bzw. Patienten nicht angesprochen hatten und in der publizierten Auswertung nicht berücksichtigt wurden. Diese Selektion stellt einen erheblichen methodischen Bias dar.
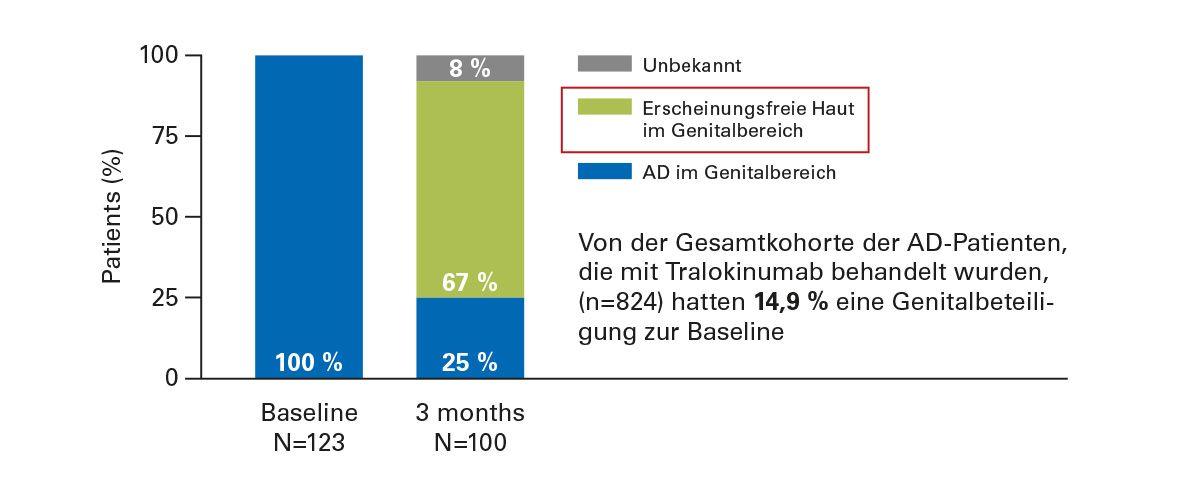
Abb. 8: TRACE (Real World): 67% der Genital-AD-Patienten sind nach drei Monaten Behandlung mit Tralokinumab erscheinungsfrei
Ein weiterer wichtiger Hinweis ergibt sich aus der TRACE-Real-World-Kohorte. Unter den 824 eingeschlossenen Patientinnen und Patienten hatten 14,9 % eine genitale Beteiligung – ein Wert, der nahezu identisch ist mit dem Anteil, der in TREATgermany beobachtet wurde. Damit liegt die Prävalenz realistisch bei etwa 15–20 % und ist folglich klinisch absolut relevant.
Zusammenfassung
Die Head-Neck-Dermatitis stellt eine der häufigsten Sonderlokalisationen der atopischen Dermatitis dar. In verschiedenen Studien und Registern wurden Prävalenzen von 80 bis 90 % bei Patientinnen und Patienten mit moderater bis schwerer AD beschrieben. Diese hohe Betroffenheit macht eine zielgerichtete diagnostische und therapeutische Aufmerksamkeit notwendig. Der Kopf-Hals-Bereich ist nicht nur funktionell und kosmetisch exponiert, sondern auch mit einer erheblichen Juckreizbelastung verbunden und kann – insbesondere bei sichtbaren Hautveränderungen – zu Stigmatisierung und psychosozialer Belastung führen.
Daten aus klinischen Registern, insbesondere den SCRATCH-/Danish-Registry-Analysen, zeigen, dass Dupilumab in dieser Lokalisation häufig nicht den gewünschten therapeutischen Effekt erzielt. Hinzu kommt das Phänomen der Dupilumab-assoziierten Head-and-Neck-Dermatitis (DAHND), bei der immunologische Analysen unter anderem eine erhöhte IL-22-Expression und verstärkte Malassezia-Sensibilisierung nachweisen konnten.
Vor diesem Hintergrund kann ein Wechsel auf einen IL-13-spezifischen Inhibitor, etwa Tralokinumab oder Lebrikizumab, für viele Betroffene von Vorteil sein.
Neben der Head-Neck-Dermatitis ist auch die genitale atopische Dermatitis ein häufig unterschätztes, aber klinisch relevantes Problem. Registerdaten und nichtinterventionelle Studien zeigen eine Prävalenz von rund 15–20 %, in einzelnen Befragungen sogar höher. Genitale Ekzeme beeinträchtigen die Lebensqualität, den Schlaf und die Sexualität erheblich. Umso wichtiger ist es, diese Region systematisch zu inspizieren, gezielt zu erfragen und in die therapeutische Bewertung einzubeziehen. Moderne Systemtherapien zeigen auch hier eine hohe Wirksamkeit.
Literaturverzeichnis
1. Heratizadeh et al. JEADV. 2020 Jun;34(6):1263–1272.
2. Vittrup et al. JEADV. 2023;37:1046–1055.
3. Czarnowicki. J Allergy Clin Immunol. 2019 Jan;143(1):1–11.
4. Zhang, Rösner, Traidl. Allergy 2021.
5. S3-Leitlinie „Atopische Dermatitis“ (AWMF-Registernr. 013-027) (2023).
6. Bayrou. 2005 Dermatology.
7. Svejgaard et al. 2004 JEADV.
8. Traidl, Heratizadeh. Dermatologie (Heidelb). 2022 Jul;73(7):529–537.
9. Ultsch M, et al. J Mol Biol. 2013;425:1330–1339.
10. Bieber T. Allergy. 2020;75:54–62.
11. Bangert et al. Nature Communications. 2024;15:2839.
12. Kozera et al. 2022 BJD.
13. Watanabe et al. 2025 JD.
14. Hanifin et al. Dermatitis. 2022 May–Jun;33(3):187–192.
15. Chovatiya R, et al. Br J Dermatol. 2024;190:49–50.
16. Chovatiya et al. 2025 Am J Clin Dermatol. doi:10.1007/s40257-025-00931-1.
17. Chovatiya R, et al. Am J Clin Dermatol. 2025 Jul;26(4):587–601.
18. Navarro-Triviño et al. Australas J Dermatol. 2024;65(3):260–265.
19. Armstrong et al. Poster Fall Clinical Dermatology Conference 2024.
20. Wiseman A, et al. Poster EADV Kongress 2025, P3435.
21. Murase et al. 2025 JDT.
22. Paolino G et al. Dermatolog Treat. 2024;35(1):2351489.
23. Serra-Baldrich E, et al. Poster Fall Clinical Dermatology Conference 2024.
24. Woo et al. 2021 JD.


Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.