Pneumologie trifft Rheumatologie: Schweres Asthma bronchiale und eosinophile Granulomatose mit Polyangiitis (EGPA)
Interessengebiete: Allgemeinmedizin und Innere Medizin, Pneumologie, Rheumatologie
Diese Fortbildung beleuchtet den Zusammenhang zwischen Pneumologie und Rheumatologie anhand zweier eng miteinander verknüpfter Krankheitsbilder: dem schweren Asthma bronchiale und der eosinophilen Granulomatose mit Polyangiitis (EGPA). In der vorliegenden Fortbildung berichten eine Pneumologin und ein Rheumatologe aus ihrer klinischen Praxis und verdeutlichen die Bedeutung eines engen interdisziplinären Vorgehens. Ziel ist es, behandelnden Ärztinnen und Ärzten praxisrelevante Entscheidungshilfen für den Umgang mit komplexen eosinophilen Erkrankungen zu geben.
Kursinhalt
Inhaltsverzeichnis
Einleitung
Schweres Asthma bronchiale ist mehr als nur eine Variante des „normalen“ Asthmas. In bestimmten Fällen kann es Ausdruck oder Vorläufer einer systemischen Erkrankung sein. Besonders hervorzuheben ist in diesem Zusammenhang die eosinophile Granulomatose mit Polyangiitis (EGPA), eine seltene Form der ANCA-assoziierten Vaskulitiden. Diese beginnt häufig mit einem chronisch persistierenden Asthma bronchiale und kann in ihrer Spätphase eine systemische Entzündung mit multisystemischer Organbeteiligung hervorrufen.
Die Herausforderung in der klinischen Praxis besteht darin, die Übergänge zwischen schwerem eosinophilem Asthma und einer beginnenden systemischen Erkrankung frühzeitig zu erkennen und therapeutisch zu adressieren.
Definition und Diagnostik
Schweres Asthma bronchiale
Das Asthma bronchiale stellt eine heterogene, chronisch-entzündliche Erkrankung der Atemwege dar, die durch eine bronchiale Hyperreagibilität, eine variable bronchiale Obstruktion und rezidivierende Symptome wie Husten, Atemnot und Brustenge gekennzeichnet ist [1]. In der Regel ist die Obstruktion reversibel, insbesondere bei leichteren Verlaufsformen. Die Prävalenz von Asthma liegt in Deutschland bei etwa 8,6 %, mit einer steigenden Tendenz in den letzten Jahrzehnten. Die meisten Patientinnen und Patienten sprechen gut auf inhalative Therapieformen an.
Die Diagnose des Asthmas bleibt in erster Linie eine klinische, gestützt durch typische Symptomkonstellationen und die Ergebnisse der Lungenfunktionsdiagnostik.
Neben der klassischen reversiblen Obstruktion gewinnen Biomarker zunehmend an Bedeutung: exhaliertes Stickstoffmonoxid (FeNO) sowie die Anzahl eosinophiler Granulozyten im Blut. Ein FeNO-Wert > 25 ppb gilt als Hinweis auf eine TH2-vermittelte Entzündung [2] (Abb. 1). Eine Eosinophilenzahl von über 300/µl gilt als prädiktiver Marker für ein gutes Ansprechen auf bestimmte Biologika [1].
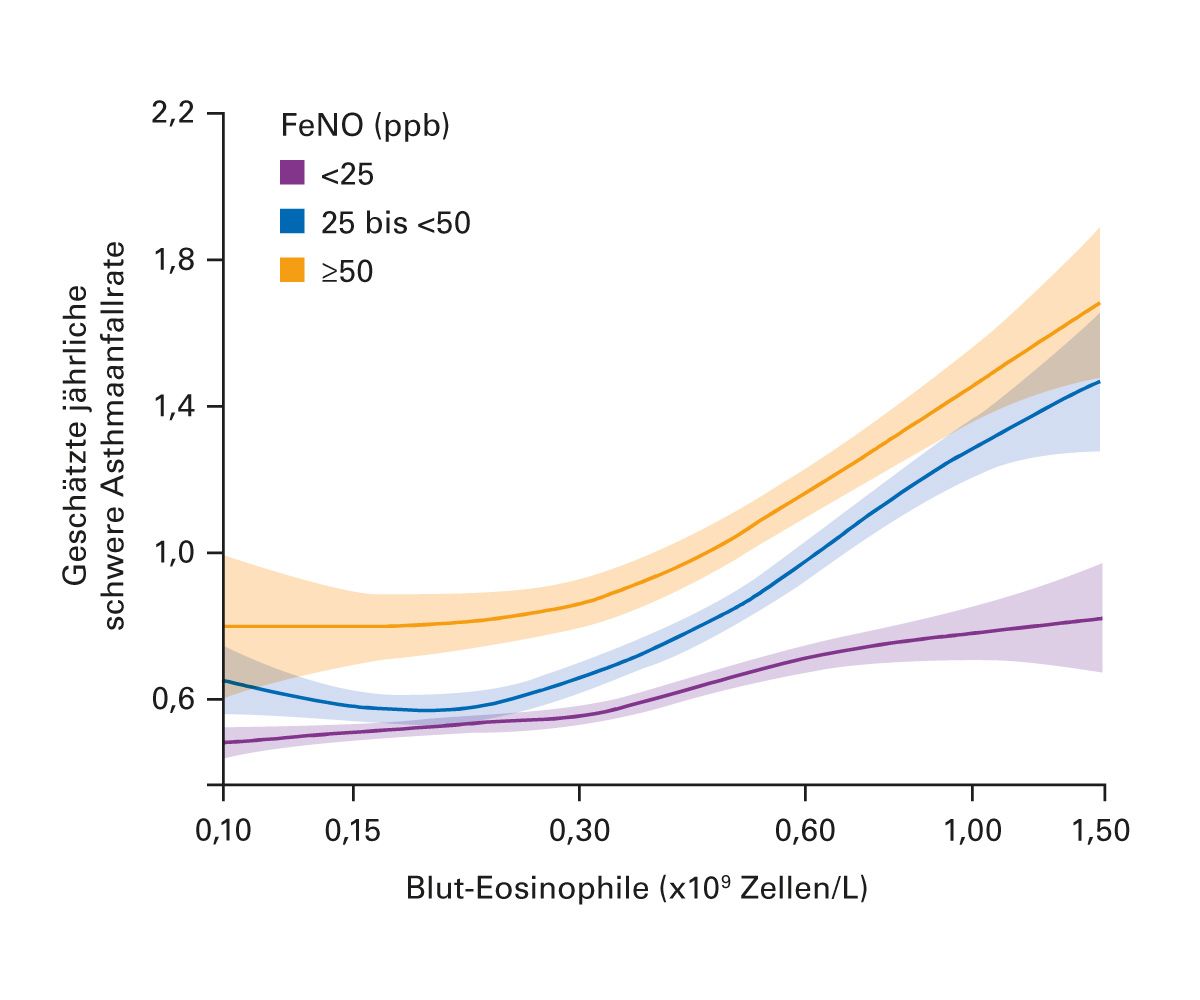
Abb. 1: Häufigkeit von Exazerbationen in Abhängigkeit von der Eosinophilenzahl und dem FeNO-Wert [5].
Von hoher praktischer Relevanz ist auch das Therapieansprechen auf inhalative Kortikosteroide (ICS). Ein positives Ansprechen kann zur Bestätigung der Diagnose beitragen, insbesondere wenn funktionelle Nachweise nicht eindeutig sind.
Problematisch wird es bei jenen Patienten, bei denen trotz leitliniengerechter, maximaler inhalativer Therapie keine ausreichende Kontrolle erzielt wird. In diesen Fällen sprechen wir von einem schweren Asthma bronchiale. Die European Respiratory Society (ERS) definiert schweres Asthma als eine Erkrankung, die trotz einer Therapie mit hochdosierten ICS und weiteren Medikamenten weiterhin unkontrolliert ist oder deren Kontrolle nur durch eine höher dosierte systemische Glukokortikoidgabe erreicht werden kann [3,4]. Der Anteil dieser schwer betroffenen Patientengruppe liegt bei etwa 4 % aller Asthmatiker [5] (Abb. 2).
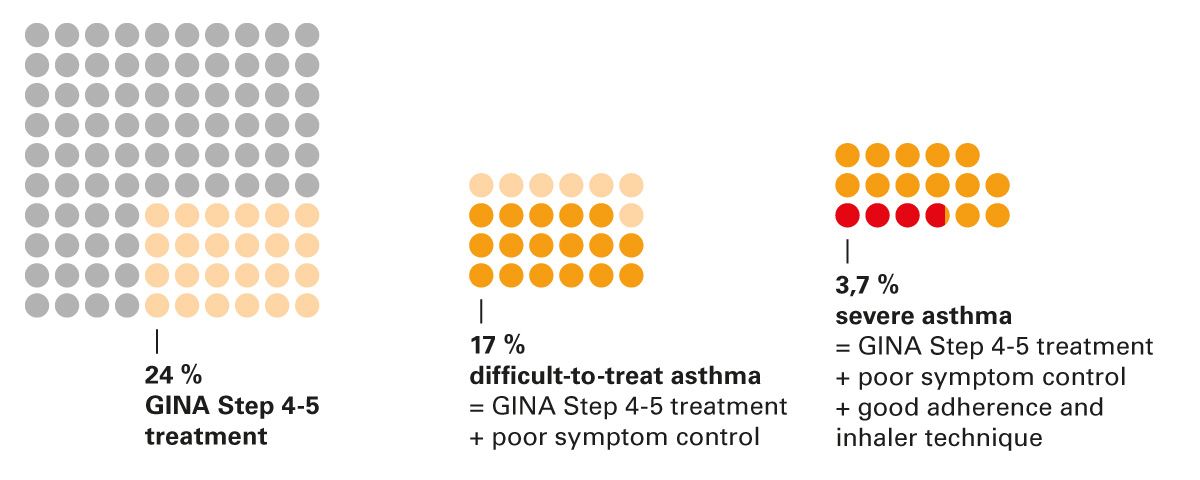
Abb. 2: Häufigkeit von schwer zu behandelndem und schwerem Asthma [5]. Übersetzungen: GINA Stufe 4-5, schwer zu behandelndes Asthma = GINA Stufe 4-5 + keine ausreichende Symptomkontrolle; schweres Asthma = GINA Stufe 4-5 + keine ausreichende Symptomkontrolle + gute Adhärenz und Inhalationstechnik
EGPA: Wenn aus Asthma eine systemische Erkrankung wird
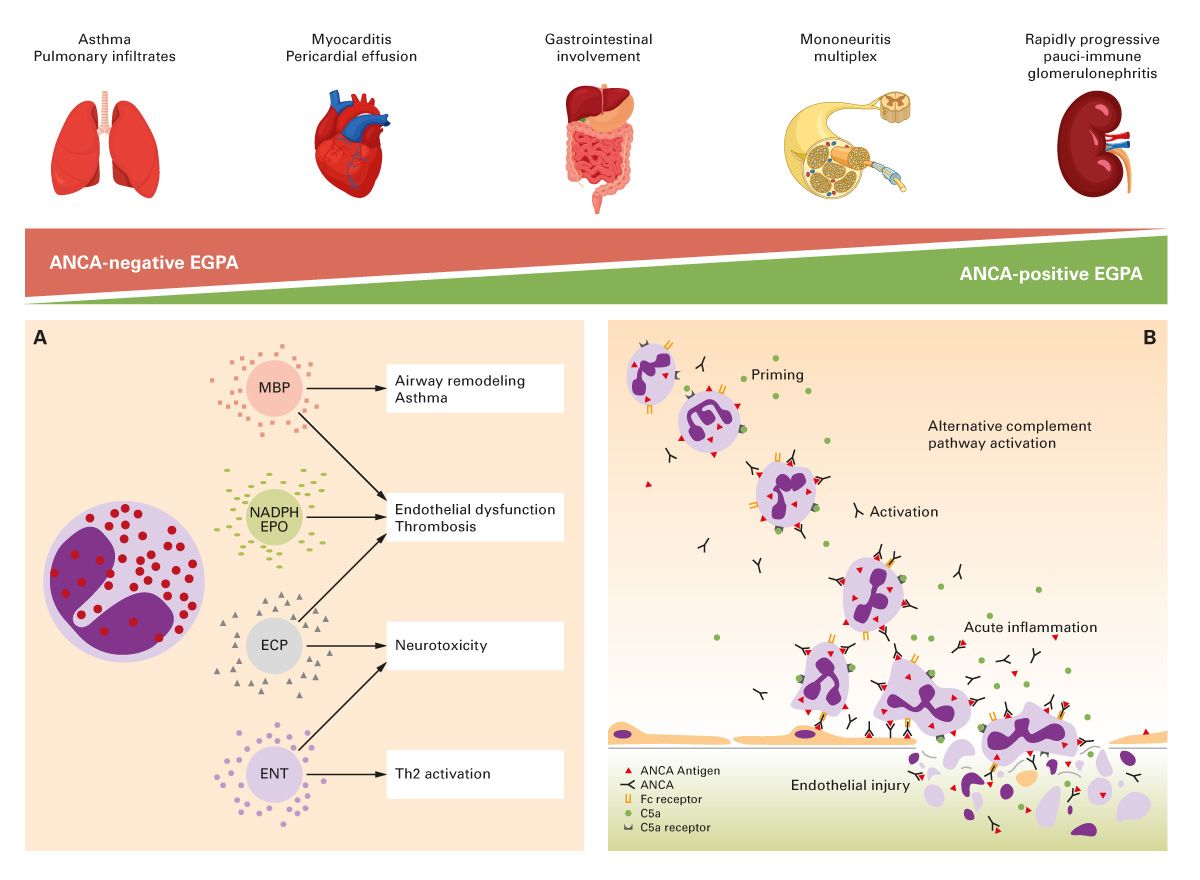
Die eosinophile Granulomatose mit Polyangiitis (EGPA), ehemals als Churg-Strauss-Syndrom bekannt, stellt eine seltene, aber potenziell schwerwiegende Erkrankung aus dem Formenkreis der ANCA-assoziierten Vaskulitiden dar. Charakteristisch ist eine triadische Verlaufsform: Zunächst manifestiert sich die Erkrankung meist als schweres, persistierendes Asthma bronchiale, gefolgt von einer Phase ausgeprägter eosinophiler Infiltration in peripherem Blut und Organen. In der dritten Phase kommt es zur Entwicklung einer systemischen, nekrotisierenden Vaskulitis kleiner bis mittelgroßer Gefäße mit multipler Organbeteiligung [6] (Abb. 3).
Die EGPA betrifft in Deutschland geschätzt weniger als 5 von 100.000 Personen. Die Erkrankung kann in jedem Lebensalter auftreten, manifestiert sich jedoch gehäuft zwischen dem 40. und 60. Lebensjahr. Eine Geschlechtspräferenz besteht nicht. Die ätiologische Genese ist noch nicht abschließend geklärt. Diskutiert wird ein Zusammenspiel genetischer Disposition, immunologischer Dysregulation sowie exogener Faktoren (z. B. Allergene, Medikamente).
Typische klinische Manifestationen umfassen [7]:
- Pulmonale Infiltrate: flüchtige oder persistierende Infiltrate, zumeist bilateral im CT sichtbar
- Kutane Vaskulitis: palpable Purpura, insbesondere an den Unterschenkeln
- Neurologische Beteiligung: asymmetrische Mononeuritis multiplex oder distale symmetrische Polyneuropathie
- Herzbeteiligung: Endomyokarditis, Kardiomyopathie, Perikarditis oder Rhythmusstörungen
- Renale Beteiligung: Glomerulonephritis mit Proteinurie und/oder Hämaturie
In etwa einem Drittel der Fälle ist ein p-ANCA (meist gegen Myeloperoxidase/MPO) nachweisbar. Der ANCA-Status kann Hinweise auf den vorherrschenden Entzündungsmechanismus geben: ANCA-positive Patienten zeigen häufiger eine Vaskulitis mit glomerulärer oder neurologischer Beteiligung, während ANCA-negative Patienten eher durch eosinophile Infiltration (z. B. pulmonal oder kardial) auffallen.
Die Diagnostik umfasst eine Kombination aus klinischer Symptomatik, laborchemischen Parametern (z. B. Blutbild mit Eosinophilie, CRP, ANCA), bildgebender Verfahren (CT-Thorax, Sinus-CT, Herz-MRT), funktionellen Untersuchungen (z. B. Nervenleitgeschwindigkeit) und – wenn möglich – histologischer Sicherung durch Biopsie betroffener Organe oder Hautveränderungen [7].
Die Klassifikation der EGPA erfolgt nach den ACR/EULAR-Kriterien, bei denen neben der Eosinophilie (mindestens 1000/µl) und dem Asthma auch Organmanifestationen und der Nachweis ANCA-assoziierter Autoantikörper eine Rolle spielen. Diese Kriterien sind primär für Studienzwecke konzipiert, haben aber auch im klinischen Alltag Bedeutung [8].
Die Abgrenzung der EGPA von anderen hypereosinophilen Syndromen, Infektionen, neoplastischen Erkrankungen oder allergischen Systemerkrankungen ist essenziell und erfordert meist eine interdisziplinäre Abklärung. Entscheidend ist hierbei, frühzeitig an die Möglichkeit einer EGPA zu denken, insbesondere bei Patienten mit schwerem eosinophilen Asthma, multiplen Organbeschwerden und persistierender Eosinophilie trotz Kortikosteroidtherapie [7, 8].
Therapie
Therapie des schweren Asthma bronchiale
Zur Therapie gemäß der deutschen S2K-Leitlinie [1] und der NVL [2] gehören frühzeitiger und regelmäßiger Einsatz inhalativer Kortikosteroide, auch bei leichtem Asthma.
Unkontrolliertes schweres Asthma stellt eine Hochrisiko-Situation mit erhöhter Morbidität und Mortalität dar [1]. Die aktuelle Leitlinie unterstreicht die Notwendigkeit einer umfassenden diagnostischen Reevaluation bei ungenügender Symptomkontrolle unter maximaler inhalativer Therapie (ICS-Hochdosis + LABA ± LAMA).
Die Einführung von Biologika hat die Therapie des schweren Asthmas in kürzester Zeit revolutioniert und sogar die potenzielle Möglichkeit einer Remissionsinduktion bei dieser Patientengruppe eröffnet [1]. Die Mehrheit der Patient*innen profitiert von einer Biologikatherapie mit Reduktion von Exazerbationen und OCS sowie Verbesserungen von Asthmakontrolle, Asthma-bezogener Lebensqualität und Lungenfunktion. Biologika werden deshalb in der aktuellen Leitlinie als prioritäre krankheitsmodifizierende Therapieoption bei schwerem Asthma empfohlen.
Therapie der EGPA
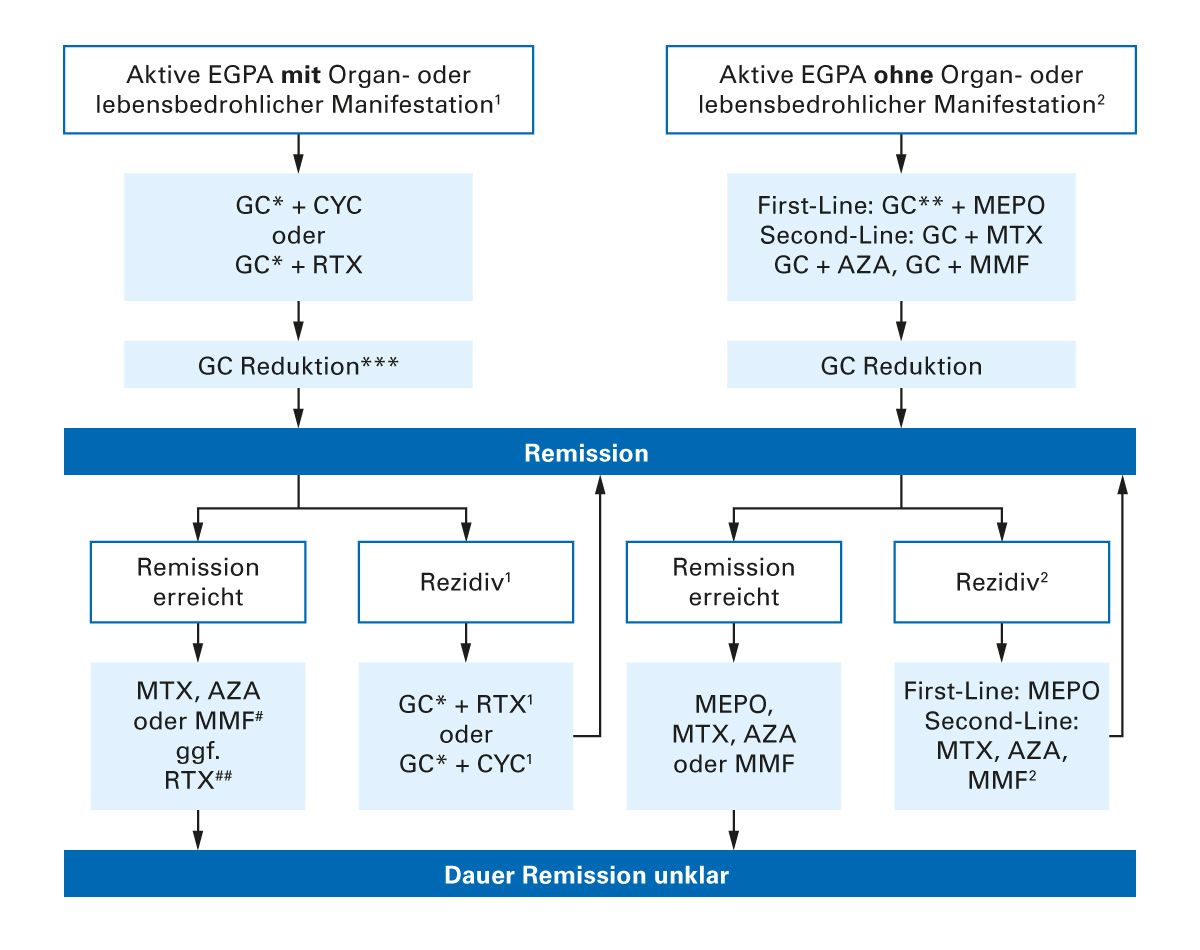
Die eosinophile Granulomatose mit Polyangiitis (EGPA) erfordert eine individuell angepasste, risikostratifizierte Therapie. Die therapeutische Entscheidung richtet sich primär nach dem Vorliegen einer lebens- oder organbedrohlichen Organmanifestation. Diese Einteilung beeinflusst sowohl die Wahl des immunsuppressiven Medikaments als auch die Dosierung und Dauer der Glukokortikoidgabe [9] (Abb. 4).
Bei Patienten mit schwerem Krankheitsverlauf, etwa bei Beteiligung des zentralen oder peripheren Nervensystems, einer Glomerulonephritis, pulmonalen Hämorrhagien oder kardiologischen Manifestationen (z. B. Myokarditis, Perikarderguss), wird eine intensive Immunsuppression empfohlen. Die initiale Glukokortikoidtherapie besteht in der Regel aus Methylprednisolon-Pulstherapie (z. B. 500–1000 mg i.v. an 3 Tagen), gefolgt von einer hohen oralen Prednisolondosis (1 mg/kg KG/Tag). Parallel wird entweder Cyclophosphamid (z. B. 6 intravenöse Pulse in 2–3-wöchigem Abstand) oder Rituximab eingesetzt, wobei Rituximab insbesondere bei ANCA-positiven Patienten vergleichbare Wirksamkeit und eine günstigere Nebenwirkungsbilanz zeigt.
Ziel der Induktionstherapie ist die Erreichung einer stabilen Remission, definiert durch das Sistieren klinischer Aktivität, Normalisierung der Entzündungsparameter sowie Rückgang der Eosinophilie. Sobald die Remission erreicht ist, wird eine Erhaltungstherapie notwendig. Diese erfolgt je nach Vortherapie mit Azathioprin, Methotrexat oder Rituximab. Bei Patienten ohne lebens- oder organbedrohliche Beteiligung (z. B. isoliertes Asthma, Rhinosinusitis, Hautmanifestationen) steht heute die Therapie mit zielgerichteten Biologika im Vordergrund [9] (Abb. 4).
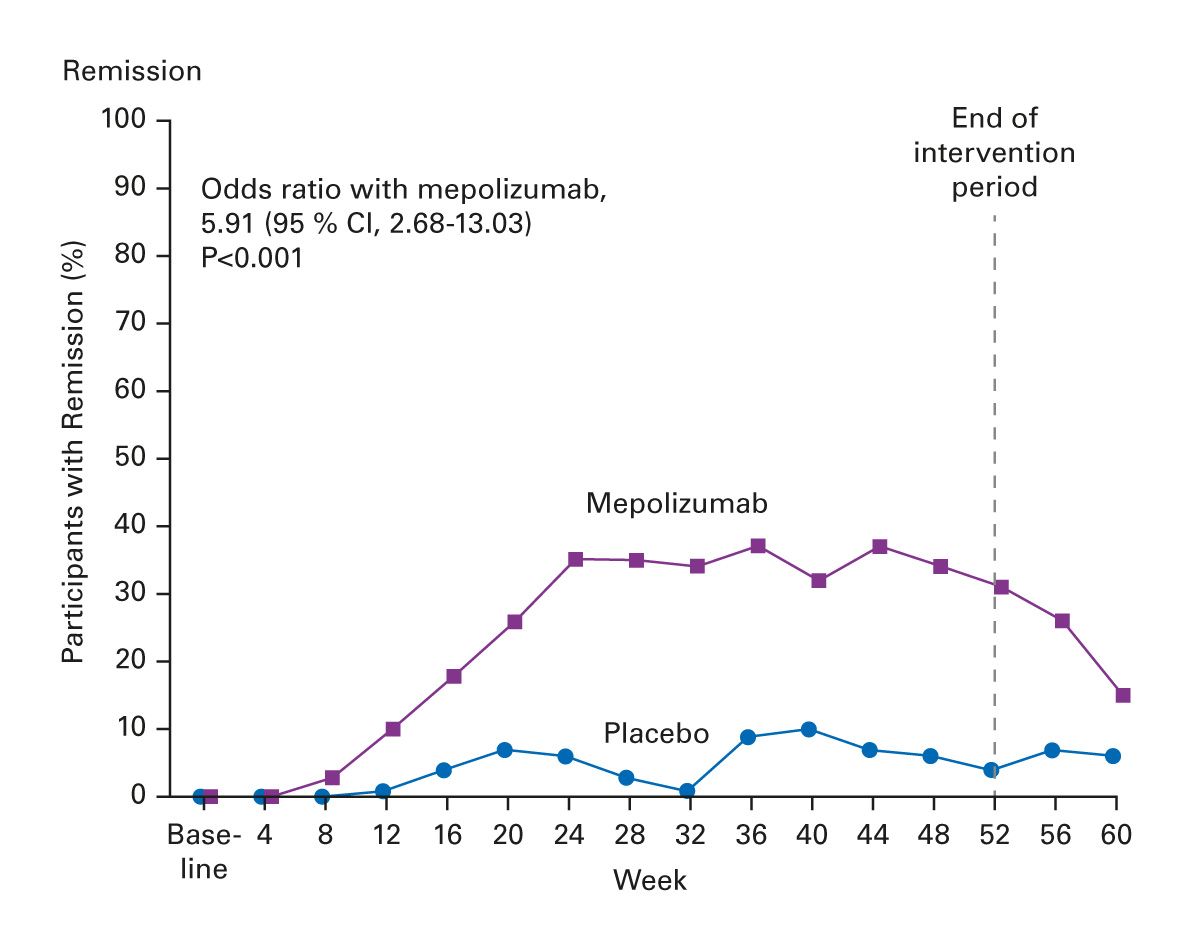
Mepolizumab, ein Anti-IL-5-Antikörper, wurde in einer placebokontrollierten Phase-III-Studie speziell für die EGPA untersucht und ist in Europa zur Behandlung dieser Indikation zugelassen [10] (Abb. 5). Die Studie zeigte eine signifikant verlängerte Remissionsdauer sowie eine Reduktion der Steroiddosis.
Hier zeigte die MANDARA-Studie, dass Benralizumab im direkten Vergleich zu Mepolizumab bei EGPA eine höhere Rate an vollständiger Steroidfreiheit erreichen konnte (41,7% vs. 25,5%)[15].
In der Praxis empfiehlt sich bei Patienten mit nicht-schwerem Verlauf die rasche Initiierung einer Biologikatherapie in Kombination mit einer niedrig dosierten Glukokortikoidgabe. Die kontinuierliche Evaluation des Therapieansprechens erfolgt anhand klinischer Aktivitätsindizes (z. B. Birmingham Vasculitis Activity Score, BVAS), Entzündungswerte (CRP, BSG), Eosinophilenzahl sowie dem subjektiven Befinden der Patientinnen und Patienten.
Ein Therapieziel bei allen Formen der EGPA bleibt neben der Remission die Reduktion der kumulativen Glukokortikoiddosis. Idealerweise sollte nach spätestens 6–12 Monaten eine steroidfreie Krankheitskontrolle erreicht werden. Biologika haben hier eine wichtige Rolle als steroid-sparende Strategien eingenommen. Dies gilt sowohl für das eosinophile Asthma als auch für die nicht-schwere EGPA.
Diskussion: Kortikosteroide – notwendig aber risikobehaftet
Systemische Glukokortikoide stellen seit Jahrzehnten eine tragende Säule in der Behandlung sowohl des schweren Asthmas als auch systemischer Autoimmunerkrankungen wie der EGPA dar. Sie wirken schnell und potenziell lebensrettend, insbesondere bei akuten Exazerbationen oder bei schweren Organmanifestationen, wie z. B. einer rasch progredienten Glomerulonephritis, pulmonalen Infiltraten oder einer eosinophilen p-ANCA.
Dennoch ist der langfristige Einsatz systemischer Kortikosteroide mit einer Vielzahl an Risiken und Nebenwirkungen verbunden, die sowohl die Lebensqualität der Patientinnen und Patienten als auch die Prognose beeinträchtigen können. Hierzu zählen unter anderem Osteoporose, arterielle Hypertonie, Diabetes mellitus, Gewichtszunahme, Katarakt, erhöhte Infektanfälligkeit sowie eine beeinträchtigte Wundheilung.
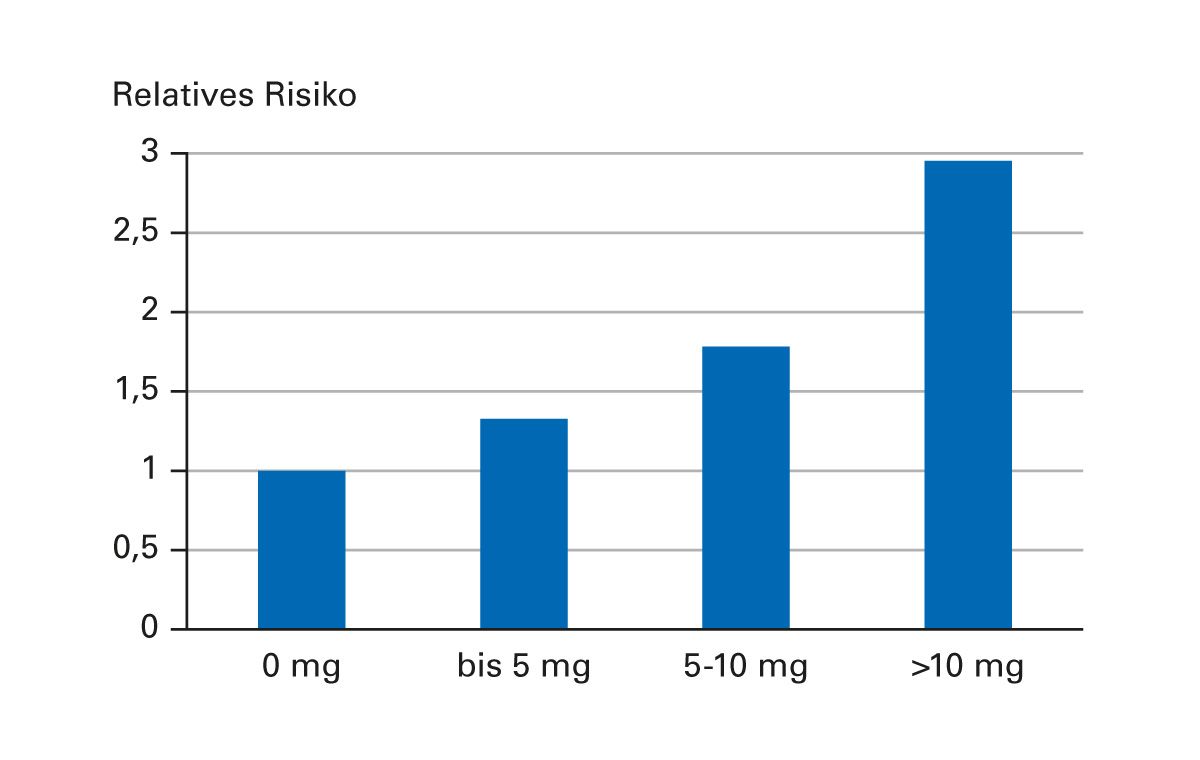
In der Rheumatologie ist gut dokumentiert, dass bereits eine tägliche Dosis von >5 mg Prednisolon mit einem signifikant erhöhten Risiko für schwere Infektionen assoziiert ist [11] (Abb. 6). Die Datenlage aus Kohortenstudien zeigt, dass insbesondere bei gleichzeitigen Komorbiditäten (z. B. chronischer Niereninsuffizienz oder Diabetes mellitus) das Infektionsrisiko unter Glukokortikoidtherapie nochmals deutlich ansteigt.
Auch die kardiovaskuläre Sicherheit ist relevant: Eine kumulative Einnahme von systemischen Glukokortikoiden ist mit einem erhöhten Risiko für Myokardinfarkte, Schlaganfälle und Herzinsuffizienz assoziiert [12]. Die Vermeidung einer chronischen Steroidbelastung ist daher nicht nur aus Lebensqualitätsgründen, sondern auch aus prognostischer Sicht von hoher Bedeutung.
Neben den systemischen Kortikosteroiden sind auch inhalative Kortikosteroide (ICS), insbesondere in hohen Dosierungen, nicht ohne systemische Effekte. Studien zeigen, dass tägliche Dosierungen von >1000 µg Fluticason äquivalent mit einer relevanten systemischen Resorption einhergehen können. Diese können sich u. a. auf die Nebennierenfunktion auswirken, was in Einzelfällen zu einer Nebennierenrindeninsuffizienz führt.
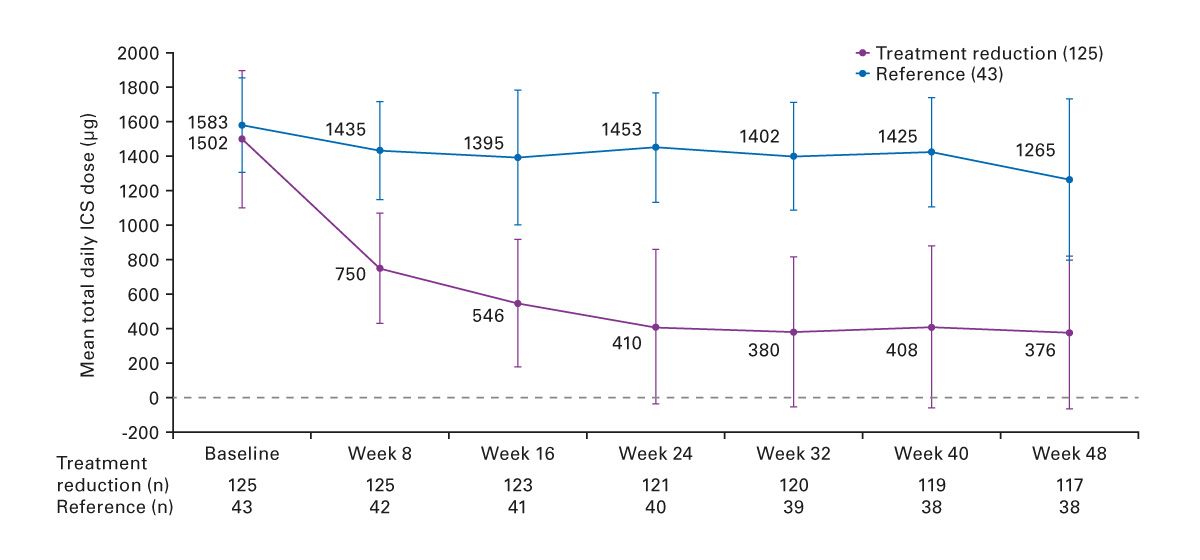
Die Verfügbarkeit moderner Biologika hat die Therapielandschaft entscheidend verändert. Diese zielen spezifisch auf inflammatorische Zytokine oder deren Rezeptoren ab, wie z. B. IL-5, IL-5R oder IL-4Rα, und ermöglichen nicht nur eine Reduktion der oralen Glukokortikoide, sondern teilweise auch eine Absenkung der ICS-Dosierung. Studien wie PONENTE (Abb. 7) und SHAMAL (Abb. 8) konnten zeigen, dass ein Großteil der Patienten unter Benralizumab erfolgreich steroidfrei werden oder die Dosis signifikant reduzieren kann. Die Reduktion sollte dabei kontrolliert und über Biomarker wie das FeNO sowie lungenfunktionelle Parameter engmaschig überwacht werden [13, 14].
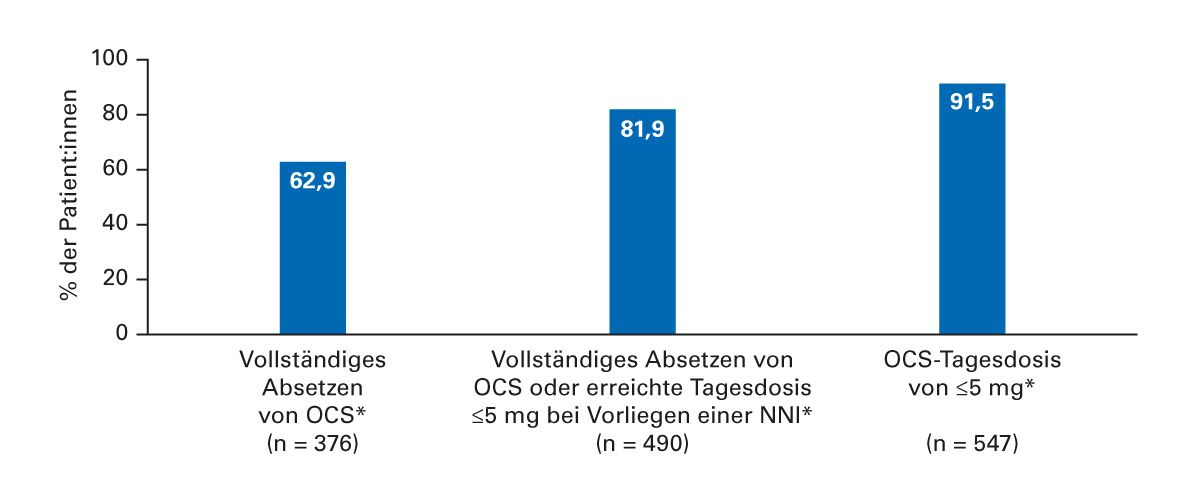
Abb. 7: OCS-Reduktion unter Biologika [13]. * Beibehaltung der OCS-Dosis über ≥ 4 Wochen, ohne dass sich das Asthma verschlechterte.
In der klinischen Praxis bedeutet dies, dass eine frühzeitige Evaluation der Glukokortikoidabhängigkeit und ein Übergang in eine Biologikatherapie angestrebt werden sollte, sobald sich ein entsprechender Phänotyp (z. B. eosinophiles Asthma, EGPA ohne Organbedrohung) abzeichnet. Ziel ist es, eine tägliche Prednisolondosis von ≤ 5 mg zu erreichen oder die Therapie gänzlich steroidfrei zu gestalten. Die strategische Herausforderung liegt darin, Patientinnen und Patienten nicht zu früh, aber auch nicht zu spät in diese Therapiestrategie zu überführen.
Fazit
Schweres Asthma bronchiale stellt nicht nur eine therapeutische Herausforderung dar, sondern kann auch Ausdruck einer zugrunde liegenden systemischen Erkrankung wie der EGPA sein. Daher ist insbesondere bei persistierendem Asthma trotz leitliniengerechter Therapie sowie bei erhöhten Eosinophilen-Werten im Blut eine differenzialdiagnostische Abklärung notwendig. Die eosinophile Granulomatose mit Polyangiitis ist zwar selten, kann jedoch im Verlauf potenziell lebensbedrohliche Organmanifestationen entwickeln. Eine frühe Diagnose ist entscheidend, um systemische Komplikationen zu vermeiden und eine effektive Therapie einzuleiten.
Die interdisziplinäre Zusammenarbeit zwischen Pneumologie, Rheumatologie und gegebenenfalls Hämatologie ist essenziell, um Patienten mit schwerem eosinophilem Asthma und Verdacht auf EGPA umfassend zu betreuen. Diagnostische Hinweise ergeben sich insbesondere aus dem Differenzialblutbild, der ANCA-Testung, bildgebender Diagnostik und ggf. histologischer Sicherung. Die therapeutische Strategie sollte individuell am klinischen Bild und der Organbeteiligung ausgerichtet werden: Während bei schweren Verläufen Immunsuppressiva indiziert sind, können bei leichteren Verläufen zielgerichtete Biologika eine wirksame und zugleich steroidminimierende Behandlungsoption darstellen.
Das übergeordnete Ziel besteht darin, Remission zu erreichen und die Glukokortikoidlast möglichst gering zu halten, um Folgeerkrankungen durch chronische Steroidtherapie zu vermeiden. Die moderne Biologika-Therapie eröffnet hierfür neue Perspektiven sowohl in der Asthma- als auch in der Vaskulitisbehandlung. Ein differenziertes, phänotypbasiertes Management sowie eine vorausschauende Therapieplanung sind für den langfristigen Behandlungserfolg entscheidend.
Kasuistiken
Kasuistik 1: Die pneumologische Perspektive
Die erste Fallvorstellung betrifft eine 72-jährige Patientin mit seit Jahrzehnten bestehendem Asthma bronchiale. Trotz einer leitliniengerechten, dreifachen inhalativen Therapie (ICS, LABA, LAMA) war die Patientin klinisch schlecht kontrolliert. Sie klagte über persistierende Luftnot und Husten. Bemerkenswert war eine langjährige orale Kortikosteroidtherapie mit täglich bis zu 40 mg Prednisolon, was retrospektiv betrachtet ein Warnsignal hätte sein sollen. Aufgrund einer im Verlauf aufgetretenen Nebennierenrindeninsuffizienz wurde sie stationär aufgenommen.
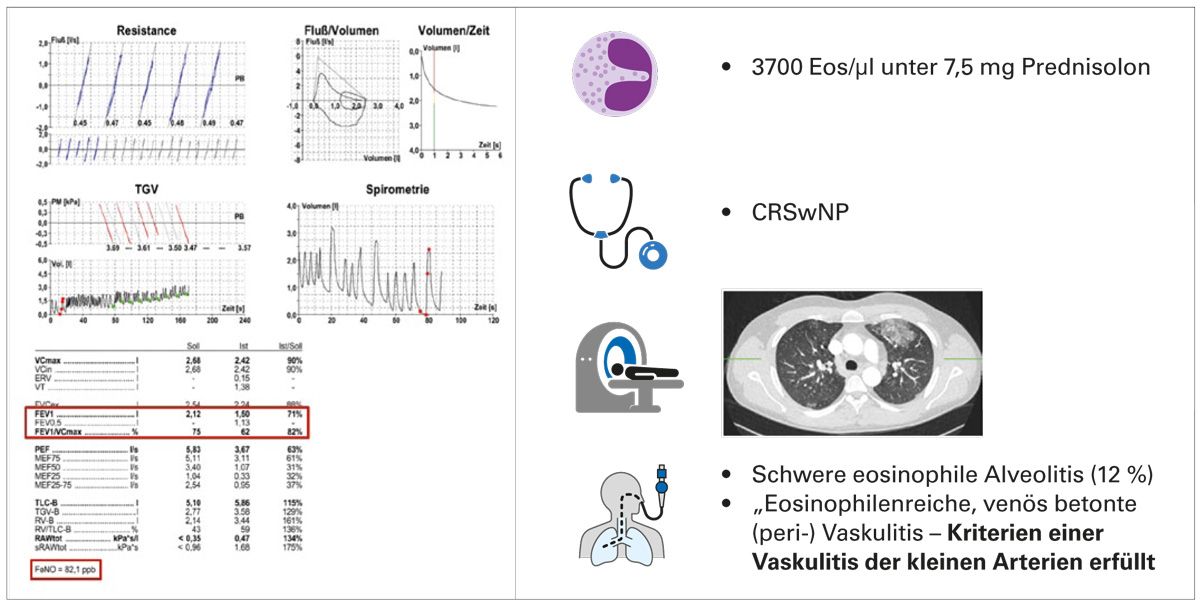
In der Funktionsdiagnostik zeigte sich eine mittelgradige Obstruktion (FEV1 bei 71 %, Tiffeneau-Index 62 %), das FeNO war mit 82 ppb deutlich erhöht. Trotz der Kortisondauertherapie fand sich eine ausgeprägte Hypereosinophilie mit 3700 Eosinophilen/µl. Die Anamnese ergab zusätzlich eine chronische Rhinosinusitis mit Nasenpolypen (Abb. 9).
Eine thorakale CT ergab Milchglasinfiltrate, woraufhin eine Bronchoskopie mit bronchoalveolärer Lavage und Kryo-Biopsie durchgeführt wurden. Dabei zeigte sich eine ausgeprägte eosinophile Alveolitis sowie histologisch eine perivaskuläre, venös betonte Infiltration mit Eosinophilen, was den Verdacht auf eine EGPA bestätigte. Die hämatologische Abklärung (u. a. Knochenmarkspunktion) ergab keinen Hinweis auf eine klonale Genese. Eine kardiale Beteiligung konnte ausgeschlossen werden.
Die Patientin erhielt daraufhin eine zielgerichtete Biologikatherapie mit subkutan injiziertem Benralizumab. Im Verlauf besserte sich die Lungenfunktion signifikant (FEV1-Anstieg auf 84 %), das FeNO sank unter die Normgrenze (<25 ppb) und klinisch berichtete die Patientin eine deutliche Symptomverbesserung. Aufgrund der Nebennierenrindeninsuffizienz wurde die Prednisolontherapie auf 7,5 mg belassen.
Kasuistik 2: Die rheumatologische Perspektive
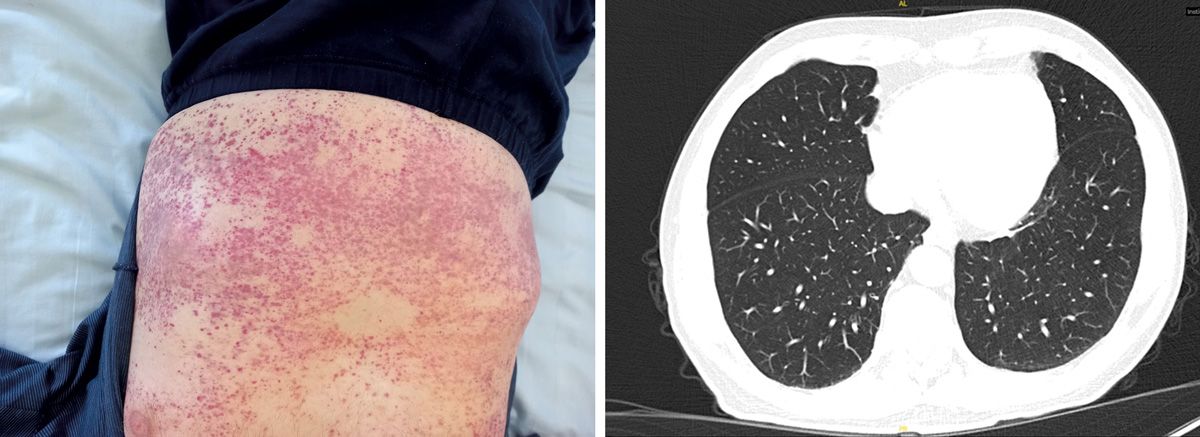
Ein 51-jähriger Mann stellte sich mit ausgeprägter Abgeschlagenheit, subfebrilen Temperaturen, Muskelschmerzen sowie Kribbelparästhesien und Taubheitsgefühlen in den Füßen in der Notaufnahme vor. In der Anamnese fanden sich ein über 30 Jahre bestehendes Asthma bronchiale, eine chronische Rhinosinusitis sowie eine drei Monate zuvor erfolgte Polypektomie.
Laborchemisch zeigte sich ein CRP von 133 mg/l, eine Leukozytose sowie eine periphere Eosinophilie von 4500/µl. Der MPO-ANCA war positiv. Eine dermatologische Inspektion ergab frische sowie abgeblasste palpable Purpura an den Unterschenkeln. Radiologisch zeigten sich keine pulmonalen Infiltrate, jedoch eine ausgeprägte chronische Sinusitis (Abb. 10). Die histologische Aufarbeitung der entfernten Polypen ergab eine eosinophile Infiltration. Elektrophysiologisch konnte eine symmetrische axonale Polyneuropathie nachgewiesen werden.
Die Diagnose EGPA war damit nach den Klassifikationskriterien gesichert. Aufgrund der neurologischen Beteiligung und raschen Progredienz wurde eine schwere Verlaufsform angenommen. Es erfolgte eine Remissionsinduktion mit Cyclophosphamid (6 Zyklen) sowie anschließend eine Erhaltungstherapie mit Rituximab.
Der Patient erreichte eine komplette Remission. Die Beschwerden bildeten sich weitgehend zurück, lediglich minimale neurologische Residuen persistierten. Der Fall unterstreicht die Bedeutung eines frühen therapeutischen Einschreitens bei systemischer EGPA.
Literatur
- Lommatzsch M et al. S2k-Leitlinie Fachärztliche Diagnostik und Therapie von Asthma 2023. AWMF Registernummer 020 – 009. Im Internet: https://register.awmf.org/de/leitlinien/detail/020-009
- Meulmeester FL et al. Inflammatory and clinical risk factors for asthma attacks (ORACLE2): a patient-level meta-analysis of control groups of 22 randomised trials. Lancet Respir Med 2025; 13: 505-516
- Nationale VersorgungsLeitlinie Asthma 2024. Im Internet:
- LaForce C et al. As-Needed Albuterol–Budesonide in Mild Asthma. N Engl J Med 2025; 393: 113-124.
- Venkatesan P et al. 2025 GINA report for asthma. Lancet Respir Med 2025; 13, e41-e42
- Fagni F et al. Eosinophilic Granulomatosis With Polyangiitis: Dissecting the Pathophysiology Front Med 2022; 8: 627776
- Fjolek J et al. Eosinophilic granulomatosis with polyangiitis – Advances in pathogenesis, diagnosis, and treatment. Front Med 2023; 10: 1145257
- Robson JC et al. 2022 American College of Rheumatology/European Alliance of Associations for Rheumatology classification criteria for granulomatosis with polyangiitis.Ann Rheum Dis 2022; 81: 315-320
- Schindler V, Venhoff N. Eosinophile Granulomatose mit Polyangiitis – ein Übersichtsartikel. Akt Rheumatol 2023, 48: 50-59
- Wechsler ME et al. Mepolizumab or Placebo for Eosinophilic Granulomatosis with Polyangiitis.N Engl J Med 2017; 376: 1921-1932
- Grijalva CG et al. Initiation of Tumor Necrosis Factor-α Antagonists and the Risk of Hospitalization for Infection in Patients With Autoimmune Diseases. JAMA 2011; 306: 2331-2339
- Bergstra SA et al. Efficacy, duration of use and safety of glucocorticoids: a systematic literature review informing the 2022 update of the EULAR recommendations for the management of rheumatoid arthritis. Ann Rheum Dis 2023; 82: 81-94
- Menzies-Gow A et al. Oral corticosteroid elimination via a personalised reduction algorithm in adults with severe, eosinophilic asthma treated with benralizumab (PONENTE): a multicentre, open-label, single-arm study. Lancet Respir Med 2022; 10: 47-58
- Jackson DJ et al. Reduction of daily maintenance inhaled corticosteroids in patients with severe eosinophilic asthma treated with benralizumab (SHAMAL): a randomised, multicentre, open-label, phase 4 study. Lancet 2024; 403: 271-281.
- Wechsler ME et al. Benralizumab versus Mepolizumab for Eosinophilic Granulomatosis with Polyangiitis. N Eng J Med 2024; 390(10):911–921.DOI:10.1056/NEJMoa2311155.
Bildquellen:
Titel: © Olga Zhurba – shutterstock.com




Tutorielle Unterstützung
Die tutorielle Unterstützung der Fortbildungsteilnehmer erfolgt durch unseren ärztlichen Leiter Dr. med. Alexander Voigt in Zusammenarbeit mit der arztCME-Redaktion. Inhaltliche Fragen können über das Kommentarfeld, direkt per Mail an service@arztcme.de oder via Telefon unter Tel.: +49(0)180-3000759 gestellt werden. Inhaltliche Fragen werden von unserem ärztlichen Leiter bzw. nach Rücksprache mit diesem und evtl. dem Autor auch von der arztCME-Redaktion beantwortet.
Technischer Support
Der technische Support der Online-Akademie arztCME.de erfolgt durch geschulte Mitarbeiterinnen und Mitarbeiter des Betreibers health&media GmbH unter der E-Mail-Adresse technik@arztcme.de oder via Telefon unter Tel.: 49(0)180-3000759.